Chap. N° 10 Exercices 2024 : Synthèses organiques
|
Exercices
avec
correction
Chap. N° 10

|
Synthèses organiques
Exercices 2024
Cours
Exercices
|
|
|
|
|
|
I-
Exercice : Hydrolyse d’un ester : .
1)- Énoncé.
Au cours de l'hydrolyse d'un ester réalisée dans l'acétone sont formés un
alcool et un acide carboxylique.
Le tableau d'avancement de la réaction est donné ci-dessous :
|
Équation
|
Ester
|
+ Eau (ℓ)
|

|
Acide
|
+ Alcool
|
|
État du
système
|
Avancement
|
n
(Ester)
|
n (Eau)
|
|
n (Acide)
|
n (Alcool)
|
|
État initial
(mol)
|
x =
0
|
1,00 mol
|
1,00 mol
|
0 mol
|
0 mol
|
|
État final
(mol)
|
xf
|
0,67 mol
|
0,67 mol
|
|
0,33 mol
|
0,33 mol
|
a)-
Calculer la valeur de la constante d'équilibre de la réaction à la
température de l'expérience.
-
Aide :
-
Donner l'expression littérale du
quotient de réaction à l'équilibre puis le calculer.
b)-
Déterminer le rendement de cette transformation.
-
Aide :
-
Déterminer le ou les réactif(s)
limitant(s).
-
Écrire la relation définissant le
rendement avant de réaliser l'application numérique.
c)-
À partir de cet état final de l'eau est ajoutée. Déterminer la manière
dont évolue la composition du milieu réactionnel.
-
Montrer que le quotient de
réaction, après ajout eau et avant retour à l'équilibre, est plus petit que la
constante d'équilibre.

2)- Correction.
a)-
Valeur de la constante d'équilibre de la
réaction à la température de l'expérience.
-
Expression littérale du quotient
de réaction à l'équilibre :
|
Hydrolyse →
|
|
RCO2
R’ (ℓ)
|
+ H2O
(ℓ)
|

|
RCO2H
(ℓ)
|
+ R’OH (ℓ)
|
|
Ester
|
eau
|
|
Acide
carboxylique
|
Alcool
|
|
← Estérification
|
-
Tableau d’avancement pour
l’hydrolyse :
|
Équation
|
Ester
|
+ Eau (ℓ)
|

|
Acide
|
+ Alcool
|
|
État du
système
|
Avancement
|
n
(Ester)
|
n
(Eau)
|
|
n
(Acide)
|
n
(Alcool)
|
|
État initial
(mol)
|
x =
0
|
1,00 mol
|
1,00 mol
|
0 mol
|
0 mol
|
|
État final
(mol)
|
xf
|
0,67 mol
|
0,67 mol
|
|
0,33 mol
|
0,33 mol
|
-
Réaction chimique :
a
. A
(aq) + b
. B
(aq)
 c
. C
(aq) + d
. D
(aq)
c
. C
(aq) + d
. D
(aq)
-
Par définition, le quotient de
réaction Qr
de cette réaction s’écrit :
|

|
|
Qr
|
Quotient de
réaction (sans unité)
|
|
[C]
et [D]
|
Concentration
des produits (mol . L–1)
|
|
[A]
et
[B]
|
Concentration
des réactifs (mol . L–1)
|
|
C0
|
Concentration
standard : C0 =
1,0 mol . L–1
|
►
Remarque :
-
Pour simplifier l’expression, on
omet de mettre la concentration standard C0.

-
Mais, il ne faut pas oublier que
le quotient de
réaction est une grandeur
sans unité
qui caractérise un système chimique dans un état donné :
-
Dans le cas de la réaction
d’hydrolyse d’un ester :
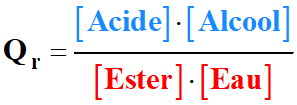
►
Remarque : dans cette
transformation, l’eau n’est pas le solvant, c’est un réactif.
-
Expression de la constante
d’équilibre K de la transformation d’hydrolyse :
-
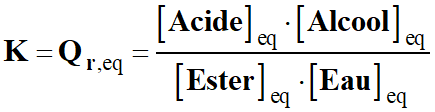
-
Simplification de l’écriture :
-
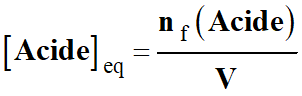
-

-
Application numérique :
-

b)-
Déterminer le rendement de cette
transformation.
-
Le rendement de la réaction
s’identifie au taux d’avancement de la réaction :
-
Tableau d’avancement :
|
Équation
|
Ester
|
+ Eau
|

|
Acide
|
+ Alcool
|
|
état
|
Avancement
x
(mol)
|
n
(Ester)
mol
|
n
(Eau)
mol
|
|
n
(Acide)
mol
|
n
(Alcool)
mol
|
|
État initial
(mol)
|
x =
0
|
1,00
|
1,00
|
0
|
0
|
|
Au cours
de la
transformation
|
x
|
1,00 – x
|
1,00 – x
|
x
|
x
|
|
Avancement
Final
(équilibre)
|
xf
|
1,00 – xf
|
1,00 – xf
|
xf
|
xf
|
|
xf
= 0,33
|
0,67
|
0,67
|
0,33
|
0,33
|
|
Avancement
maximal
|
xmax
|
1,00 – xmax
|
1,00 – xmax
|
xmax
|
xmax
|
|
xmax
= 1,00
|
0
|
0
|
1,00
|
1,00
|
-
On est en présence d’un mélange
stœchiométrique.
-
Les deux réactifs sont limitants :
xmax
= 1,00 mol
-
Avancement final :
xf
= 0,33 mol
-
Rendement de la réaction.
-
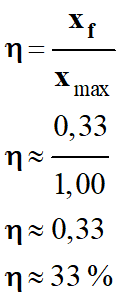
c)-
Manière dont évolue la composition du
milieu réactionnel après ajout d’eau.
-
Étude quantitative :
-
On ajoute de l’eau : exemple :
n
(Eau) = 5,00 mol
-
La quantité de matière d’ester ne
change pas : n
(Ester) = 1,00
mol
-
Tableau d’avancement :
|
Équation
|
Ester
|
+ Eau
|

|
Acide
|
+
Alcool
|
|
état
|
Avancement
x
(mol)
|
n (Ester)
mol
|
n
(Eau)
mol
|
|
n
(Acide)
mol
|
n
(Alcool)
mol
|
|
État initial
(mol)
|
x =
0
|
1,00
|
5,00
|
0
|
0
|
|
Au cours
de la
transformation
|
x
|
1,00 – x
|
5,00 – x
|
x
|
x
|
|
Avancement
Final
(équilibre)
|
xf
|
1,00 – xf
|
5,00 – xf
|
xf
|
xf
|
|
xf
= ?
|
|
|
|
|
|
Avancement
maximal
|
xmax
|
1,00 – xmax
|
5,00 – xmax
|
xmax
|
xmax
|
|
xmax
= 1,00
|
0
|
4,00
|
1,00
|
1,00
|
-
L’ester est le réactif limitant.
-
xmax
= 1,00 mol
-
Avancement final :
xf
= ?
-
La constante d’équilibre de la
réaction ne change pas :
-

-
On distribue, on simplifie et on
ordonne :
-
K . (1,00 –
xf)
. (5,00 – xf) =
x2f
-
5
K –
K .
xf
– 5
K .
xf
+
K
. x2f
= x2f
-
(1 –
K)
. x2f
+ 6
K .
xf
–
5
K
= 0
-
Or
K
≈ 0,24
-
Équation du second degré en
xf :
-
0,76
x2f
+
1,44
xf
– 1,20 ≈ 0
-
Solution acceptable et cohérente :
-

-
L’avancement final a augmenté
-
Rendement de la réaction dans ce
cas :
-

-
L’ajout d’eau favorise l’hydrolyse
d’un ester.
-
Étude qualitative :
-
Si la quantité de matière
n (Eau) augmente, le quotient
de réaction initial
Qr,i
diminue.
-
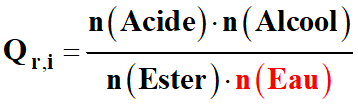
-
La quantité de matière d’eau
intervient au dénominateur
-
Il est inférieur à
Qr,eq
= K
-
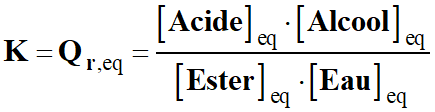

|
Hydrolyse →
|
|
RCO2
R’ (ℓ)
|
+ H2O
(ℓ)
|

|
RCO2H
(ℓ)
|
+ R’OH (ℓ)
|
|
Ester
|
eau
|
|
Acide
carboxylique
|
Alcool
|
|
← Estérification
|
-
L’ajout d’eau favorise la réaction
d’hydrolyse d’un ester.

II-
Exercice : La Bakélite :
1)- Énoncé.

La Bakélite® matière (plastique d'usage courant) est
polymère fabriqué à partir du résorcinol d’une espèce chimique A
de formule brute CH2O appartenant à la
famille des aldéhydes.
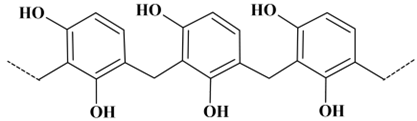
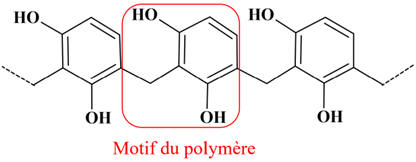
La formule d'une portion d'une macromolécule de Bakélite® est
donnée ci-dessous :
-
Macromolécule de Bakélite® :
Le résorcinol (formule topologique ci-dessous) et l'espèce A sont des
produits de synthèse issus de l'industrie pétrochimique.
-
Résorcinol : benzène-1,3-diol
(formule brute :
C6H6O2)

a)-
Écrire la formule topologique d'un isomère de constitution du
résorcinol ayant les mêmes groupes caractéristiques.
b)-
Déterminer le nom de la molécule A et écrire sa formule
topologique.
c)-
Recopier la formule de la portion de macromolécule et encadrer un
motif de ce polymère.

2)- Correction.
a)-
Formule topologique d'un isomère de constitution du résorcinol ayant
les mêmes groupes caractéristiques.
-
Isomères de constitution :
-
Définition :
-
Les isomères de constitution sont des molécules qui ont la même
formule brute mais qui différent par l’enchaînement de leurs atomes.
-
Parmi les isomères de constitution, on distingue :
-
Les isomères de chaîne : les chaînes carbonées sont différentes.
-
Les isomères de position : la position du groupe fonctionnel ou de
la double liaison sont différentes.
-
Les isomères de fonction : les groupes fonctionnels sont différents.
-
Quelques isomères de position :
-
Résorcinol : benzène-1,3-diol
(formule brute :
C6H6O2) ,
métadihydroxybenzène

-
Pyrocatéchol : benzène-1,2-diol
(formule brute :
C6H6O2) ,
orthodihydroxybenzène.
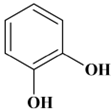
-
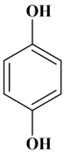
Hydroquinone : benzène-1,4-diol
(formule brute :
C6H6O2) ,
paradihydroxybenzène.
-
Isomère de fonction :
-
4-hydroxycyclohexa-2,4-dièn-1-one :
(formule brute :
C6H6O2)

-
Isomérie de chaîne (et de fonction) :
-
(2E,4E)-hexa-2,4-diènedial :
(formule brute :
C6H6O2)
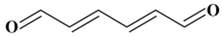
b)-
Nom de la molécule A et formule topologique.
-
Espèce chimique A appartenant à la famille des aldéhydes.
-
Formule brute CH2O :
autre formulation H2C
= O ; formule développée
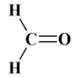
-
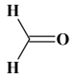
Nom : Méthanal (formaldéhyde)
-
Formule topologique :
-
On peut accepter la représentation suivante :
c)-
Formule de la portion de macromolécule et motif de ce polymère.

III-
Exercice : Saponification :
1)- Énoncé.
Du savon peut être synthétisé à partir de l’oléine C57H104O6,
constituant principal de l'huile d'olive, et de soude.
L’équation de la réaction modélisant la transformation s'écrit :
C57H104O6
+ 3 (Na+ + HO–) → 3 C17H33COONa
+HO –
CH2
–CH(OH)
– CH2
– OH
Le savon constitué d’oléate de sodium C17H33COONa.
Extrait de protocole :
-
Dans un ballon de 250
mL,
-
de l’hydroxyde de
sodium : m1 = 6,4 g
-
de l’eau
Veau = 20 mL
-
et de l’huile
d’olive : m2
= 10 g
-
sont mélangés avec
précaution.
-
De l’éthanol est
ajouté V = 10 mL (solvant)
-
Un réfrigérant à eau
est adapté au ballon
-
Le mélange est chauffé
à reflux pendant 30 min (ébullition douce).
-
Pendant la phase de
traitement, appelée « relargage », le savon précipite.
-
Les copeaux de savon
sont rincés et séchés, et un échantillon de masse
m3 = 8,5 g d’oléate de
sodium est récupéré.
DONNÉES :
-
Masse molaire :
-
Hydroxyde de sodium :
M1 = 40 g . mol–1
-
Oléine :
M2 = 885 g . mol–1
-
Oléate de sodium :
M3 = 304 g . mol–1
-
Constante d’équilibre
de la réaction : K (T)
= 1010 à la température de l’expérience.
a)-
Déterminer les quantités de matière
initiales des réactifs.
b)-
En déduire la masse maximale d'oléate de
sodium attendue dans le cas d'une transformation totale.
c)-
Exprimer puis calculer le rendement
expérimental de la synthèse.
d)-
La constante d'équilibre de la réaction
K (T) = 1010, proposer des hypothèses expliquant pourquoi
le rendement obtenu expérimentalement n'est pas égal à 1.
e)-
Certains élèves mesurent un rendement
supérieur à 1. Proposer une explication possible à ce résultat.

2)- Correction.
►
L’oléine :
-
L'oléine est le
triester du propan – 1, 2, 3 – triol (glycérol) et de l'acide oléique de formule
: C17H33COOH.
-
Acide oléique :
CH3–(CH2)7–CH=CH–(CH2)7–COOH
Contrôle
d'évolution d'une transformation chimique.
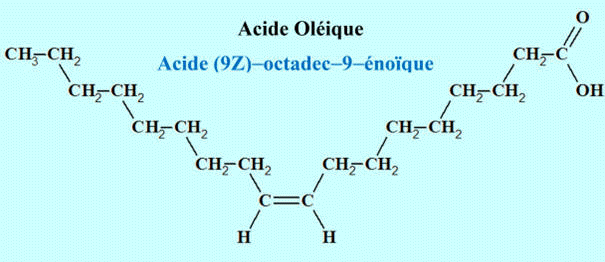
Acide (9Z) –octadec–9–énoïque

Acide (9E) –octadec–9–énoïque

-
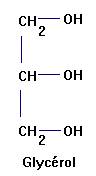
Le glycérol :
propan–1,2,3–triol

►
Schéma du montage : Le
chauffage à reflux
|
Chauffage à Reflux

|
Mélange
réactionnel :
Huile d’olive
Soude
Eau
Éthanol
|
►
Remarque :
-
On peut ajouter des
grains de pierre ponce pour réguler l’ébullition.
-
Lors de l'ébullition,
les bulles de gaz sont plus petites.
-
L’oléine et la
solution de soude ne sont pas miscibles, on agite pendant l'expérience pour
maintenir les réactifs en contact.
-
L'utilisation de
l'éthanol rend le mélange réactionnel plus homogène.
►
Rôle du chauffage à
reflux :
-
Il permet de
travailler à température élevée et ainsi d’accélérer la réaction chimique.
-
On accélère la
réaction de saponification qui est une réaction lente à température ambiante.
-
Il permet d’éviter les
pertes de réactifs et de produits.
-
Les réactifs et les
produits qui se vaporisent retombent dans le mélange réactionnel lorsqu’ils se
condensent.
-
Le reflux est assuré
par le condenseur ou le réfrigérant à eau (vertical) qui permet de condenser les
produits et les réactifs de la réaction.
-
Les produits et les
réactifs de la réaction se retrouvent ainsi dans le mélange réactionnel.
Réalisation d’une synthèse : Le chauffage à reflux
TP : Fabrication d’un savon de Marseille
Synthèse : les différentes étapes, le rendement.
Les savons.
Nettoyants pour sol
Devoir : Le savon
Contrôle d’évolution d’une réaction chimique :
a)-
Quantités de matière initiales des réactifs.
►
Équation bilan de la
réaction :

-
Quantité de matière
d’hydroxyde de sodium : n1
-
m1
= 6,4 g
-
M1
= 40 g . mol–1
-
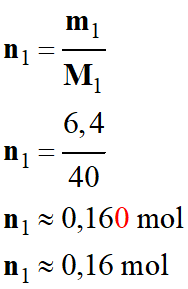
-
Quantité de matière
d’oléine : n2
-
m2
= 10 g
-
M2
= 885 g . mol–1
-
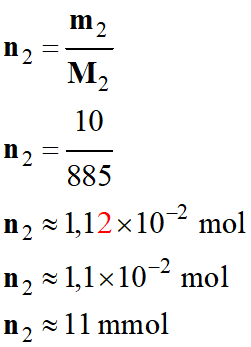
-
Tableau d’avancement : avec
notations simplifiées
|
Équation
|
Oléine
|
+ 3 (Soude)
|

|
3 Savon
|
+ Glycérol
|
|
état
|
Avancement
x
(mol)
|
n
(Oléine)
mol
|
n
(Soude)
mol
|
|
n
(Savon)
mol
|
n
(Glycérol)
mol
|
|
État initial
(mol)
|
x =
0
|
n2
= 0,011
|
n1
= 0,16
|
0
|
0
|
|
Au cours
de la
transformation
|
x
|
n2
– x
|
n1
– 3 x
|
3 x
|
x
|
|
Avancement
Final
(équilibre)
|
xf
|
n2
– xf
|
n1
– 3 xf
|
3 xf
|
xf
|
|
xf
= ?
|
|
|
|
|
|
Avancement
maximal
|
xmax
|
n2
– xmax
|
n1
– 3 xmax
|
3 xmax
|
xmax
|
|
xmax
= ?
|
|
|
|
|
b)-
Masse maximale d'oléate de sodium attendue dans le
cas d'une transformation totale.
►
Caractéristiques de la
réaction de saponification :
-
Il se produit une
réaction de saponification entre la fonction ester et les ions hydroxyde.
-
Cette réaction est
totale (K (T) = 1010)
mais elle est très lente à la température de 25 °C.
-
Il faut chauffer pour
accélérer la réaction.
►
Recherche du réactif
limitant :
-
Lors d’une
transformation totale, si l’un au moins des réactifs est entièrement consommé :
-
Il est appelé réactif
limitant.
-
C’est celui qui est
entièrement consommé à la fin de réaction.
-
Identification du
réactif limitant :
|
Équation
|
Oléine
|
+ 3 (Soude)
|
|
état
|
n
(Oléine)
mol
|
n
(Soude)
mol
|
|
État initial
(mol)
|
n2
= 0,011
|
n1
= 0,16
|
|
Coefficients
stœchiométriques
|
1
|
3
|
-
Pour connaître le
réactif limitant, il faut comparer les grandeurs :
-
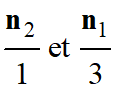
-
Or :
-
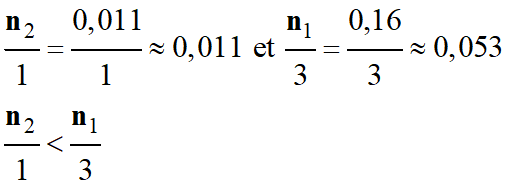
-
L’oléine est le
réactif limitant.
-
En conséquence
xmax = n2
≈ 0,011 mol
►
Autre méthode :
-
Hypothèse 1 :
on considère que l’hydroxyde de sodium est le réactif limitant :
-
n1
– 3 xmax1 = 0 => 3 xmax1 = n1
=> xmax1 = n1 / 3
-
xmax1
≈ 0,053 mol
-
Hypothèse 2 :
on considère que l’oléine est le réactif limitant :
-
n2
– xmax2 = 0 => xmax2 = n2
-
xmax2
≈ 0,011 mol
-
La valeur de xmax
est égale à la plus petite des deux valeurs.
-
xmax
= xmax2 ≈ 0,011 mol < xmax1 ≈ 0,053 mol
-
Bilan de matière :
|
Équation
|
Oléine
|
+ 3 (Soude)
|
→
|
3 Savon
|
+ Glycérol
|
|
état
|
Avancement
x
(mol)
|
n
(Oléine)
mol
|
n
(NaOH)
mol
|
|
n
(Savon)
mol
|
n
(Glycérol)
mol
|
|
État initial
(mol)
|
x =
0
|
n2
= 0,011
|
n1
= 0,16
|
0
|
0
|
|
Au cours
de la
transformation
|
x
|
n2
– x
|
n1
– 3 x
|
3 x
|
x
|
|
Avancement
Maximal
(mol)
|
xmax
|
n2
– xmax
|
n1
– 3 xmax
|
|
3 xmax
|
xmax
|
|
xmax
= 0,011
|
0
|
≈ 0,15
|
0,033
|
0,011
|
-
Masse maximale
m3max d’oléate de sodium attendue :
-
m3max
= 3 xmax . M3
-
m3max
≈ 3 ×0,011 × 304
-
m3max
≈10,3 g
-
m3max
≈10 g
c)-
Expression et calcul du rendement expérimental de la
synthèse.
-
Le rendement d’une
synthèse, noté η, est égal au
quotient de la masse de produit obtenu mexp,
par la masse maximale de produit attendu
mmax.
-
Rendement :
-
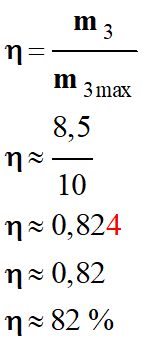
d)-
Commentaires sur le rendement
-
La constante
d'équilibre de la réaction K (T)
= 1010 ,
-
En conséquence, on
peut considérer que la transformation est totale.
-
Mais cette réaction
est très lente à la température ambiante.
-
Le fait de travailler
à une température élevée permet d’accélérer cette réaction.
-
Pour récupérer le
savon à l’état solide, il faut procéder au « relargage ».
►
Le relargage :
-
Le relargage consiste
à verser le mélange réactionnel, dans une solution aqueuse glacée de chlorure de
sodium. Le savon précipite.
-
Le relargage permet de
récupérer le savon.
-
La présence des ions
chlorure et des ions sodium diminue la solubilité du savon et facilite la
précipitation.
►
Filtration sur filtre
Büchner.
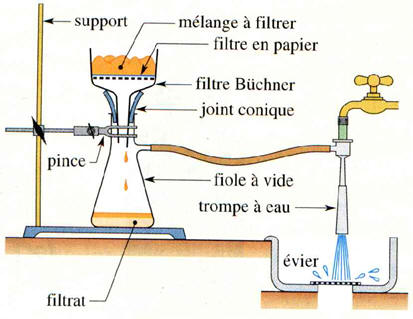
Synthèse
: Cours de première
-
Pour récupérer le
savon obtenu, on filtre sur filtre Büchner le mélange et on rince le savon à
l'eau distillée, puis on laisse sécher
sur un verre de montre.
-
Il est déconseillé
d'utiliser le savon ainsi obtenu pour se laver les mains ; il contient encore
beaucoup de soude et il est donc caustique.
►
Le rendement obtenu
expérimentalement est inférieur à 1 :
-
Il se peut que lors du
relargage la réaction de saponification n’était pas terminée.
-
Il se peut que lors du
rinçage une partie du savon s’est dissoute.
e)-
Certains élèves mesurent un rendement supérieur à 1.
-
Explication possible à
ce résultat :
►
Le rendement obtenu
expérimentalement est supérieur à 1 :
-
Le savon n’est pas
assez sec, il contient encore de l’eau.
-
La masse du savon est
alors surévaluée.
-
Il faut poursuivre
l’opération de séchage.
-
Le savon peut contenir
des impuretés.
►
Le glycérol :
-
Le glycérol est un
sous-produit de la saponification. On peut le récupérer par distillation.
-
Le glycérol est un
trialcool : le propan-1, 2,3 -triol
Formule semi-développée

Formule topologique

-
Le glycérol possède
trois groupes hydroxyle – OH.
-
Ces groupes hydroxyle
sont portés par des carbone tétragonaux.
-
Le glycérol est un
triol, il fait partie de la famille des alcools.
-
Lorsque le glycérol
réagit avec des acides gras (acides carboxyliques), il se forme des triesters,
aussi appelés triglycérides ou lipides.
-
C’est une réaction
d’estérification.
Le glycérol

IV-
Exercice : Synthèse d’une amorce à gardons.
1)- Énoncé.
Certains pêcheurs utilisent l'éthanoate de pentyle pour réaliser des amorces
à gardons, petits poissons de nos rivières.
Cet ester peut être synthétisé par une transformation appelée estérification,
très lente à froid.
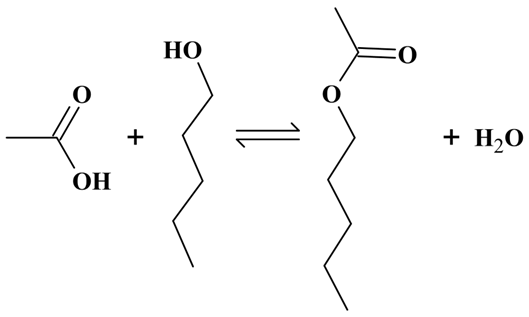
DOC. 1 : Équation de la réaction d’estérification :

ou
DOC.2 : Appareil de Dean-Stark :
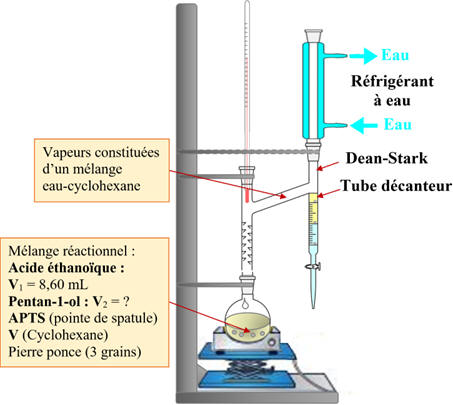
Un appareil de Dean-Stark permet de séparer l'eau formée, lors d'une
synthèse, du reste du milieu réactionnel par distillation en présence de
cyclohexane.
Le cyclohexane et l'eau formée non miscibles à l'état du liquide forment un
mélange qui s’accumule dans le tube décanteur de Dean-Stark.
Données :
|
|
Masse molaire
M
(g . mol–1)
|
Densité
d
|
Solubilité
dans l’eau
|
Solubilité
dans le
cyclohexane
|
|
Acide
éthanoïque
|
60,0
|
1,05
|
Totale
|
-
|
|
Pentan-1-ol
|
88,0
|
0,81
|
Faible
|
-
|
|
Ester
|
130
|
0,88
|
Faible
|
Forte
|
|
eau
|
18,0
|
1,00
|
-
|
Insoluble
|
|
Cyclohexane
|
84,0
|
0,78
|
Insoluble
|
-
|
Protocole 1 : avec Dean-Stark
-
Le tube décanteur du
Dean-Stark est rempli de cyclohexane jusqu’à la partie supérieure.
-
Le mélange réactionnel
est chauffé à reflux.
-
Lors de l’ébullition,
seuls l’eau et le cyclohexane se vaporisent puis se liquéfient.
Protocole 2 : sans Dean-Stark
-
Le même mélange
d’acide éthanoïque, de pentan-1-ol et de cyclohexane est chauffé à reflux
pendant environ 50 min.
-
Après refroidissement,
le contenu du ballon est traité et à la suite de plusieurs opérations, un
échantillon de masse m = 11,7 g
d’éthanoate de pentyle est recueilli.
Questions.
1.
Synthèse sans Dean-Stark :
a)-
Établir en fonction des DONNÉES,
l'expression littérale du volume V2 de pentan-1-ol utilisé
pour que le mélange d'acide carboxylique et d'alcool soit dans les proportions
stœchiométriques. Calculer la valeur du volume V2.
b)-
L’acide paratoluène sulfonique (APTS)
est utilisé comme catalyseur : préciser le rôle d'un catalyseur.
c)-
Définir calculer le rendement r de
la synthèse.
2.
Synthèse avec Dean-Stark
a)-
Indiquer sur un schéma les positions
relatives des 2 phases (eau et cyclohexane) dans le tube décanteur du
Dean-Stark. Justifier.
b)-
L’eau est éliminée du ballon au fur et à
mesure de sa formation. Préciser l’intérêt du Dean-Stark.
c)-
Après traitement, la masse d’ester formé
est m’ = 17,6 g. Vérifier l'intérêt
de cette méthode de synthèse par rapport à la précédente en calculant son
rendement r’.

2)- Correction.
1.
Synthèse sans Dean-Stark :
a)-
Expression littérale du volume V2
de pentan-1-ol utilisé.
-
Tableau d’avancement :
|
Équation
|
Acide
éthanoïque
|
+ Pentan-1-ol
|

|
Éthanoate
de pentyle
|
+ Eau
|
|
état
|
Avancement
x
(mol)
|
n
(Acide)
mol
|
n
(Alcool)
mol
|
|
n
(Ester)
mol
|
n
(Eau)
mol
|
|
État initial
(mol)
|
x
= 0
|
n1
=
|
n2
=
|
0
|
0
|
|
Au cours
de la
transformation
|
x
|
n1
– x
|
n2
– x
|
3 x
|
x
|
|
Avancement
Final
(équilibre)
|
xf
|
n1
– xf
|
n2
– xf
|
xf
|
xf
|
|
xf
= ?
|
|
|
|
|
|
Avancement
maximal
|
xmax
|
n1
– xmax
|
n2
– xmax
|
xmax
|
xmax
|
|
xmax
= ?
|
0
|
0
|
|
|
-
Volume d’acide
éthanoïque (pur) : V1 = 6,00 mL
-
Quantité de matière
d’acide éthanoïque :
-
 avec m1 = ρ1
. V1
avec m1 = ρ1
. V1
-

-
D’autre part, d’après
le tableau d’avancement :
-
Les réactifs
constituent un mélange stœchiométrique si
-
n1
= n2
-
En utilisant le même
système de notation :
-
L’indice 2 étant
relatif au pentan-1-ol.
-
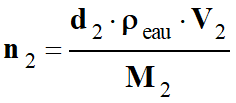
-

-
Calcul de la valeur du
volume V2 :
-
Application
numérique :
-
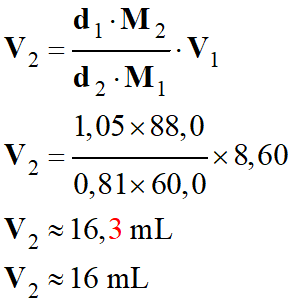
b)-
Rôle d'un catalyseur.
►
Acide paratoluène
sulfonique (APTS) :
-
Acide 4-méthylbenzène-1-sulfonique
(acide tosylique)
-
Formule brute : C7H8O3S
-
Solide blanc soluble dans l'eau
-
Formule semi-développée :

-
Formule topologique :
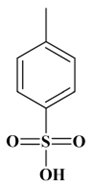
-
En synthèse organique l'APTS est
utilisé comme catalyseur acide.
-
Il ne présente pas de caractère oxydant
comme l’acide sulfurique.
-
Un catalyseur est une
substance qui accélère une réaction sans entrer dans le bilan de la réaction et
sans modifier l’état final du système.
-
Remarques :
-
Lorsqu’une réaction
est limitée, le catalyseur permet d’arriver plus vite à l’état d’équilibre mais
il ne déplace pas l’équilibre.
-
Un catalyseur ne peut
pas rendre possible une réaction non spontanée.
-
Catalyser une
réaction, c’est augmenter sa vitesse par ajout d’un catalyseur.
-
Un catalyseur modifie
le mécanisme réactionnel et la nature des étapes permettant de passer des
réactifs aux produits.
La catalyse :
Interprétation microscopique de l’action d’un catalyseur.
Cinétique et catalyse
c)-
Définition et calcul de rendement r
de la synthèse.
►
Le rendement d’une
réaction chimique :
Rendement
-
On appelle rendement,
noté η, de la synthèse, le quotient de la quantité de produit P
effectivement obtenue nP par la quantité maximale attendue
nmax :
-
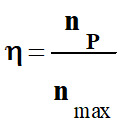
-
Si la synthèse du
produit demande plusieurs étapes, le rendement de la synthèse est égal au
produit des rendements de chaque étape.
-
Le rendement est
défini par rapport au réactif limitant.
-
Dans le cas présent,
on travaille avec un mélange stœchiométrique.
-
Les deux réactifs sont
limitants.
-
n1
= n2
-
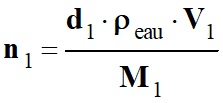
-
Application
numérique :
-

-
n1
≈ 151 mmol
-
Au cours de cette
expérience, la masse d’ester (éthanoate de pentyle) obtenu :
-
m
= 11,7 g
-
Quantité de matière
correspondante :
-

-
Quantité de matière
que l’on peut relier à l’avancement final :
-
xf
= n ≈ 9,00 × 10–2 mol
-
xf
= n ≈ 90,0 mmol
-
Tableau d’avancement :
Bilan de matière
|
Équation
|
Acide
éthanoïque
|
+ Pentan-1-ol
|

|
Éthanoate
de pentyle
|
+ Eau
|
|
état
|
Avancement
x
(mmol)
|
n
(Acide)
mmol
|
n
(Alcool)
mmol
|
|
n
(Ester)
mmol
|
n
(Eau)
mmol
|
|
État initial
(mol)
|
x
= 0
|
n1
=
|
n2
=
|
0
|
0
|
|
Au cours
de la
transformation
|
x
|
n1
– x
|
n2
– x
|
3 x
|
x
|
|
Avancement
Final
(équilibre)
mmol
|
xf
|
n1
– xf
|
n2
– xf
|
xf
|
xf
|
|
xf
= 90,0
|
61,0
|
61,0
|
90,0
|
90,0
|
|
Avancement
Maximal
mmol
|
xmax
|
n1
– xmax
|
n2
– xmax
|
xmax
|
xmax
|
|
xmax
= 151
|
0
|
0
|
151
|
151
|
-

-
r
≈ 60 %
-
Cette réaction fait
intervenir un acide carboxylique et un alcool primaire.
Rendement d’une réaction d’estérification
(Classe d'un alcool)
-
Dans ce cas, le
rendement est proche de 66 %.
-
Le rendement
expérimental est proche du rendement optimal.
2.
Synthèse avec Dean-Stark
a)-
Indication sur un schéma des positions
relatives des 2 phases (eau et cyclohexane) dans le tube décanteur du
Dean-Stark.
-
Schéma :

-
Justification :
-
Le cyclohexane
constitue la phase supérieure et l’eau la phase inférieure.
-
L’eau (d
= 1,00) est plus dense que le cyclohexane (d
= 0,78).
-
L’eau et le
cyclohexane sont deux liquides non miscibles.
b)-
Intérêt du Dean-Stark.
-
L’eau est éliminée du
ballon au fur et à mesure de sa formation.
-
Au cours de cette
expérience, la masse d’ester (éthanoate de pentyle) obtenu :
-
Après traitement, la
masse d’ester formé est :
-
m’
= 17,6 g.
-
Quantité de matière
correspondante :
-

-
Quantité de matière
que l’on peut relier à l’avancement final :
-
xf
= n ≈ 135 mmol
|
Équation
|
Acide
éthanoïque
|
+ Pentan-1-ol
|

|
Éthanoate
de pentyle
|
+ Eau
|
|
état
|
Avancement
x
(mmol)
|
n
(Acide)
mmol
|
n
(Alcool)
mmol
|
|
n
(Ester)
mmol
|
n
(Eau)
mmol
|
|
État initial
(mol)
|
x
= 0
|
n1
=
|
n2
=
|
0
|
0
|
|
Au cours
de la
transformation
|
x
|
n1
– x
|
n2
– x
|
3 x
|
x
|
|
Avancement
Final
(équilibre)
mmol
|
xf
|
n1
– xf
|
n2
– xf
|
xf
|
xf
|
|
xf
= 135
|
16,0
|
16,0
|
135
|
135
|
|
Avancement
Maximal
mmol
|
xmax
|
n1
– xmax
|
n2
– xmax
|
xmax
|
xmax
|
|
xmax
= 151
|
0
|
0
|
151
|
151
|
-
Rendement
r’ de la synthèse avec la méthode du
Dean-Stark.
-
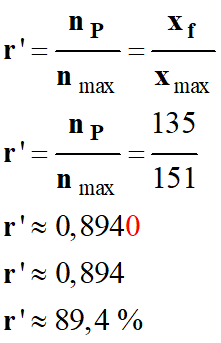
-
r’
≈ 89 %
-
Vérifier l'intérêt de
cette méthode de synthèse par rapport à la précédente.
-
Le rendement est
proche de 1, car on extrait l'eau au fur et à mesure qu'elle se forme.
-
Le système évolue de
façon continue dans le sens direct de l’écriture de l’équation.
-
On déplace l'équilibre
dans le sens de l'estérification.
|
|
|
Estérification →
|
|
|
|
Acide
carboxylique
|
+ Alcool
|

|
Ester
|
+ Eau
|
|
|
|
← Hydrolyse
|
|
|
-
En conséquence, le
montage Dean-Stark agit sur la vitesse de la réaction (comme le montage de
chauffage à reflux), mais de plus, il agit sur le rendement de la réaction
d’estérification.
-
Il déplace l’équilibre
dans le sens de l’estérification et transforme un équilibre chimique en une
réaction quasi totale.
Synthèse d’un ester à l’odeur de jasmin

V-
Exercice : Synthèse industrielle de l’ammoniac.
1)- Énoncé.
La production industrielle de l'ammoniac a été réalisé pour la première fois
1913 dans l’usine de l'entreprise des BASF, en Allemagne.
La production de l'ammoniac repose sur la réaction entre le diazote et le
dihydrogène à l'état gazeux.
Les réactifs sont portés à haute température (450 °C) et à haute pression
(300 bars) en présence de catalyseurs solides à base de fer.
La transformation est exothermique.
VOCABULAIRE : faction molaire d’un mélange gazeux.
La fraction molaire yA de l’espèce A d’un mélange
gazeux est définie par
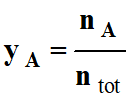 ,
où nA désigne la quantité de matière
de l’espèce A et ntot la quantité de matière totale du
mélange.
,
où nA désigne la quantité de matière
de l’espèce A et ntot la quantité de matière totale du
mélange.
yA est un nombre sans dimension.
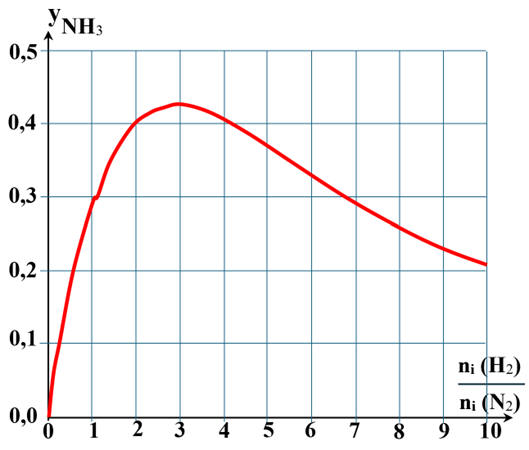
DOC. 1 Influence de la composition initiale du système.
La représentation graphique ci-dessous montre l'évolution de la fraction
molaire de NH3 (g) dans un mélange à l'équilibre, en fonction
de la composition initiale du système, à une température de 450 °C et une
pression de 300 bar.
DOC. 2 Influence de la température
La représentation graphique ci-dessous est réalisée pour un mélange initial
de dihydrogène et de diazote en même quantité de matière, à une pression de 300
bar.

DONNÉE : Loi de déplacement de l’équilibre
Loi de Van’t Hoff : Dans le cas de système subissant une
transformation chimique, une augmentation de la température (à la pression
fixée) provoque un déplacement, de l'équilibre chimique considéré, dans le sens
endothermique c'est-à-dire le sens d'absorption réelle d'un transfert thermique.
Questions
1.
Écrire l'équation de la réaction modélisant la
synthèse de l'ammoniac avec les nombres stœchiométriques entiers les plus petits
possibles.
2.
En utilisant le DOC. 2, vérifier que l'expérience est
en accord avec la loi de Van’t Hoff .
3.
Préciser pourquoi le mélange gazeux des réactifs est
chauffé.
4.
Montrer que le meilleur rendement à température et
pression fixées est obtenu pour des proportions stœchiométriques des réactifs.
5.
Montrer que dans ces conditions, la fraction molaire
de l'ammoniac est proche de 0,4.
6.
En déduire le rendement de la synthèse industrielle
de l'ammoniac.

2)- Correction.
1.
Équation de la réaction modélisant la synthèse de
l'ammoniac.
-
Synthèse de l’ammoniac :
3 H2 (g) + N2 (g)
 2 NH3 (g)
2 NH3 (g)
2.
Loi de Van’t Hoff .
-
Loi de Van’t
Hoff :
dans le cas de système subissant une transformation chimique, une augmentation
de la température (à la pression fixée) provoque un déplacement de l'équilibre
chimique considéré dans le sens endothermique c'est-à-dire le sens d'absorption
réelle d'un transfert thermique.
|
|
|
Sens direct :
synthèse →
|
|
|
3 H2
(g)
|
+ N2
(g)
|

|
2 NH3
(g)
|
|
|
|
← Sens indirect
|
|
-
Il est précisé que la réaction de synthèse de
l’ammoniac est une réaction exothermique.
-
En conséquence, une élévation de la température
entraîne un déplacement de l’équilibre chimique dans le sens indirect.
-
Exploitation du graphique :

-
Lorsque l’on chauffe un mélange initial de
dihydrogène et de diazote, la fraction d’ammoniac
yNH3 diminue
lorsque la température T augmente.
-
La réaction de synthèse de l’ammoniac suit bien la
loi de Van’t Hoff.
-
Chauffer le mélange réactionnel n’est pas favorable à
la synthèse de l’ammoniac.
3.
Mélange gazeux des réactifs est chauffé.
-
On utilise le fait que la température est un facteur
cinétique.
-
La vitesse de formation ou de disparition d'une
espèce chimique augmente généralement avec la température.
-
Plus la température est élevée, plus l’agitation
thermique est grande, plus l’énergie cinétique des espèces chimiques sera
importante et plus la vitesse des espèces chimiques sera grande.
-
Il découle de ceci que le nombre de chocs et chocs
efficaces entre les espèces chimiques augmente avec la température.
-
Une augmentation de la température permet à la
transformation chimique de se produire plus vite.
4.
Meilleur rendement à température et pression fixées.
-
Il est obtenu pour des proportions stœchiométriques
des réactifs.
-
Tableau pour les
proportions stœchiométriques :
|
Équation
|
3 H2
(g)
|
+ N2
(g)
|

|
2 NH3
(g)
|
|
état
|
n
(H2)
mol
|
n
(N2)
mol
|
|
n
(NH3)
|
|
État initial
(mol)
|
ni
(H2)
|
ni
(N2)
|
0
|
|
Coefficients
stœchiométriques
|
3
|
1
|
2
|
-
Les proportions stœchiométriques :
-

-
Exploitation graphique :
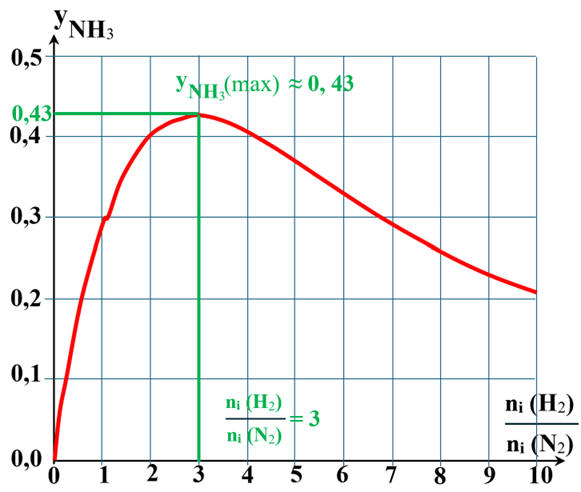
-
Le graphique montre bien que la fraction molaire en
ammoniac est maximale lorsque le rapport
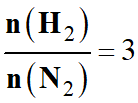
5.
Fraction molaire de l'ammoniac.
-
L’exploitation graphique permet de déterminer la
fraction molaire d’ammoniac
-
yNH3 (max)
≈ 0,43 (exploitation graphique)
-
Cette valeur est légèrement supérieure à 0,4.
6.
Rendement de la synthèse industrielle de l'ammoniac.
-
Tableau d’avancement :
-
On considère un mélange stœchiométrique de
dihydrogène et de diazote gazeux.
-
Pour simplifier, on choisit
ni (H2)
= 3,0 mol et ni (N2)
= 1,0 mol.
-
Tableau d’avancement :
|
Équation
|
3 H2
(g)
|
+ N2
(g)
|

|
2 NH3
(g)
|
|
état
|
Avancement
|
n
(H2)
mol
|
n
(N2)
mol
|
|
n
(NH3)
|
|
État initial
(mol)
|
x
= 0
|
3,0
|
1,0
|
0
|
|
État
intermédiaire
|
x
|
3,0 – 3 x
|
1,0 – x
|
2 x
|
|
État final
|
xf
|
3,0 – 3 xf
|
1,0 – xf
|
2 xf
|
|
État maximal
|
xmax
|
3,0 – 3 xmax
|
1,0 – xmax
|
2 xmax
|
-
Les réactifs étant introduits dans les proportions
stœchiométriques :
-
Les deux réactifs sont limitants :
-
xmax
= 1,0 mol
-
L’avancement final peut être calculé à partir de la
fraction molaire maximale en ammoniac.
-
La fraction molaire yNH3 d’ammoniac
d’un mélange gazeux est définie par
 , où nNH3 désigne
la quantité de matière d’ammoniac et ntot la quantité de
matière totale du mélange.
, où nNH3 désigne
la quantité de matière d’ammoniac et ntot la quantité de
matière totale du mélange.
-
yNH3 est
un nombre sans dimension.
-
Dans le cas présent :
-
yNH3 (max)
≈ 0,43
-
À l’équilibre chimique, on peut écrire :
-
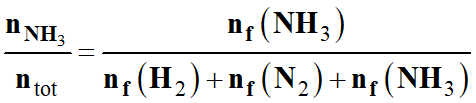
-
En utilisant le tableau d’avancement de la réaction :
-

-
On réduit, on ordonne et on distribue :
-
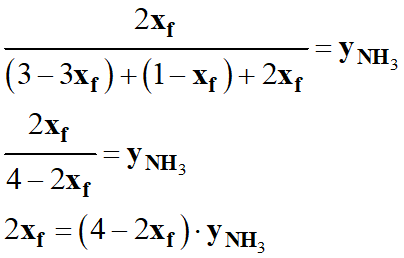
-
Suite :
-

-
Application numérique :
-

-
Tableau d’avancement : bilan de matière
|
Équation
|
3 H2
(g)
|
+ N2
(g)
|

|
2 NH3
(g)
|
|
état
|
Avancement
mol
|
n
(H2)
mol
|
n
(N2)
mol
|
|
n
(NH3)
|
|
État initial
(mol)
|
x
= 0
|
3,0
|
1,0
|
0
|
|
État
intermédiaire
|
x
|
3,0 – 3 x
|
1,0 – x
|
2 x
|
|
État final
|
xf
|
3,0 – 3 xf
|
1,0 – xf
|
2 xf
|
|
= 0,60
|
1,2
|
0,40
|
1,2
|
|
État maximal
|
xmax
|
3,0 – 3 xmax
|
1,0 – xmax
|
2 xmax
|
|
xmax
= 1,0
|
0,0
|
0,0
|
2,0
|
►
Remarque :
-
ntot
= 4 – 2
x
-
Au cours de la réaction l’avancement
x augmente.
-
0 ≤ x ≤
xf
-
En conséquence, au cours de la réaction, la quantité
de matière totale diminue.
-
ntot
↓
-
Rendement d’une synthèse :
-
On appelle rendement, noté η, de la synthèse,
le quotient de la quantité de produit P effectivement obtenue nP
par la quantité maximale attendue nmax :
-
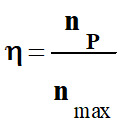
-
Le rendement est défini par rapport au réactif
limitant.
-
Dans le cas présent, on travaille avec un mélange
stœchiométrique.
-
nmax
(NH3) = 2,0 mol et
nf (NH3) = 2 xf
≈ 1,2 mol
-


VI-
Activité : Synthèse du paracétamol :
1)- Énoncé.
Le paracétamol est un médicament utilisé pour ses propriétés analgésiques et
antipyrétiques.
Cette espèce chimique est obtenue au laboratoire par réaction entre le
4-aminophénol et l'anhydride éthanoïque.
►
Comment synthétiser le paracétamol et
confirmer sa structure ?
PROTOCOLE :
L'anhydride éthanoïque et le 4-aminophénol sont corrosifs : éviter le contact
avec la peau et les yeux.
|

|
Je ronge.
|
Corrosif.
Détruit et attaque les
métaux.
Peuvent ronger la peau et/ou
les yeux en cas de projection.
|
1.
Dans un ballon Bicol muni d'un réfrigérant
à eau et d'une ampoule de coulée, introduire un échantillon de 4-aminophénol de
masse m = 5,0 g et un barreau aimanté.
2.
Ajouter rapidement 15 mL d'eau, puis
lentement 6,0 mL d'anhydride éthanoïque
3.
Chauffer à reflux pendant 20 min.
4.
Laisser refroidir à température ambiante
grâce à un bain d’eau, puis transvaser le mélange dans un bécher.
Le refroidir
dans un bain de glace : le paracétamol précipite.
5.
Essorer le solide sous pression réduite et
le laver à l'eau glacée ; essorer, puis sécher le solide sur papier-filtre.
6.
Mesurer sa température de fusion.
DONNÉES :
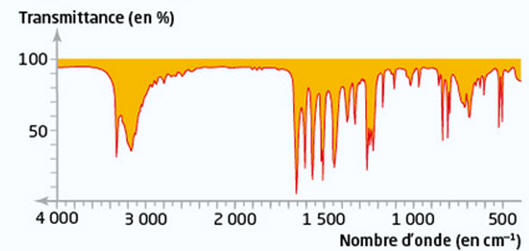
Spectre IR du produit obtenu :
►
Formule topologique de
l’anhydride éthanoïque :

C4H6O3
►
Températures de
fusion :
|
4-aminophénol :
C6H7NO

θfus = 190
° C
|
N-(4-hydroxyphényl)acétamide
C8H9NO2

θfus
= 171 ° C
|
|
1-(5-amino-2-hydroxyphényl)éthan-1-one
C8H9NO2
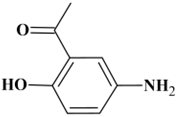
θfus
= 112 ° C
|
Acétate de
4-aminophényle
Ou éthanoate
de 4-aminophényle
Éthanoate de
p-aminophényle
C8H9NO2

θfus
= 74 ° C
|
1.
RÉALISER : mettre en œuvre le protocole.
2.
ANALYSER ET RAISONNER :
a)-
Identifier les étapes de transformation du
substrat, d'isolement, de purification et d'analyse.
b)-
Proposer deux formules topologiques possibles pour le produit
obtenu.
3.
VALIDER :
a)-
À partir de la mesure de la température de
fusion du produit obtenu, identifier la formule du paracétamol.
b)-
Confirmer le résultat par l'étude du
spectre IR du produit obtenu.
c)-
Déterminer à quelle classe de réaction
appartient la transformation du 4-aminophénol en paracétamol.

2)- Correction.
1.
RÉALISER : mettre en œuvre le protocole.
-
Schéma du montage :

2.
ANALYSER ET RAISONNER :
a)-
Identification des étapes de transformation du
substrat, d'isolement, de purification et d'analyse.
-
Transformation du substrat : 2. On verse lentement
6,0 mL d'anhydride éthanoïque et 3,. on chauffe à reflux pendant 20 min.
-
Le chauffage à reflux permet de travailler à une
température élevée et d’accélérer la réaction.
-
Isolement du produit obtenu : 4. Transvaser le
mélange dans un bécher. Le refroidir dans un bain de glace : le paracétamol
précipite
-
L’extraction du produit obtenu se fait par
précipitation (cristallisation).
-
Puis on effectue un filtrage sous pression réduite :

-
Purification : on peut effectuer une
recristallisation du produit obtenu pour le purifier.
-
Analyse :
-
Détermination de la température de fusion au banc
Kofler.
-
Réalisation d’une C.C.M.
b)-
Formules topologiques possibles pour le produit
obtenu.
-
Le paracétamol : réaction sur la fonction amine

-
Acétate de 4-aminophényle : réaction sur le groupe
hydroxyle.

►
Étude du para-aminophénol ou du 4-aminophénol :
-
Cette molécule possède un groupe hydroxyle et un
groupe amine.


-
La famille associée au groupe hydroxyle est la
famille alcool, si le groupe hydroxyle est porté par un carbone tétragonal.
-
Dans le cas présent, le groupe hydroxyle est porté
par un carbone trigonal.
-
La famille associée est la famille des phénols. Cette
famille peut dans certains cas se comporter comme un alcool.
-
Les sites donneurs d’électrons : sites nucléophiles

-
Les deux sites donneurs de doublets d’électrons :
-
L’atome d’oxygène O du groupe hydroxyle (deux
doublets non liants) ;
-
L’atome d’azote N du groupe amine (un doublet
non liant).
►
Étude de l’anhydride éthanoïque :


-
Les sites donneurs de doublets d’électrons : sites
nucléophiles
-
L’atome d’oxygène O (deux doublets non liants)
-
Les sites appauvris en électrons : sites
électrophiles
-
Les atomes de carbone du groupement fonctionnel.
►
Le paracétamol :
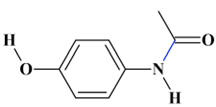
On remarque qu’une liaison
C – N s’est formée
►
Mécanisme réactionnel : formation du paracétamol
-
Étape 1 :
réaction d’addition (2 réactifs et un produit intermédiaire)
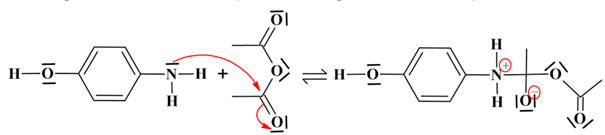
-
Étape 2 : élimination : un réactif et deux produits
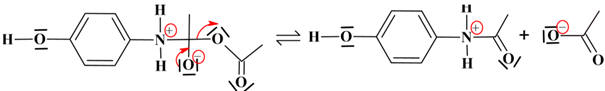
-
Étape 3 : réaction
acide-base

On obtient le paracétamol et l'acide éthanoïque
►
Mécanisme
réactionnel : Formation de l’acétate de 4-aminophényle
-
Étape 1 :
réaction d’addition (2 réactifs et un
produit intermédiaire)

-
Étape 2 : élimination : un réactif et deux produits
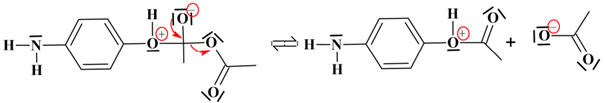
-
Étape 3 : réaction
acide-base
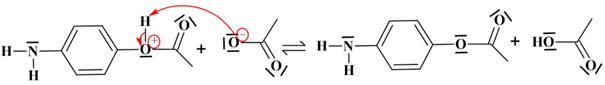
- Les différentes espèces chimiques :
- L'ion éthanoate :

- l'acide éthanoïque :
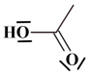
1.
VALIDER :
a)-
Identification de la
formule du paracétamol.
-
Le produit obtenu
est placé dans l’étuve pour le séchage.


-
Détermination de
la température de fusion à l’aide d’un banc Kofler :

Isoler un produit solide
►
Utilisation du
banc Kofler :
-
Mise sous tension du banc
Kofler
-
Il faut attendre
au moins 30 minutes pour permettre l’établissement du gradient de
température.
-
Le voyant vert
indique que le banc est équilibré.
-
Étalonnage du banc
Kofler:
-
Avant la mesure,
on peut étalonner le banc Kofler avec une substance étalon dont la
température de fusion est proche de celle du produit testé.
-
Déplacez le
chariot jusqu’à ce que le curseur soit à la frontière entre solide et
liquide de la substance étalon.
-
Mesure de la
température de fusion:
-
Déposer une pointe
de spatule de solide sec et finement divisé (poudre) sur la partie froide de
la plaque.
-
Déplacer
horizontalement le chariot jusqu’à ce que le curseur soit à la frontière
entre solide et liquide.
-
Lorsque le solide
commence à fondre, lisez la température de fusion grâce à l’aiguillage.

-
La température de
fusion du produit obtenu est proche de 171 ° C
-
θfus
≈ 171 ° C
-
Ce résultat est en
accord avec la température de fusion du paracétamol.
|
Paracétamol
N-(4-hydroxyphényl)acétamide
C8H9NO2

θfus
= 171 ° C
|
b)-
Confirmation à l’aide de l'étude du spectre
IR
du produit obtenu.
Analyses spectrales
-
La spectroscopie
IR est
une spectroscopie d’absorption.
-
Les composés
organiques absorbent aussi dans le domaine de l’infrarouge.
-
Pour ces spectres,
on fait figurer :
-
La transmittance
T ou
intensité lumineuse transmise par l’échantillon analysé en ordonnée (elle
s’exprime en pourcentage)
-
Le nombre d’ondes
σ en
abscisse.
-
Le nombre d’ondes
σ est
l’inverse de la longueur d’onde λ.
-
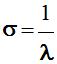
-
Le nombre d’ondes
σ
s’exprime en cm–1 en
chimie organique.
►
Le
nombre d’onde compris entre 1500 et 4000 cm–1.
-
Cette zone ne
contient qu’un nombre limité de bandes, correspondant à des types de
liaisons particuliers.
-
Chaque bande est
caractérisée par :
-
Sa position dans
le spectre (la valeur du nombre d’onde du minimum de transmittance,
-
Sa largeur (bande
large ou fine),
-
Son intensité
(faible, moyenne ou forte), correspondant à la valeur minimale de la
transmittance.
►
Le
nombre d’onde compris entre 400 et 1500 cm–1.
-
Il s’agit d’une
zone très riche en bandes d’absorption pour les molécules organiques
possédant un ou plusieurs atomes de carbone.
-
Elle est
généralement exploitée qu’en comparaison avec un spectre de référence.
-
Cette zone
s’appelle l’empreinte digitale de la molécule.
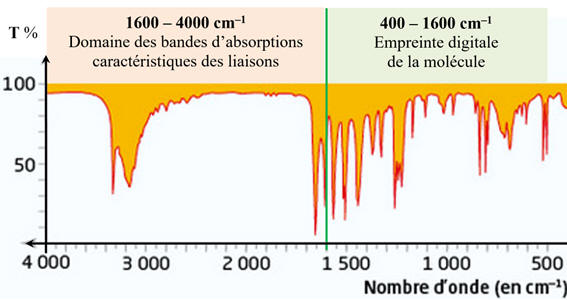
►
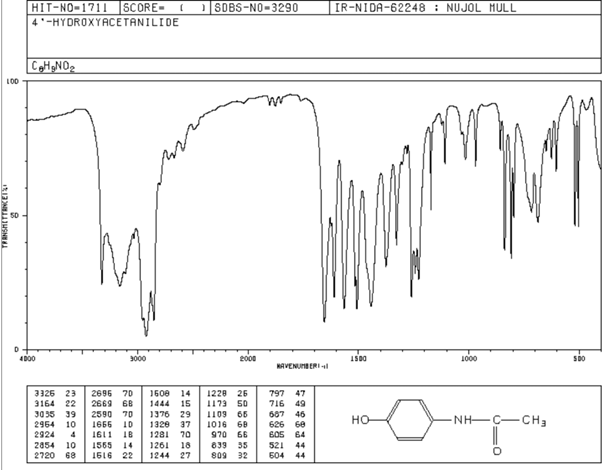
Analyse des
principales bandes caractéristiques :
-
Le
spectre IR
du paracétamol présente plusieurs bandes d'absorptions caractéristiques de
différents groupes fonctionnels :
-
Bande fine à 3300 cm⁻¹ : due à la liaison
N
– H du groupe amide
 .
.
-
Bande large à 3200 et 3000 cm⁻¹ : dues aux vibrations d'élongation des
liaisons C – H
aromatiques et aliphatiques
-
Bande à 1680 cm⁻¹ : due à la vibration d'élongation de la liaison
C = O
(groupe carbonyle de la fonction amide).

-
Le spectre observé
est en accord avec la molécule de paracétamol.
-
Les différents
groupes présents dans la molécule de paracétamol :

-
Groupe carbonyle (amide) :
C = O
-
Groupe amino (amide) :
N
–
H.
-
Groupe méthyl : –
CH3.
-
Groupe aromatique :

-
Groupe phénol :
C
–
OH.
-
Groupe phénol : –
O
–
H.
|
Les
différents groupes
|
Liaison
|
σ
(cm–1)
|
|
Groupe phénol
|
– O –
H
|
3300 – 3600
|
|
Groupe amino
(amide)
|
N
– H
|
3300 – 3600
|
|
Hydrogène
aromatique
|
C
– H
|
3010 – 3100
|
|
Hydrogène
aliphatique (– CH3)
|
C
– H
|
2850 – 3050
|
|
Groupe
carbonyle (amide)
|
C = O
|
1640 – 1700
|
|
Groupe
aromatique
|

|
1400 – 1610
|
b)-
Classe de réaction à
laquelle appartient la transformation du 4-aminophénol en paracétamol.
-
La transformation
du 4-aminophénol en paracétamol appartient à la classe des réactions
d’acétylation.
-
C’est une réaction
d’acétylation du groupe amino du 4-aminophénol.
-
Lors de cette
réaction, l’un des atomes d’hydrogène du groupe caractéristique amino (–
NH2)
du 4-aminophénol est remplacé par le groupe d’atomes
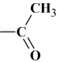 .
.
-
Cette
transformation nécessite trois étapes :
-
Étape 1 : réaction
d’addition
-
Étape 2 : réaction
d’élimination
-
Étape 3 : réaction
acide -base.
►
Remarques :
-
En fin de
réaction, dans le mélange réactionnel, on peut trouver
-
De l’anhydride
éthanoïque,
-
Du 4-aminophénol
-
Des ions éthanoate
-
De l’acide
éthanoïque.
-
Pour ne pas
retrouver du 4-aminophénol en fin de réaction, on peut faire en sorte que ce
soit le réactif limitant.
-
Ainsi, on peut
utiliser l’anhydride éthanoïque en excès.
-
Lors de l’ajout
d’eau est du chauffage, l’acide éthanoïque, le paracétamol et le
4-aminophénol se dissolvent.
-
Lors du
refroidissement, seul l’acide éthanoïque reste soluble dans l’eau.
-
Si le
4-aminophénol est le réactif limitant, seul le paracétamol est recueilli
dans le filtre.
-
Il ne faut pas
rajouter trop d’eau distillée car le paracétamol ne précipitera pas lors du
refroidissement.
-
Le paracétamol est
peu soluble dans l’eau glacée.
-
L’anhydride
éthanoïque utilisée en excès réagit avec l’eau pour donner l’acide
éthanoïque soluble dans l’eau.
►
Comparaison des
spectres IR du paracétamol er du 4-aminophénol
-
On peut retrouver
les deux spectres sur le site (en anglais)
-
https://sdbs.db.aist.go.jp/sdbs/cgi-bin/direct_frame_top.cgi
-
Cliquer sur :

-
Compléter les
champs suivants :

-
Et cocher : 
-
Cliquer sur :
-
On obtient la page
suivante
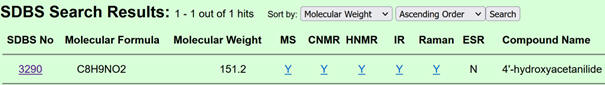
-
Cliquer sur le
lien : 3290
-
Puis sur :
IR nujol mull

- Nujol est une
huile minérale utilisée en particulier dans une technique classique
d’échantillonnage en spectroscopie infrarouge.
- Il s’agit d’une
huile paraffinique lourde (masse molaire élevée) qui est chimiquement inerte.
-
On obtient
l’affichage suivant :
-
Recommencer pour
le p-aminophenol :
-
-
On obtient le
spectre suivant :

- Superposition des deux spectres :
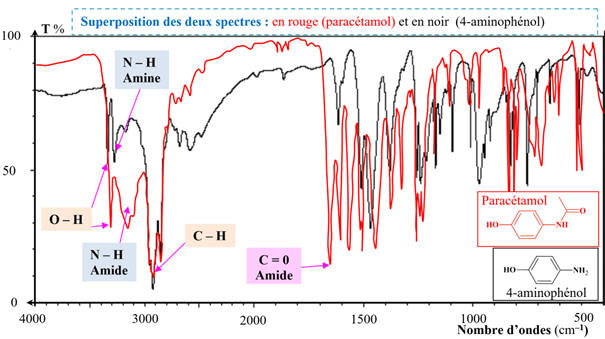
-
Vers 3300 cm–1
:
-
On
observe deux bandes d’absorption pour le para-aminophénol dues au groupe
–NH2
-
et
une bande d’absorption pour le paracétamol correspondant au groupement
–NH–
de l’amide.
-
Sur
le spectre du paracétamol, vers 1680 cm–1
il y a une bande qui correspond à la vibration d’élongation de la liaison
C = O
de l’amide.
-
Ces
deux spectres montrent bien le passage du groupe
amine
du 4-aminophénol vers le groupe
amide
du paracétamol
Titrage colorimétrique du paracétamol
Synthèse du paracétamol (CCM)
Masse molaire du paracétamol
Un
di-antalgique, le Salipran®
Mesure de la température de fusion du
paracétamol



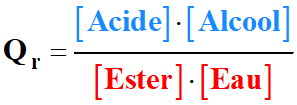
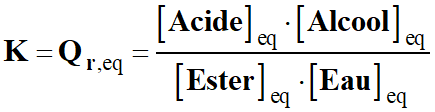


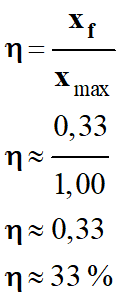



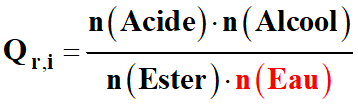

















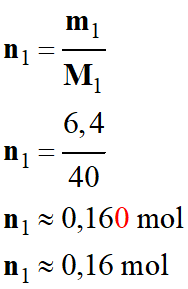
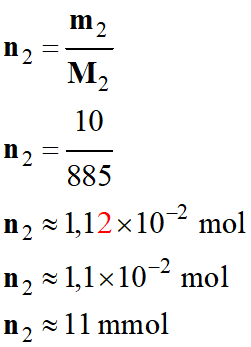
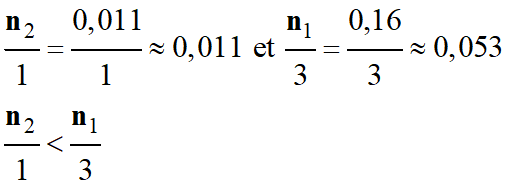
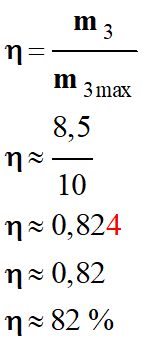








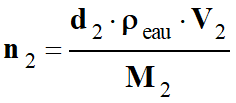

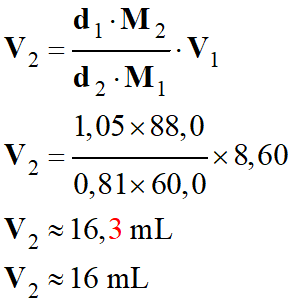


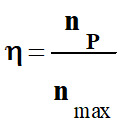
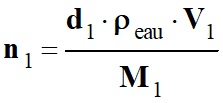





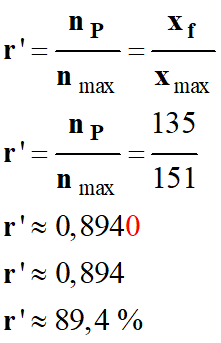
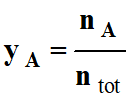 ,
où nA désigne la quantité de matière
de l’espèce A et ntot la quantité de matière totale du
mélange.
,
où nA désigne la quantité de matière
de l’espèce A et ntot la quantité de matière totale du
mélange.



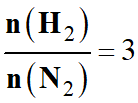
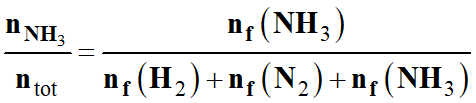

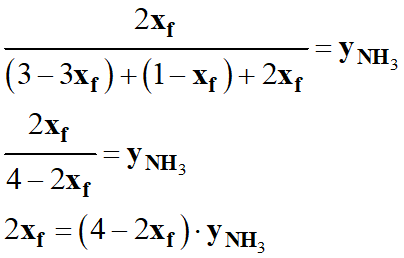
















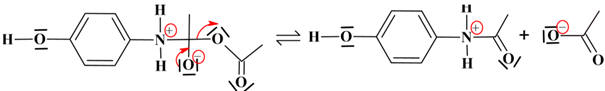










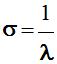

 .
.


 .
.






