|
TP Chimie N° 12 |
Fabrication d'un savon de Marseille : Correction. |
|
|
|
|
Programme 2012 : Programme 2020 |
![]() IV- Exploitation.
IV- Exploitation.
1)-
Faire les schémas annotés des différentes étapes.

Filtration sur filtre Büchner
2)-
Quel est le type de montage utilisé lors de l'expérience 1 ? Quels sont les
rôles du montage utilisé ?
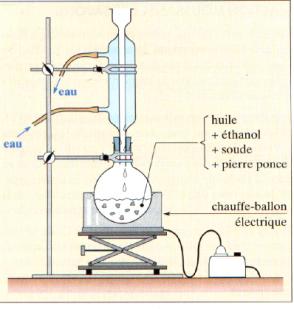
- On utilise le chauffage à reflux.
- En chauffant, on augmente la température du mélange réactionnel, on accélère la réaction de saponification qui est une réaction lente à température ambiante.
- Le chauffage à reflux permet de condenser les vapeurs des réactifs et des produits grâce au réfrigérant à bulles et de les faire retourner à l'état liquide dans le ballon.
3)-
Pourquoi agite-t-on le mélange réactionnel au cours de l’expérience ?
Quel est le rôle de l'éthanol ?
- Le corps gras et la solution de soude ne sont pas miscibles, on agite pendant l'expérience pour maintenir les réactifs en contact.
- L'utilisation de l'éthanol rend le mélange réactionnel plus homogène.
4)- Indiquer
les observations lors de l’expérience 2. Quel est le but du relargage ?
Pourquoi effectue-t-on le relargage avec une solution aqueuse saturée de
chlorure de sodium ?
- L’expérience 2 est le relargage. Lorsque l’on verse le mélange réactionnel, dans la solution aqueuse glacée de chlorure de sodium, le savon précipite.
- Le relargage permet de récupérer le savon.
- La présence des ions chlorure et des ions sodium diminue la solubilité du savon et facilite la précipitation.
5)-
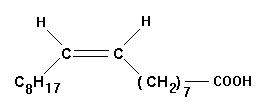
Qu’est-ce qu'un acide gras ?
Écrire la formule semi-développée de l'acide oléique en mettant en évidence
la double liaison.
- Un acide gras est un acide carboxylique à chaîne linéaire, saturée ou non, possédant en général un nombre pair d'atomes de carbone, entre 4 et 22.
- L’acide oléique est un acide gras : acide (Z) octadéc-9-énoïque.
- Il possède 18 atomes de carbone et une double liaison. C’est un acide gras insaturé.
- Formule semi-développée :
![]()
6)-
Qu’est-ce qu'un corps gras ? Comment obtient-on un corps gras ? écrire
la réaction chimique de la formation d’un corps gras.
- Un corps gras est un triester d'acide gras et du glycérol. Les corps gras sont encore appelés triglycérides.
- Il s’agit d’une réaction d’estérification entre des acides gras et un alcool, le glycérol.
- Le glycérol est un trialcool : le propan-1, 2,3 - triol.
|
|
|
- Équation chimique : estérification.
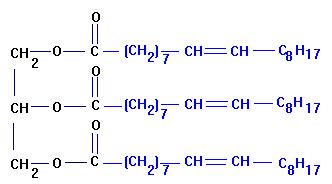
7)- Écrire
la formule semi-développée de l'oléine.
- Formule semi-développée de l’oléine :
8)- Écrire
l'équation de la réaction de saponification de l'oléine.
- Réaction de saponification de l’oléine :
9)- Déterminer la quantité de matière n 1 d'ions hydroxyde introduits dans le milieu réactionnel.
Déterminer la
quantité de matière
n 2
d'oléine introduite dans le milieu réactionnel. Quel est le réactif en excès
?
- Quantité de matière d’ions hydroxyde introduits.
- Quantité de matière d'ions hydroxyde :
- n 1 = C . V
- n 1 = 10,0 x 10,0 x 10 -3
- n 1 ≈ 0,10 mol
- Quantité de matière d'oléine :
| ρ . V | |||
|
n 2 = |
|
||
| M | |||
| 0,90 x 15,0 | |||
|
n 2 = |
|
||
| 884 | |||
|
n 2 ≈ 0,015 mol |
|||
- L’ion hydroxyde est le réactif en excès car
| { | ||||||||||||||
|
n 1 » 0,10 mol n 2 » 0,015 mol |
Þ |
|
≈ |
|
≈ |
6,7 > 3 | ||||||||
10)- Déterminer
la masse
m de
savon sec que l'on peut espérer recueillir. Calculer le rendement de la réaction.
- Masse de savon sec que l’on peut espérer obtenir :
- Masse de savon : la soude est en excès, c'est l'oléine qui limite la réaction.
- Masse molaire de l'oléate de sodium : M(oléate de sodium) = 304 g / mol.
- m théo = 3 n 2 . M savon
- m théo = 3 x 0,015 x 304
- m théo ≈ 13,7 g
- On a obtenu la masse de savon suivante : m exp ≈ 10,2 g
- Rendement de la réaction :
| τ = | n exp |
|
m exp | |||
|
|
= |
|
||||
| n théo |
|
m théo | ||||
| τ = | 10,2 | |||||
|
|
||||||
| 13,7 | ||||||
| τ ≈ |
74 % |
|||||