|
Titrages colorimétriques Exercices |
|
|
|
|
|
1)- Exercice 4 page 72 : Prévoir un changement de couleur :
|
Prévoir un changement de couleur : On dose une solution aqueuse incolore de dioxyde de soufre SO2
(aq) par une solution aqueuse de diiode I2 (aq). L’équation de la réaction support du titrage s’écrit : I2 (aq) + SO2 (aq) + 2 H2O
(ℓ) → 2 I– (aq) + SO42–
(aq) + 4 H+ (aq) Une solution aqueuse de diiode est jaune-orangée. 1.
Identifier les réactifs titré et titrant. 2.
Identifier le réactif limitant : a.
Avant l’équivalence. b.
Après l’équivalence. 3.
Prévoir le changement de couleur de la
solution dans le bécher à l’équivalence du titrage. |
|
Prévoir un changement de couleur : On dose une solution aqueuse incolore de dioxyde de soufre SO2
(aq) par une solution aqueuse de diiode I2 (aq).
1.
Identifier les réactifs titré et titrant.
-
Le réactif titré : Solution aqueuse
incolore de dioxyde de soufre
SO2 (aq).
-
Le réactif titrant : Solution aqueuse
jaune-orangée de diiode I2
(aq).
-
Montage :
2.
Identifier le réactif limitant : a.
Avant l’équivalence.
-
Avant l’équivalence :
-
Le réactif titrant, le diiode I2
(aq) est totalement consommé :
-
C’est le réactif limitant
- Il reste encore du réactif titré : il
est en excès.
b.
Après l’équivalence.
-
Après l’équivalence :
-
Le réactif titré,
le dioxyde de soufre SO2
(aq) est totalement consommé :
-
C’est le réactif limitant.
-
Maintenant, c’est le réactif titrant,
le diiode I2
(aq)
qui est en excès.
3. Prévoir le changement de couleur de la solution dans le bécher à l’équivalence du titrage.
-
L’équivalence :
-
il y a équivalence lorsque les
réactifs ont été mélangés dans les proportions stœchiométriques de
la réaction.
-
C’est-à-dire lorsqu’on a réalisé un
mélange stœchiométrique des réactifs titré et titrant.
-
Les deux réactifs de la réaction sont
alors totalement consommés.
-
Le mélange réactionnel est incolore.
-
À l’équivalence du titrage, il y a
changement de réactif limitant.
-
Après l’équivalence la solution
devient jaune clair.
-
Il y a du diiode en excès. |
2)- Exercice 7 page 74 : Établir et exploiter une relation d’équivalence :
|
Établir et exploiter une relation d’équivalence : On dose un volume V1 = 10,0 mL d’une solution de vitamine C ou acide ascorbique C6H8O6 (aq), contenue dans une ampoule par une solution de diiode I2 (aq) de concentration
C2 = 2,0 × 10–3 mol . L–1. Le volume de diiode versé à l’équivalence est VE
= 15,1 mL. L’équation de la réaction support du titrage s’écrit : I2 (aq) + C6H8O6
(aq) → 2 I– (aq) + C6H6O6
(aq) + 2 H+ (aq) 1.
Établir la relation entre les quantités n1
(C6H8O6) et
nE (I2). 2.
Exprimer et calculer la quantité de matière n1
(C6H8O6) de
vitamine C contenue dans l’ampoule. 3.
En déduire la concentration C1
en vitamine C de la solution dans l’ampoule. |
|
Établir et exploiter une relation
d’équivalence : Réactif titré : Solution de vitamine C ou acide ascorbique C6H8O6
(aq) V1 = 10,0 mL C1 = ? Réactif titrant : Solution de diiode I2 (aq) C2 = 2,0 × 10–3 mol . L–1. Le volume de diiode versé à l’équivalence est : VE = 15,1 mL. L’équation de la réaction support du titrage s’écrit : I2 (aq) + C6H8O6
(aq) → 2 I– (aq) + C6H6O6
(aq) + 2 H+ (aq) 1.
Relation entre les quantités n1
(C6H8O6) et
nE (I2).
-
L’équivalence :
-
il y a équivalence lorsque les
réactifs ont été mélangés dans les proportions stœchiométriques de
la réaction.
-
C’est-à-dire lorsqu’on a réalisé un
mélange stœchiométrique des réactifs titré et titrant.
-
Les deux réactifs de la réaction sont
alors totalement consommés.
-
n1 (C6H8O6)
=
C1 . V1 - Quantité de matière de diiode I2 (aq) versé à l'équivalence :
-
nE
(I2)
-
Tableau d’avancement :
-
n1 (C6H8O6)
= nE (I2) 2.
Expression et calcul de la quantité de
matière n1 (C6H8O6)
de vitamine C contenue dans l’ampoule.
-
n1 (C6H8O6)
= nE (I2)
= C2 . VE
-
n1 (C6H8O6)
= 2,0 × 10–3 × 15,1 × 10–3
-
n1 (C6H8O6)
≈ 3,02 × 10–5 mol
-
n1 (C6H8O6)
≈ 3,0 × 10–5 mol 3.
Concentration C1 en
vitamine C de la solution dans l’ampoule.
-
Une méthode pour retrouver la
relation :
-
-
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3)- Exercice 9 page 74 : Dosage du dioxyde de soufre dans le vin :
|
Dosage du dioxyde de soufre dans le vin : La concentration en masse de dioxyde de soufre dans un vin blanc
ne doit pas excéder 210 mg . L–1. Pour vérifier la conformité de la concentration en dioxyde de soufre d’un vin blanc, on utilise une solution titrante de concentration : C1 = 7,80 × 10–3 mol . L–1
en diiode. Dans un erlenmeyer, on verse un volume V2 = 25,0 mL de vin blanc. On ajoute 2 mL d’acide sulfurique pour acidifier le milieu. Lors du titrage du vin blanc, l’équivalence est obtenue après avoir versé un volume VE = 6,1 mL de solution titrante. La
réaction support du titrage s’écrit : SO2 (aq) + I2
(aq) + 2 H2O
(ℓ) → SO42– (aq) + 2 I–
(aq) + 4 H+ (aq) Ce vin est-il conforme à la législation ? 1.
Identifier les réactifs titrant et titré. 2.
Établir une relation entre la quantité de
matière initiale n0 (SO2) de dioxyde de soufre et la quantité
de diiode nE (I2) versée à
l’équivalence du titrage. 3.
Déterminer la concentration en quantité de
matière de dioxyde de soufre dans ce vin blanc. 4.
Ce vin est-il conforme à la législation ?
Justifier.
-
Donnée :
M (SO2) = 64,1 g . mol–1 |
Dosage du dioxyde de soufre dans le vin : SO2 (aq) + I2
(aq) + 2 H2O
(ℓ) → SO42– (aq) + 2 I–
(aq) + 4 H+ (aq) 1.
Identification des réactifs titrant et
titré.
-
Le réactif titré : le vin blanc :
-
Volume : V2 = 25,0
mL
-
Concentration à déterminer : C2
= ?
-
Le réactif titrant : solution aqueuse
de diiode I2 (aq) :
-
Volume versé à l’équivalence : VE = 6,1
mL
-
Concentration connue : C1
= 7.80 × 10–3 mol . L–1 2.
Relation entre la quantité de matière
initiale n0 (SO2) de dioxyde de
soufre et la quantité de diiode nE (I2)
versée à l’équivalence du titrage.
-
L’équivalence :
-
il y a équivalence
lorsque les réactifs ont été mélangés dans les proportions
stœchiométriques de la réaction.
-
C’est-à-dire lorsqu’on a réalisé un
mélange stœchiométrique des réactifs titré et titrant.
-
Les deux réactifs de la réaction sont
alors totalement consommés.
-
Quantité de matière initiale n0
(SO2) de dioxyde de soufre :
-
n0 (SO2)
= C2 .
V2
-
Quantité de matière
nE (I2) de diiode versé à
l’équivalence :
-
nE (I2)
= C1 . VE
-
Tableau d’avancement :
Équation
I2
(aq) +
SO2
(aq)
→
2
I– (aq)
+
C6H6O6
(aq)
+ 2
H+ (aq)
état
Avanc.
x
(mol)
n
(I2)
(mol)
n (SO2)
(mol)
n
(I–)
(mol)
n
(SO42–)
(mol)
excès
État initial
à
l’équivalence
(mol)
0
nE
(I2)
=
C1 . VE
n0
(SO2)
=
C2 . V2
0
0
Au cours
de la
transformation
x
C1
. VE – x
n0
(SO2)
– x
2 x
x
État final
à
Équivalence
xmax
= xE
C1
. VE – xE
n0
(SO2)
– xE
2 xmax
xmax
0
0
C1
. VE = xE
C2
. V2 = xE
2 xmax
xmax
-
Relation :
C1 .
VE = C2
. V2 3.
Concentration C2 en
quantité de matière de dioxyde de soufre dans ce vin blanc.
-
4.
Conformité du vin blanc à la législation :
-
pour 1,0 L de vin blanc :
-
n0 (SO2)
≈ 1,9 × 10–3 mol
-
Masse de dioxyde de soufre dans 1,0 L
de vin blanc :
-
m (SO2) =
n0 (SO2) . M (SO2)
= 1,9 × 10–3 × 64,1
-
m (SO2) =
C2 . V = 1,9 × 10–3 × 64,1
-
m (SO2) ≈
0,12 g
-
m (SO2) ≈
120 mg
-
Ce vin blanc est conforme à la
législation : m (SO2) < 210 mg
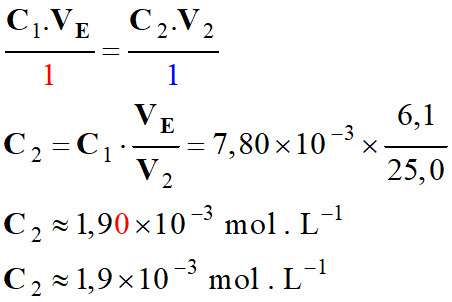
![]()
4)- Exercice 12 page 75 : Titrage colorimétrique de l’eau oxygénée :
|
Titrage colorimétrique de l’eau oxygénée : On souhaite déterminer la concentration C0 en quantité de matière de peroxyde d’hydrogène dans une solution commerciale S0 d’eau oxygénée à « 10 volumes » incolore. La réaction support du titrage est la
réaction entre les ions permanganate MnO4–
(aq) et le peroxyde d’hydrogène H2O2
(aq). On dilue 10 fois la solution S0, on obtient une solution S1. On dose un volume V1 = 10,0 mL de la solution
S1 par une solution S2 de permanganate de potassium de concentration C2 =
0,020 mol . L–1 en ion permanganate. Le volume versé à l’équivalence est VE = 17,6
mL. 1.
Écrire et ajuster l’équation de la réaction
support du dosage. 2.
Le titrage : a.
Schématiser et légender le dispositif de
titrage. b.
Expliquer comment est repérée visuellement
l’équivalence du titrage. 3.
Écrire la relation à l’équivalence du
titrage et en déduire l’expression de la concentration C1
en peroxyde d’hydrogène de la
solution S1. 4.
Calculer les valeurs des concentrations C1
puis C0. 5.
En déduire la quantité n0
(H2O2) de peroxyde d’hydrogène
présente dans un litre de solution
commerciale S0. 6.
L’eau oxygénée étudiée est dite à « 10
volumes ». cela signifie qu’un litre de solution peut libérer 10 L de
dioxygène selon l’équation de la réaction : 2 H2O2 (aq) →
2 H2O (ℓ) + O2 (g)
-
Calculer la quantité de matière
maximale nmax (O2) de dioxygène
libéré par un litre de solution S0. 7. Dans les conditions de l’expérience, le volume molaire vaut Vm = 22,4 L . mol–1. En déduire le volume maximal de
dioxygène Vmax (O2) libéré par
un litre de solution S0. 8.
Comparer ce résultat à la valeur indiquée
par le fabricant en faisant le calcul d’écart relatif.
Conclure.
-
Données : - Couples oxydant / réducteur : - MnO4– (aq) / Mn2+
(aq) et O2 (aq) / H2O2
(aq).
-
Les ions permanganate MnO4–
(aq) donnent une couleur violette à la solution qui les contient.
-
Le contrôle de qualité est considéré
comme satisfaisant si l’écart relatif est inférieur à 5 %.
-
Écart relatif :
|
Titrage colorimétrique de l’eau oxygénée :
-
Réactif titré :
-
Solution S1 de
peroxyde d’hydrogène H2O2 (aq).
-
Volume de la solution : V1
= 10,0 mL
-
Concentration de la solution : C1
= ? (à déterminer)
-
Réactif titrant :
-
Solution S2 de
permanganate de potassium, MnO4– (aq)
-
Concentration de la solution :
C2 = 0,020 mol . L–1
-
Volume versé à l’équivalence est VE
= 17,6 mL 1.
Équation de la réaction support du dosage.
-
Couple MnO4–
(aq) / Mn2+ (aq) :
-
On peut retrouver les demi-équations
électroniques : MnO4–
(aq) / Mn2+ (aq)
Demi-équation électronique
Première étape :
On
écrit le couple
oxydant / réducteur
MnO4–
(aq)
Deuxième étape : On équilibre
l’élément oxygène avec
de l’eau
MnO4–
(aq)
Troisième étape : On équilibre
l’élément hydrogène
avec H+
(on travaille
en milieu acide)
MnO4– (aq)
+
8
H+
(aq)
Quatrième étape : On
équilibre les charges avec les
électrons.
MnO4–
(aq) +
8
H+
(aq)
+ 5
e –
-
Couple O2 (aq) /
H2O2 (aq) : O2
(g) / H2O2 (aq) Demi-équation électronique
Première étape :
On
écrit le couple
oxydant / réducteur
O2
(g)
Troisième étape : On équilibre
l’élément hydrogène
avec H+
(on travaille
en milieu acide)
O2
(g) +
2
H+
(aq)
Quatrième étape : On
équilibre les charges avec les
électrons.
O2
(g) +
2
H+
(aq) + 2
e –
-
Équation bilan de la réaction :
(
MnO4–
(aq) +
8
H+
(aq)
+ 5
e –
(H2O2 (aq)
2
MnO4–
(aq) + 5
H2O2 (aq) +
6
H+
(aq)
→ 2
Mn2+ (aq)
+
5 O2 (g) +
8
H2O
(ℓ)
2.
Le titrage : a.
Le dispositif de titrage.
-
Montage : b.
Repérage visuel de
l’équivalence du titrage.
-
La seule espèce colorée est l’ion
permanganate MnO4– (aq) qui donne une
couleur violette à la solution qui les contient.
-
Avant l’équivalence, l’ion
permanganate est le réactif limitant.
-
Le mélange réactionnel est incolore.
-
À l’équivalence, les réactifs sont
mélangés dans les proportions stœchiométriques et sont totalement
consommés.
- Il y a changement de réactif limitant.
-
Le mélange réactionnel est toujours
incolore.
-
Après l’équivalence, le réactif titré
est le réactif limitant.
-
L’ion permanganate est en excès et
colore le mélange réactionnel en rose.
-
On repère l’équivalence grâce à ce
changement de couleur. 3.
Relation à l’équivalence du titrage et
l’expression de la concentration C1 en peroxyde
d’hydrogène de la solution
S1.
-
Cette relation
fait intervenir les réactifs : MnO4–
(aq) et H2O2 (aq)
-
Une méthode pour retrouver la
relation :
-
Équation
de titrage 2
MnO4–
(aq)
+
5
H2O2 (aq)
→
…
Quantités
de
matières
à
l’équivalence
nE
(MnO4–) =
C2
. VE
n0
(H2O2) = C1
. V1
…
Coefficients
stœchiométriques
2
5
…
Relation
…
-
-
4.
Valeurs des concentrations C1
puis C0.
-
Valeur de la concentration C1
:
-
-
Valeur de la concentration C0
:
-
On dilue 10 fois la solution S0,
on obtient une solution S1 :
-
C0
= 10 C1
-
C0
≈ 0,88
mol . L–1 5.
Quantité n0 (H2O2)
de peroxyde d’hydrogène présente dans un litre de solution
commerciale S0.
-
n0 (H2O2)
= C0 . V ≈ 0,88 × 1,0
-
n0 (H2O2)
≈ 0,88 mol 6.
Quantité de matière maximale nmax
(O2) de dioxygène libéré par un litre de solution
S0.
-
Réaction chimique mise en jeu : 2 H2O2 (aq) →
2 H2O (ℓ) + O2 (g)
-
Tableau d’avancement :
en considérant que la
réaction est totale : xf
= xmax Équation
2 H2O2
(aq)
→
O2
(aq) + 2
H2O (aq)
État du
système
Avanc.
n (H2O2)
(mol)
n (O2)
(mol)
État initial
(mmol)
x =
0
n0
≈ 0,88
0
État
intermédiaire
x
0,88 – 2 x
x
État
Final
(mmol)
xf =
xmax
0,88 – 2 xmax
xmax
xf =
xmax
0
0,44
-
Valeur de l’avancement maximal :
-
0,88
– 2 xmax = 0
=>
xmax ≈ 0,44 mol
-
Quantité de matière maximale nmax
(O2) de dioxygène libéré :
-
nmax (O2)
= xmax ≈ 0,44 mol 7.
Volume maximal de dioxygène Vmax
(O2) libéré par un litre de solution S0
-
Le volume molaire : Vm
= 22,4 L . mol–1.
-
Volume maximal de dioxygène Vmax
(O2) libéré :
-
Vmax (O2)
= nmax (O2) . Vm
-
Vmax (O2)
≈ 0,44 ×22,4
-
Vmax
(O2) ≈ 9,856 L
-
Vmax (O2)
≈ 9,9 L 8.
Valeur de l’écart relatif et conclusion :
-
Écart relatif :
-
L’eau oxygénée étant à « 10
volumes », un litre de solution libère 10 L de dioxygène dans les
même conditions de température et de pression.
-
-
r ≈ 1 % < 5 %
-
le contrôle de qualité est
satisfaisant.
![]() Mn2+ (aq)
Mn2+ (aq)
![]() Mn2+
(aq) +
4
H2O
(ℓ)
Mn2+
(aq) +
4
H2O
(ℓ)
![]() Mn2+ (aq) +
4
H2O
(ℓ)
Mn2+ (aq) +
4
H2O
(ℓ)
![]() Mn2+ (aq)
+ 4
H2O
(ℓ)
Mn2+ (aq)
+ 4
H2O
(ℓ)
![]() H2O2
(aq)
H2O2
(aq)
![]() H2O2 (aq)
H2O2 (aq)
![]() H2O2
(aq)
H2O2
(aq)
![]() Mn2+ (aq)
+ 4
H2O
(ℓ)
) × 2
Mn2+ (aq)
+ 4
H2O
(ℓ)
) × 2
![]() O2
(g) + 2
H+
(aq)
+ 2
e –
) × 5
O2
(g) + 2
H+
(aq)
+ 2
e –
) × 5
![]()
![]()
![]()


![]()
5)- Exercice 15 page 76 : Titrage indirect de la vitamine C :
|
Titrage indirect de la vitamine C :
-
Comparer la masse de vitamine C
contenue dans un jus de fruit à celle d’un comprimé.
A.
La vitamine C. - La vitamine C, de formule C6H8O6, est le nom donné à l’acide ascorbique. - La vitamine C est synthétisée par de nombreux êtres vivants, mais pas par l’être humain qui doit la trouver dans son alimentation, notamment dans les fruits. Un comprimé de « vitamine C 500 » contient 500 mg de
vitamine C. B.
Principe du dosage indirect de la vitamine
C. - Une quantité n1 de vitamine C réagit avec une quantité connue de diiode en excès nexcès (I2). Le diiode restant
est titré par une solution de thiosulfate de sodium.
-
On presse deux oranges : on obtient
un volume V0 = 88,0 mL de jus de fruit.
-
Dans un erlenmeyer, on verse un
volume V1 = 10,0 mL de jus de fruit.
-
On ajoute dans l’erlenmeyer un volume
V2 = 15,0 mL d’une solution de concentration C2 = 4,70
× 10–3 mol . L–1 en diiode.
-
Le diiode restant est dosé par une
solution de thiosulfate de sodium de concentration C3 = 5,00
× 10–3 mol . L–1 en ions thiosulfate S2O32–
(aq).
-
Le volume versé à l’équivalence du
titrage est VE = 13,0 mL.
-
Données :
-
Couples Oxydant / réducteur : C6H6O6
(aq) / C6H8O6
(aq)
-
I2 (aq) / I–
(aq) ; S4O62– (aq) /
S2O32– (aq)
-
Masse molaire de la vitamine C :
M = 176,0 g . mol–1
-
La réaction entre la vitamine C
et le diiode est totale. |
|
Titrage indirect de la vitamine C :
-
Comparer la masse de vitamine C
contenue dans un jus de fruit à celle d’un comprimé.
-
Un résumé de la situation : 1)- Première
étape : réaction entre la vitamine C et le diiode en excès :
-
Une quantité n1 de
vitamine C réagit avec une quantité connue de diiode en excès nexcès (I2) :
-
La vitamine C du jus de
fruit : V0 = 88,0 mL
-
On utilise le volume V1
= 10,0 mL de jus de fruit.
-
La solution de diiode :
-
Concentration de la solution de
diiode :
-
C2 = 4,70 × 10–3
mol . L–1
-
V2 = 15,0 mL
-
Quantité de matière de diiode en
excès nexcès (I2) :
-
nexcès (I2) =
C2 . V2
-
Équation de la réaction :
-
Les couples mis en jeu : C6H6O6
(aq) / C6H8O6
(aq) et I2 (aq) / I– (aq)
-
Demi-équation électroniques :
-
Tableau d’avancement :
-
La réaction entre la vitamine C
et le diiode est totale : xf = xmax
-
Le diiode est en excès, la vitamine
C est le réactif limitant :
-
En fin de réaction :
-
n1 –
xmax = 0 =>
xmax = n1
-
Connaissant l’expression de
l’avancement maximal, on peut en déduire, l’expression de la
quantité de matière de diiode restant :
-
nrestant (I2) =
nexcès (I2) –
n1 2)- Le dosage
du diiode restant :
-
Le diiode restant est dosé par une
solution de thiosulfate de sodium :
-
Réactif titré : le diiode
restant
-
nrestant (I2) =
nexcès (I2) –
n1
-
Le réactif titrant : Solution
de thiosulfate de sodium
-
Concentration en ions thiosulfate
S2O32– (aq) :
-
C3 = 5,00 × 10–3
mol . L–1
-
Volume versé à l’équivalence du
titrage :
-
VE = 13,0 mL.
-
Quantité de matière d’ions
thiosulfate
S2O32– (aq)
correspondante :
-
n3
= C3 . VE
-
Équation de la réaction :
-
Les couples mis en jeu : I2
(aq) / I– (aq) ; S4O62–
(aq) / S2O32– (aq)
-
Les demi-équations électroniques :
-
I2 (aq)
+
2 e –
-
S4O62–
(aq) +
2
e –
-
Équation de la réaction :
-
Tableau d’avancement : la réaction
est totale (réaction de titrage)
- à l'équivalence; on est en présence d'un mélange stœchiométrique.
-
Un mélange initial est dit
stœchiométrique si les quantités de matières initiales des réactifs
sont dans les proportions des nombres stœchiométriques de l’équation
de la réaction :
-
Les quantités de matières initiales
des réactifs vérifient la relation suivante :
-
3)-
Exploitation des résultats :
-
nrestant (I2) =
nexcès (I2) –
n1 =>
n1 = nexcès (I2) –
nrestant (I2)
-
n1 = C2 .
V2 – nrestant (I2)
-
D’autre part :
-
-
-
On tire :
-
-
Ceci
dans 10,0 mL de jus de fruit :
-
On presse deux oranges : on obtient
un volume V0 = 88,0 mL de jus de fruit.
-
Quantité de matière n de
vitamine C dans le volume V0 :
-
-
Masse de m vitamine C
correspondante :
-
m = n . M ≈ 3,24 × 10–4
× 176,0
-
m ≈ 5,88544
× 10–2 g
-
m ≈ 5,89 × 10–2 g
-
m ≈ 58,9 mg
-
À comparer avec un comprimé de
« vitamine C 500 » qui contient 500 mg de vitamine C.
-
Il faut boire le jus de 17
oranges environ pour obtenir la même quantité de vitamine C qu’un comprimé
de « vitamine C 500 ».
-
Ce qui fait environ 0,75 L de jus
d’orange. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
6)- Exercice 16 page 76 : Titrage du paracétamol :
|
Titrage du paracétamol : BACCALAURÉAT GÉNÉRAL PHYSIQUE-CHIMIEon réalise une hydrolyse du paracétamol en para-aminophénol puis on dose le para-aminophénol par les ions
cérium (IV) Ce4+ (aq). A.
Hydrolyse du paracétamol en para-aminophénol
-
On hydrolyse le paracétamol C8H9NO2
(aq) contenu dans un comprimé de Doliprane®.
-
L’équation de la réaction, considérée
comme totale, s’écrit : C8H9NO2
(aq) + H2O (aq) → C6H7NO
(aq) + C2H4O2
(aq)
-
On obtient du para-aminophénol C6H7NO
(aq). - On verse la solution obtenue dans une fiole jaugée de 100,0 mL et on complète jusqu’au trait de jauge avec de l’eau distillée.
Soit S1
la solution obtenue, on note C1 la concentration
en quantité de matière de para-aminophénol dans S1. B.
Titrage du para-aminophénol. - On dose un volume V1 =10 ,00 ± 0,05 mL de solution S1 par une solution titrante S2 de concentration
C2
= (5,00 ± 0,01 ) × 10–2 mol . L–1 en ions cérium (IV) Ce4+ (aq).
-
Le volume versé à l’équivalence est
VE = 13,1 ± 0,1 mL.
-
L’équation de la réaction support du
titrage s’écrit : C6H7NO
(aq) + 2 Ce4+ (aq) + H2O
(ℓ) → C6H4O2
(aq) + 2 Ce3+ (aq) + NH4 +
(aq) + H + (aq) 1.
Avec quelle verrerie de précision
mesure-t-on le volume V1 de la solution S1 ? 2.
Écrire la relation à l’équivalence du
titrage et en déduire la concentration C1 en para-aminophénol de la solution
S1. 3.
Identifier quelques sources d’erreurs lors
du titrage. 4.
L’incertitude type u (C1)
sur la concentration C1 est donnée par la
relation :
-
-
Avec u (C2),
u (VE) et u (V1)
respectivement les incertitudes types sur C1, VE
et V1.
-
Calculer u (C1)
et exprimer la concentration C1 sous forme : C1
± u (C1) 5.
En déduire la quantité de matière n1
de para-aminophénol dans la solution S1. 6.
Justifier que la quantité de paracétamol
dans un comprimé est égale à la quantité n1. 7. En utilisant les résultats du titrage, déterminer la masse m de paracétamol contenu dans le comprimé de Doliprane®. Conclure.
-
Donnée :
-
M (paracétamol) = 151,0 g .
mol–1 |
|
Titrage du paracétamol : 1.
Verrerie de précision pour mesurer le volume
V1 de la solution S1 :
-
Pipette jaugée de 10,0 mL, munie de
sa propipette. 2.
Relation à l’équivalence du titrage et
concentration C1 en para-aminophénol de la solution
S1.
-
Réactif titré : Solution S1
de para-aminophénol.
-
Volume de la solution : V1
=10 ,00 ± 0,05 mL
-
Concentration de la solution en
para-aminophénol : C1 (inconnue)
-
Réactif titrant : Solution
titrante S2 en ions cérium (IV) Ce4+
(aq).
-
Concentration :
C2 = (5,00
± 0,01 ) × 10–2 mol . L–1
-
Le volume versé à l’équivalence :
VE = 13,1 ± 0,1 mL.
-
L’équation de la réaction support du
titrage : C6H7NO
(aq) + 2 Ce4+ (aq) + H2O
(ℓ) → C6H4O2
(aq) + 2 Ce3+ (aq) + NH4 +
(aq) + H + (aq)
-
À l’équivalence du titrage, on a
réalisé un mélange stœchiométrique des réactifs titrant et titré.
-
La relation à l’équivalence du
titrage s’écrit :
-
Concentration C1 en
para-aminophénol de la solution S1.
-
-
Application numérique :
-
-
Erreur lors du prélèvement du volume
V1 de la solution S1.
-
Erreur sur la valeur de la
concentration C2 de la solution titrante S2
en ions cérium (IV) Ce4+ (aq).
-
Repérage de l’équivalence : erreur de
lecture du volume à la burette graduée.
-
Mauvais repérage de l’équivalence :
-
On peut faire un premier titrage
rapide pour connaître VE au millilitre,
-
puis un titrage plus précis pour
connaître VE à la goutte près.
-
Expression du type : C1
± u (C1) :
-
C1 = (3,28 ± 0,03 )
× 10–2 mol . L–1 5.
Quantité de matière n1 de
para-aminophénol dans la solution S1.
-
Le volume de la solution S1 est VS1
= 100,0 mL
-
n1 = C1
. VS1 ≈ 3,28 × 10–2 × 100,0 × 10–3
-
n1 ≈ 3,28 × 10–3
mol 6.
Quantité de paracétamol dans un comprimé.
-
Le para-aminophénol a été obtenu à
partir de la réaction d’hydrolyse du paracétamol :
-
La réaction d’hydrolyse est la
suivante :
-
L’équation de la réaction, considérée
comme totale, s’écrit : C8H9NO2
(aq) + H2O (aq) → C6H7NO
(aq) + C2H4O2
(aq)
-
D’après les coefficient
stœchiométriques, il se forme autant de para-aminophénol qu’il disparaît de paracétamol :
-
n (paracétamol) = n1
≈ 3,28 × 10–3 mol 7.
Masse m de paracétamol contenu dans
le comprimé de Doliprane® et Conclusion :
-
m = n (paracétamol) .
M (paracétamol)
-
m ≈ 3,28 × 10–3 ×
151,0
-
m ≈ 0,495 g
-
m ≈ 495 mg
-
Il s’agit certainement d’une gélule
de Doliprane 500 mg.
-
Additif :
-
Paracétamol :
-
Formule brute : C8H9NO2
-
Masse molaire : M
(paracétamol) = 151,2 g . mol–1
-
Formule topologique :
-
Para-aminophénol : (4-aminophénol)
-
Formule brute : C6H7NO
-
Masse molaire : M
(para-aminophénol) = 109,1 g . mol–1
-
Formule topologique :
-
Acide éthanoïque : (acide acétique) :
-
Formule brute : CH3COOH
-
Masse molaire : M (CH3COOH)
= 60,1 g . mol–1
-
Formule topologique :
-
Réaction d’hydrolyse du paracétamol :
|
||||||||||||||||||||||||
|
|