|
Chim N° 09 |
Synthèse d'une espèce chimique. Cours. |
|
|
Mots clés : Cours de chimie seconde Espèce chimique, synthèse, mode opératoire, chimie de synthèse, réalisation d'une synthèse, étapes de transformation, séparation, purification, identification, synthèse d'un ester à l'odeur fruitée, synthèse de l'aspirine, ampoule à décanter, baume du Pérou, texticaments, chauffage à reflux, C.C.M, styrène, polystyrène, polymérisation, AIBN, toluène, pictogrammes, méthybenzène, p-tert-butylcatéchol, 2,2-azobis (2-méthylpropionitrile), verrerie, agitateur, magnétique, chauffant, chauffage à reflux, ampoule de coulée, CCM polystyrène, heptane, 1,4-dioxane, acétone, propanone, propan-2-one, éluant, , ... |
|
|
|
II- Réalisation d’une
synthèse. 2)- L’étape de transformation. |
|
TP Chimie : Les différentes techniques d'extraction. |
|
|
|
Exercices : énoncé et correction a)- Exercice 3 page 282 : connaître le matériel utilisé pour une synthèse. b)- Exercice 5 page 282 ; nommer les étapes d’une synthèse. c)- Exercice 9 page 284 : Le
baume du Pérou. d)- Exercice 13 page 286 : les
texticaments. |
I- Nécessité de la chimie de synthèse.
- Réaliser la synthèse d’une espèce chimique, c’est la préparer à partir d’autres espèces chimiques grâce à une transformation chimique.
-
La synthèse est la préparation d’une espèce chimique à
partir de réactifs.
-
Elle se déroule en trois étapes :
-
Étape 1 : synthèse de l’espèce chimique (Montage :
chauffage à reflux).
-
Étape 2 : isolement de l’espèce chimique (Extraction
solide/liquide ou liquide/liquide, filtration, décantation,…)
- Étape 3 : Identification de l’espèce chimique
- (Mesure de
la température d’ébullition, mesure de l’indice de réfraction,
mesure de la température de fusion, réalisation du C.C.M)
- Pour répondre aux besoins de l’homme, l’industrie chimique synthétise un nombre considérable de produits.
- On distingue : la chimie lourde et la chimie fine.
► La chimie lourde synthétise, à partir de matières premières simples des produits en grande quantité :
- La chimie lourde fabrique des espèces chimiques en grande quantité et pour un coût peu élevé.
- Ces synthèses nécessitent peu d’étapes.
- Synthèse de matières plastiques (polyéthylène, polychlorure de vinyle PVC…) :
- La production française de PVC dépasse le million de tonnes.
- Synthèse de l’ammoniac (NH3,…).
- Synthèse de l’aluminium (bauxite → alumine)
► La chimie fine synthétise des substances plus complexes :
- Les parfums et les médicaments sont des produits de la chimie fine.
- La chimie fine élabore, à partir des produits de la chimie lourde ou d’espèces naturelles, des espèces chimiques à haute valeur ajoutée.
- Les médicaments préparés en plus faibles quantités que ceux de la chimie lourde, sont plus coûteux et nécessitent souvent de nombreuses réactions chimiques successives.
- Synthèse de l’acétate de linalyle.
- Synthèse de l’aspirine (acide acétylsalicylique).
II- Réalisation d’une synthèse.
![]() Le protocole expérimental précise : (ou mode
opératoire)
Le protocole expérimental précise : (ou mode
opératoire)
- La nature et les quantités de réactifs nécessaires,
- Le solvant approprié,
- Les consignes de sécurité à respecter,
- Le montage utilisé,
- Les différentes étapes à effectuer.
- Exemple : le chauffage à reflux
|
Chauffage à Reflux
|
1- Réfrigérant. 2- Ballon. 3- Chauffe-ballon. 4- Sortie de l’eau. 5- Arrivée de l’eau. 6- Mélange réactionnel. 7- Vallet ou Support. |
|
Ce montage permet de maintenir le milieu réactionnel à une température constante, en l'occurrence
pratiquement la température d'ébullition du solvant. Les
vapeurs sont condensées dans le réfrigérant et
retournent à l'état liquide dans le ballon. Les
réactifs et les produits restent dans le milieu
réactionnel. La présence du Vallet est obligatoire. Elle permet
d’enlever le chauffe-ballon sans toucher au reste du
montage (ballon et réfrigérant). Dans
le réfrigérant, l’eau circule du bas vers le haut. À la fin de la synthèse, on refroidit le milieu réactionnel pour
-
Des
raisons de sécurité (pour éviter les brûlures)
-
Condenser les vapeurs
éventuellement toxiques.
-
Faire précipiter le produit
s’il est solide. |
|
2)- L’étape de transformation.
- Lors de la synthèse d’une espèce chimique, des réactifs réagissent pour former un ou plusieurs produits, dont l’espèce attendue.
- Réactifs et produits d’une synthèse.
-
La synthèse d’une espèce chimique nécessite d’autres
espèces chimiques.
-
Les espèces chimiques nécessaires à la synthèse sont
appelées : les réactifs de la synthèse.
-
Les espèces chimiques obtenues sont appelées : les
produits de la synthèse.
|
Réactifs |
→ |
Produits |
- Les réactifs et les produits différent par leurs caractéristiques physiques.
- Exemple : Pour synthétiser l’acétate d’isoamyle, on utilise de l’acide acétique et de l’alcool isoamylique.
|
|
densité |
θ eb °C |
Solubilité dans
l'eau |
Formule brute |
|
Acide éthanoïque |
1,05 |
118,2 |
Grande |
CH3COOH |
|
Alcool
isoamylique |
0,81 |
128 |
Faible |
C5H11OH |
|
Éthanoate de 3-méthylbutyle |
0,87 |
142 |
Très faible |
C7H14O2 |
- On peut schématiser cette transformation chimique comme suit :
|
Réactifs |
Transformation chimique |
Produits |
||||||
|
|
Donne → |
|
Ou
C2H4O2
+ C5H12O
→ C7H14O2
+ H2O
- Certaines réactions, qui sont lentes à température ambiante, nécessitent un chauffage qui permet d’accélérer la réaction.
- On effectue alors un chauffage à reflux pour éviter les pertes d’espèces chimiques par vaporisation.
- Pour accélérer certaines réactions chimiques, on peut ajouter un catalyseur au mélange réactionnel.
|
Le catalyseur : Un catalyseur est une substance qui accélère une réaction sans entrer dans le bilan de la réaction et sans modifier l’état final du système. |
3)- Les étapes de séparation et de purification.
- L’espèce chimique obtenue par synthèse est généralement mélangée :
- Au solvant,
- Aux réactifs restants,
- Et aux autres produits de la réaction.
► Les techniques de séparation : cela dépend de la nature de l’espèce synthétisée
- Si l’espèce synthétisée est un solide :
- On peut la séparer par filtration
- Et la purifier par recristallisation.
- Si l’espèce est dissoute dans le mélange réactionnel,
- On peut la séparer par extraction
- Puis la purifier par évaporation ou distillation.
- Il est nécessaire de vérifier la présence de l’espèce attendue ainsi que son degré de pureté.
- La caractérisation de l’espèce chimique peut se faire grâce à ses propriétés physiques :
- Aspect,
- Solubilité,
- Température d’ébullition, température de fusion,
- Densité,
- Indice de réfraction…
- On peut effectuer une analyse comparative :
-
On peut réaliser une chromatographie sur couche mince (C.C.M) :
-
De l’espèce synthétique,
-
De l’espèce de référence,
-
D’un extrait naturel contenant la même espèce chimique.
-
Il faut ensuite comparer la position des différentes
taches du chromatogramme obtenu.
- Remarque : Une espèce chimique d’origine naturelle est identique à l’espèce chimique obtenue par synthèse.
- Rien ne
permet de les différencier.
III- Exemple : synthèse de l’acide acétylsalicylique.TP N° 11
a)-
Quelques données.
|
Espèce chimique |
M g / mol |
densité |
Pictogrammes
de sécurité |
||
|
Styrène |
104 |
0,91 |
Inflammable |
Toxique,
irritant |
|
|
AIBN |
164 |
1,11 |
Inflammable |
Danger pour
le milieu aquatique |
Toxique,
irritant |
|
Toluène |
92 |
0,87 |
Inflammable |
Toxique,
irritant |
Cancérogène,
tératogène |
b)-
Introduction.
-
Les polymères sont très utilisés
dans le sport car ils constituent souvent les matériaux de base
à la construction du matériel utilisé par les sportifs.
-
On peut citer par exemple le
polyuréthane utilisé dans les combinaisons des nageurs et ayant
permis entre 2005 et 2009 une spectaculaire amélioration
des performances.
-
L'utilisation des polymères dans l'élaboration des équipements du sportif constitue
aujourd'hui, avec la pharmaceutique, le principal lien entre
sportifs et chimistes.
-
Pour illustrer cette contribution
des chimistes à la pratique du sport,
on propose d’étudier, la fabrication d'un polymère : le
polystyrène.
-
Le polystyrène est une matière dure, cassante et
très transparente.
-
Parmi les plastiques industriels
usuels, c'est un produit de très grande diffusion, offrant un
vaste champ
d'application.
- L'application la plus connue est le polystyrène expansé, sorte de mousse blanche compacte qui sert au niveau de l’habitat à l’isolation des murs,
- à emballer les appareils sensibles aux chocs (électroménager, chaîne hifi...),
- mais c'est aussi le plastique transparent et dur
utilisé pour de nombreux types de boîtes et boîtiers (Boîtier
CD, couverts, verres, …).
-
Le solvant utilisé pour cette
réaction est le toluène.

-
L’AIBN permet l’amorçage de la
réaction de polymérisation.
- Ce polymère est employé dans le domaine du nautisme, en particulier le surf,
- pour la fabrication
des planches mais aussi dans le conditionnement des produits et
l’isolation thermique.
c)-
Synthèse du polystyrène.
-
Pour réaliser la synthèse du polystyrène, on utilise :
-
5 mL de styrène pur,
- 20 mL d’une solution d’AIBN dans le toluène (3,4 g d’AIBN pour 100 mL de toluène)
- On ajoute la solution d’AIBN grâce à une ampoule de coulée.
- On commence par 5 mL de solution.
-
AIBN : 2,2-azobis
(2-méthylpropionitrile). (C8H12N4).
|
Nom |
AIBN |
Styrène |
|
Formule brute |
C8H12N4 |
C8H8 |
|
Formule semi-développée |
2,2-azobis
(2-méthylpropionitrile) ou 2,2'-(E)-diazene-1,2-diylbis(2-methylpropanenitrile) |
|
|
Représentation 3
D |
|
|
-
Le solvant :
|
Nom |
Toluène |
|
Formule brute |
C7H8 |
|
Formule semi-développée et topologique |
Méthylbenzène
|
|
Représentation 3
D |
|
►
Remarque :
-
Si on utilise le styrène du
commerce
-
Le styrène commercial utilisé
contient une faible quantité de stabilisant, le
4-tertbutylcatéchol (Environ 15 mg par kg de styrène),
inhibiteur de réactions radicalaires.
-
Il permet d’empêcher la
polymérisation du styrène dans la bouteille.
-
Le styrène est sensible à la
lumière et la chaleur et peut se polymériser dans la bouteille.
-
Pour obtenir du styrène pur, on
l’isole du p-tert-butylcatéchol (C10H14O2)
par lavages.
-
4-tert-butylcatéchol
|
Nom |
p-tert-butylcatéchol
|
|
Formule brute |
C10H14O2 |
|
Formule semi-développée et topologique |
4-tert-butylbenzene-1,2-diol
|
|
Représentation 3
D |
|
![]() Lavage du styrène commercial :
Lavage du styrène commercial :
-
1.
Prélever 15 mL de styrène à l’aide d’une éprouvette
graduée de 50 mL. Les verser (sous la hotte commune) dans un
erlenmeyer.
-
2.
Fixer l’ampoule à décanter, puis introduire les 15 mL de
styrène.
-
3.
Prélever 15 mL de soude de concentration à 1,0 mol / L
dans une éprouvette graduée de 50 mL.
-
4.
Verser la solution de soude dans l’ampoule à décanter.
-
5.
Boucher, agiter l’ampoule, dégazer puis laisser décanter
(sans oublier d’enlever le bouchon).
-
6.
Éliminer la phase aqueuse.
-
7. Laver une fois avec 15 mL de solution de soude
[Na+
-
8.
Laver deux fois la phase organique avec 20 mL d’eau
distillée (Agiter l’ampoule, dégazer puis laisser décanter).
-
9.
Récupérer la phase aqueuse
-
10. Recueillir par le haut de
l’ampoule à décanter le styrène dans un erlenmeyer.
- 15. Le styrène est ensuite séché sur carbonate de potassium anhydre :
Ajouter 1 spatule de carbonate de potassium (ou de sulfate de magnésium anhydre) dans l’erlenmeyer,
- agiter manuellement,
- boucher avec
un bouchon en liège et laisser reposer pendant quelques minutes.
-
16. Le styrène est filtré sur un
petit entonnoir en verre muni d’un petit morceau de coton.
-
On obtient le styrène pur.
![]() Le montage :
Le montage :
-
Le montage où se déroule la
réaction doit permettre :
-
De contrôler la température du
milieu réactionnel,
-
D’agiter et chauffer le milieu
réactionnel sans perte de matière,
-
De réaliser des ajouts de liquide
au cours de la réaction.
-
D’éloigner rapidement la source
de chaleur en cas de surchauffe.
![]() Dans la liste de matériel, cocher
ce dont vous avez besoin pour réaliser cette synthèse.
Dans la liste de matériel, cocher
ce dont vous avez besoin pour réaliser cette synthèse.
![]() Réaliser un schéma du montage :
Réaliser un schéma du montage :
►
Le matériel :
-
Cocher le matériel nécessaire :
|
a |
b |
c |
d |
e |
f |
|
|
|
x |
|
x |
|
|
g |
h |
i |
j |
k |
l |
|
x |
x |
|
|
|
|
|
m |
n |
o |
p |
q |
r |
|
x |
|
|
|
|
|
|
s |
t |
u |
v |
x |
y |
|
x |
x |
x |
x |
x |
|
-
Matériel :
- Ampoule de coulée (c), ballon tricol (e), thermomètre (g), vallet ou support élévateur (h), réfrigérant vertical (m),
- Bécher (s), bouchon rodé (t), noix de
serrage (u), pince (v), olive aimantée (x),
-
Pas présent dans la liste du
matériel : support avec potence, dispositif de chauffage avec
agitateur magnétique.
►
Montage :
-
Agitateur magnétique chauffant :

Bouton température et bouton
agitation
d)-
Récupération du polystyrène :
-
À la fin de la réaction, le
ballon contient essentiellement du polystyrène et du toluène.
-
On verse le mélange dans l’un des
trois solvants suivants et on récupère le polystyrène solide
avec un dispositif approprié.
|
Solvant |
Toluène |
Éthanol |
Méthanol |
|
Solubilité du polystyrène |
+ |
– |
–
– |
|
Solubilité du styrène |
+ |
+ |
+ |
|
Pictogrammes |
|
|
|
![]() Élaborer un protocole détaillé
permettant de récupérer le polystyrène.
Élaborer un protocole détaillé
permettant de récupérer le polystyrène.
►
Précipitation du polystyrène :
-
On verse le mélange réactionnel
dans un solvant ou le polystyrène est très peu soluble.
-
Ainsi, le polystyrène précipite.
-
L’éthanol et le méthanol
conviennent, mais on choisit l’éthanol car il est moins toxique
que le méthanol.
-
Ensuite, on peut récupérer le
polystyrène solide par filtration.
![]() Protocole :
Protocole :
-
On verse le mélange réactionnel,
sous agitation, dans un bécher contenant de l’éthanol à
température ambiante.
![]() Filtration sous pression
réduite :
Filtration sous pression
réduite :
-
On humidifie le papier filtre
avec de l’éthanol pour qu’il adhère aux parois du filtre
Büchner.
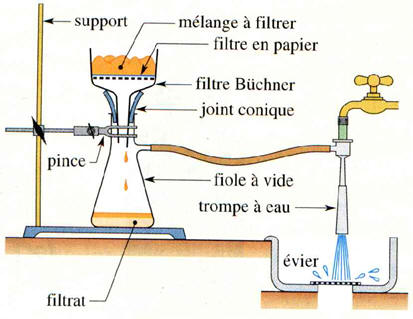
-
On récupère ainsi le polystyrène
solide.
►
Caractérisation du polymère :
-
Une caractérisation pertinente
d’un polymère passe par la détermination de sa masse molaire
moyenne.
-
On cherche à obtenir ici
l’intervalle approximatif dans lequel se situent les masses
molaires des polymères contenus dans l’échantillon
synthétisé.
-
On
propose donc de déposer
sur une plaque CCM le produit synthétisé ainsi que
plusieurs
polystyrènes de référence (de masses molaires respectives :
3460, 9630, 139000 g . mol –1).
![]() On dissout 6 cg de chaque
échantillon de polystyrène dans 10 mL d’acétone.
On dissout 6 cg de chaque
échantillon de polystyrène dans 10 mL d’acétone.
-
Le choix de l’éluant est une
étape cruciale dans la réalisation d’une CCM.
- L’éluant de la CCM doit être préparé avec une grande précision et dans un récipient fermé hermétiquement pour éviter toute évaporation de ses constituants :
- Le moindre écart dans les
proportions fausse considérablement les résultats ;
l’utilisation de verrerie
jaugée est nécessaire.
-
Les résultats de cette analyse chromatographique sont exceptionnellement sensibles à la composition de l’éluant :
|
Composition de
l’éluant |
Rapports
frontaux Rf
des polymères de référence |
||||
|
Mélange |
Proportions
volumiques |
M Masse molaire |
M Masse molaire |
M Masse molaire |
|
|
N° |
1,4-dioxane |
Heptane |
3460 g . mol–1 |
39630 g . mol–1 |
139000 g . mol–1 |
|
1 |
4,4 |
5,0 |
0,61 |
0,50 |
0,18* |
|
2 |
4,5 |
5,0 |
0,57 |
0 ,49 |
0,22 |
|
3 |
4,6 |
5,0 |
0,63 |
0,54 |
0,30 |
|
4 |
4,7 |
5,0 |
0,55 |
0,49 |
0,32 |
|
5 |
4,8 |
5,0 |
0,65 |
0,57 |
0,36 |
|
6 |
4,9 |
5,0 |
0,55 |
0,51 |
0,35 |
|
7 |
5,0 |
5,0 |
0,74 |
0,66 |
0,51 |
* : tache de forme assez allongée.
-
Les différents constituants :
|
Heptane |
1,4-dioxane |
Acétone |
|
|
|
Propan-2-one |
|
|
|
|
|
|
|
|
►
Choix de l’éluant :
-
Le choix de l’éluant est une
étape cruciale dans la réalisation d’une CCM.
-
Parmi les éluants proposés en
annexe, celui qui est adapté à l’expérience, est le mélange N°
3.
-
C’est le mélange 4,6 volumes de
1,4-dioxane pour 5 volumes d’heptane.
-
Il permet une meilleure
différenciation des différentes taches (l’écart entre les
différentes taches est le plus important).
-
Il rend le chromatogramme plus
lisible.
2)- QCM : pour chaque question, indiquer la (ou les) bonne(s) réponse(s).
|
|
3)- Exercices : Exercices : énoncé et correction
a)- Exercice 3 page 282 : connaître le matériel utilisé pour une synthèse.
b)- Exercice 5 page 282 ; nommer les étapes d’une synthèse.
|
|






























