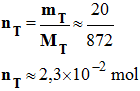|
Anabac Sciences Physiques Pondichéry 2012 Exercice 3 correction Énoncé et Correction |
|
|
|
EXERCICE 3 -
Nettoyants pour sols
(4
points)
1ière partie : l’huile de lin. |
EXERCICE 3 - Nettoyants pour sols (4 points)
|
Les produits d’entretien ménager peuvent contenir certaines substances chimiques ayant un impact négatif sur l’environnement et la santé. Les agences régionales de l’environnement ont pour mission d’informer et de sensibiliser le public.
Sur le site de l’une d’elles,
on trouve le texte suivant. |
|
Les produits ménagers : nettoyez
sans polluer ! Les produits d’entretien peuvent contenir des substances chimiques dont certaines ne sont pas biodégradables et dont les impacts sur l’environnement et la santé sont douteux voire négatifs. [...] Nettoyants pour les sols ils contiennent parfois du LAS (linear-alkylbenzène-sulfonate), un tensioactif pétrochimique [...], particulièrement nocif pour l’environnement [...] et pour la santé
provoquant parfois
irritations ou allergies respiratoires (pollution de l’air
intérieur).[...] Alternatives : Un simple coup de balai ou d’aspirateur suffit généralement ; si besoin, nettoyez le sol à l’eau claire. S’il est
particulièrement sale, ajoutez dans le seau un peu de
savon noir. l’huile de lin ou le vinaigre blanc suffisent pratiquement à résoudre tous les problèmes.
Adjoignez-leur à la rigueur un produit
multi-usages réellement vert
(à base végétale ou
biodégradable à au moins 98 % en quelques jours)
et le tour
est
joué |
Données :
|
Acide gras |
Formule semi-développée |
Formule simplifiée |
|
Acide α-linolénique |
CH3
– CH2 – (CH =
CH – CH2)3
– (CH2)6 –
COOH |
C17H29 – COOH |
|
Acide linoléique |
CH3
–
(CH2)4
–
(CH= CH
–
CH2)2
–
(CH2)6
–
COOH |
C17H31 – COOH |
|
Acide oléique |
CH3
–
(CH2)7
–
CH=CH
–
(CH2)7
–
COOH |
C17H33 – COOH |
|
Acide stéarique |
CH3 – (CH2)16 – COOH |
C17H35 – COOH |
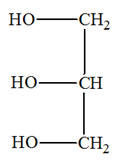
1. 1ière partie : l’huile de lin.
|
L’huile de lin est constituée en majeure partie d’un mélange de triglycérides issus des acides gras suivants : - L’acide a-linolénique (45 à 70 %) ; - L’acide linoléique (12 à 24 %) ; - L’acide oléique (10 à 21 %) ; - Quelques acides gras saturés comme l’acide stéarique. 1.1. L’acide stéarique est un acide gras saturé alors que l’acide a-linolénique, l’acide linoléique et l’acide oléique sont des acides gras insaturés. Quelle est la caractéristique commune de ces molécules justifiant le qualificatif "insaturé" ? - Caractéristique commune de ces molécules justifiant le qualificatif "insaturé" : - Ces molécules possèdent une ou plusieurs doubles liaisons carbone-carbone C = C.
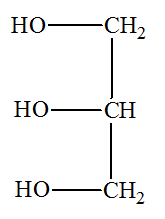
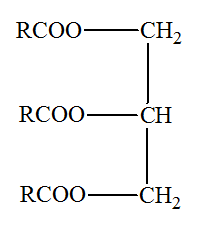
1.2. Les triglycérides présents dans la nature peuvent être
synthétisés par réaction
entre le
glycérol et des acides gras de formule générale
R – COOH.
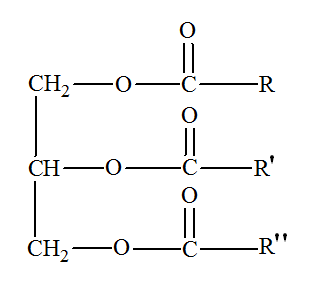
1.2.1. À quelle famille de composés organiques appartient le glycérol ? Justifier. - Le glycérol possède trois groupes hydroxyle – OH. - Ces groupes hydroxyle sont portés par des carbone tétragonaux. - Le glycérol est un triol, il fait partie de la famille des alcools. - Le glycérol est un trialcool : le propan-1, 2, 3 -triol. 1.2.2. À quelle famille de composés organiques appartient un triglycéride ? Justifier. - Les triglycérides ou corps gras sont des triesters des acides gras et du glycérol. - Un acide gras est un acide carboxylique à chaîne linéaire, saturée ou non, possédant en général un nombre pair d'atomes de carbone, entre 4 et 22 - Les triglycérides sont dits simples si R = R' = R''. Sinon les triglycérides sont mixtes. - Les triglycérides possèdent trois groupes ester :
|
2. 2ième partie : Fabrication du savon noir.
|
Le savon noir est un savon mou de couleur naturellement ambrée sombre, résultant de la saponification de l’huile de lin par la potasse (solution d’hydroxyde de potassium K+(aq) + HO –(aq) ). Dans cette partie, on considérera que l’huile de
lin est constituée uniquement du
triglycéride issu de l’acide α–linolénique, que l’on
appellera composé
T. Données : Masse molaire du composé
T :
MT
= 872 g.mol–1
Masse molaire
du savon : MS
= 316 g.mol–1
Formule du
triglycéride T :
2.1. Quelle est la formule brute du groupe R dans le triglycéride T ? - Formule brute du groupe R dans le triglycéride T : - On considère que l’huile de lin est
constituée uniquement du triglycéride issu de l’acide
α–linolénique. - Le linoléate de glycéryle est un triglycéride simple provenant de l'estérification de l'acide α–linolénique avec le glycérol. - Formule semi-développée du groupe R : CH3 – CH2 – (CH = CH – CH2)3 – (CH2)6 – - Formule brute du groupe R : C17H29 – 2.2. Compléter sur la feuille annexe à rendre avec la copie l’équation de la réaction correspondant à la saponification du composé T par la potasse. Encadrer le produit de la réaction correspondant au savon. |
|
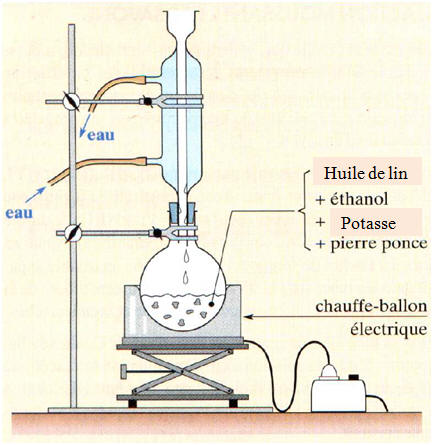
2.3. Au laboratoire, on réalise cette synthèse à partir de 20 g d’huile de lin et 20 mL de solution de potasse à 5,0 mol . L –1.
On porte ce mélange à
ébullition, additionné de 20 mL d’éthanol
et de quelques
grains de pierre ponce, pendant 30
minutes. 2.3.1. Quel dispositif expérimental utilisera-t-on pour réaliser cette synthèse ? Expliquer l’intérêt de ce dispositif. - Dispositif expérimental :
- On utilise le chauffage à reflux. - En chauffant, on augmente la température du mélange réactionnel, on accélère la réaction de saponification qui est une réaction lente à température ambiante. - Le chauffage à reflux permet de condenser les vapeurs des réactifs et des produits grâce au réfrigérant à bulles et de les faire retourner à l'état liquide dans le ballon. - Ainsi la réaction est plus rapide et se fait sans perte de matière. 2.3.2. Déterminer les quantités de matière initiales de réactifs. - Quantités de matière initiales de réactifs : - On réalise cette synthèse à partir
de 20 g d’huile de lin et 20 mL
de solution de
potasse à 5,0 mol . L –1. -
On considère que l’huile de lin est
constituée uniquement du triglycéride issu de l’acide
α–linolénique. - Quantité de matière du composé T de masse molaire MT = 872 g.mol –1 : - - Quantité de matière de potasse : - npotasse = C . V - npotasse ≈ 5,0 × 20 × 10 –3 - npotasse ≈ 0,10 mol 2.3.3. Compléter le tableau d’évolution du système fourni en annexe. Sachant que la transformation est totale, déterminer la quantité de matière de savon synthétisé. - Tableau
d’avancement et réactif limitant : - Hypothèse 1 : On
considère que T
est le réactif limitant : - Alors : -
nT
– xmax1
= 0
-
nT
= xmax1
≈ 2,3
×
10 – 2 mol - Hypothèse 2 : - On
considère que la potasse est le réactif limitant : - npotasse
– 3
xmax2
= 0 -
npotasse
= 3
xmax2
≈ 0,10 mol - xmax2
≈ 3,3
× 10– 2 mol - L’avancement
maximal xmax
est égal à la plus petite des deux valeurs : - xmax
= xmax1
≈ 2,3
× 10– 2 mol <
xmax2 - Le réactif limitant est le réactif T. |
|
|
T + |
3
(K+(aq) + HO–
(aq)) |
=
3
(K+(aq) + RCOO–
(aq)) |
+ |
|
x
= 0
mol |
nT
≈ 2,3 x 10– 2 |
npotasse
≈ 0,10 |
nsavon
= 0 |
0 |
|
x
mol |
nT
– x |
npotasse
– 3 x |
nsavon
= 3 x |
x |
|
xmax
mol |
2,3
×
10– 2 – xmax = 0
nT
≈ 0,0 |
0,10 –
3
×
2,3
× 10– 2 npotasse
≈ 9,3
×
10– 2 |
nsavon
= 3
×
2,3
× 10– 2 nsavon
≈ 6,9
×
10– 2 |
nglycerol
= xmax
nglycerol
≈ 2,3
×
10– 2 |
|
- Quantité de matière de savon synthétisé : - Du tableau, on tire : - nsavon
= 3
× 2,3
× 10 – 2 - nsavon
≈ 6,9
×
10 – 2 mol 2.3.4. Déterminer alors la masse de savon synthétisé. - Masse de savon synthétisé : - msavon
= nsavon
.
MS - msavon
≈ 6,9
× 10– 2 ×
316 - msavon ≈ 22 g |
3. 3ième partie : Action du savon.
|
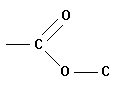
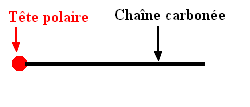
3.1. Les propriétés détergentes du savon, c’est-à-dire son aptitude à enlever les salissures, sont dues à la structure particulière de l’anion carboxylate RCOO–. Sa tête polaire constituée du groupe – COO– et la longue chaîne carbonée R ont des propriétés antagonistes. 3.1.1. Nommer les propriétés des deux parties de cet ion. - Propriétés des deux parties de cet ion : - Le groupe carboxylate est hydrophile (il s’entoure de molécules d’eau polaire), il est lipophobe car il n’a pas d’affinité pour les chaînes carbonées présentes dans les graisses - La chaîne carbonée R est hydrophobe car elle n’est pas polaire, mais elle est lipophile car elle a beaucoup d’affinité pour les chaînes carbonées. - Les ions carboxylates possèdent : - Une extrémité hydrophile – COO– tête hydrophile - Une extrémité lipophile R – queue hydrophobe - Ce sont des espèces amphiphiles. 3.1.2. En utilisant la représentation symbolique suivante, dessiner sur le schéma de la feuille annexe à rendre avec la copie quelques ions carboxylate du savon au niveau de l’interface entre
la
salissure graisseuse et l’eau. |
|
Schématisation de l’ion carboxylate . |
|
3.2. La formule du LAS (linear-alkylbenzène-sulfonate) est la suivante : (C18H29NaO3S) |
|
Montrer que l’anion associé au cation Na+ possède une action détergente, du fait de sa structure analogue à celle de l’anion carboxylate du savon. - L’anion associé au cation Na+ possède une partie hydrophile l’ion sulfonate – SO3– et une partie lipophile la chaîne carbonée. |
- Schéma :
Questions 2.1. et 2.2.3.
|
Avancement |
T
+ |
… (K+(aq)
+ HO– (aq)) |
= …(K+(aq)
+ RCOO– (aq)) + |
 |
|
x
= 0 |
|
|
|
|
|
x |
|
|
|
|
|
xmax |
|
|
|
|
Question 3.1.2.
|
|
|
|