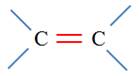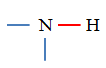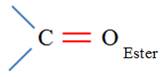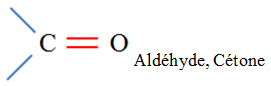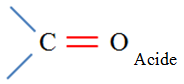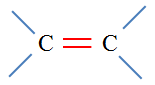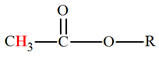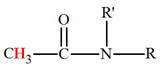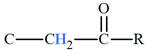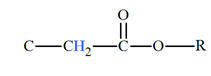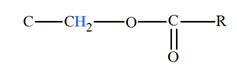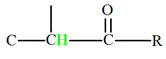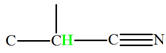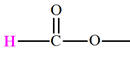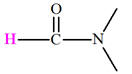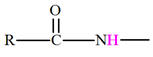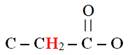|
Chap. N° 04 |
Analyses spectrales. Cours. |
|
|
Exercices : énoncé avec correction a)-
Exercice 8 page 104 : Utiliser un spectre pour déterminer une
couleur. b)- Exercice 10 page 104 : Reconnaître un groupe caractéristique. c)- Exercice 11 page 105 : Nommer des composés organiques. d)- Exercice 14 page 105 : écrire une formule topologique à partir d’un nom. e)- Exercice 16 page 105 : Reconnaître des bandes d’absorption. f)- Exercice 18 page 106 : Utiliser un spectre pour identifier une
fonction (tableau) g)- Exercice 21 page 106 : Attribuer des déplacements chimiques. h)- Exercice 23 page 107 : Relier la multiplicité du signal au nombre de
voisins. i)- Exercice 24 page 107 : Reconnaître des signaux par leur
multiplicité. j)- Exercice 29 page 108 : Spectres infrarouge et oxydation. k)- Exercice 31 page 108 : Spectre infrarouge d’acides carboxyliques. l)- Exercice 34 page 109 : à chacun son rythme. m)- Exercice 39 page 111 : analyse élémentaire et spectres. n)- Exercice 41 page 112 : identifier une molécule. |
I-
Nomenclature des composés organiques.
1)- Groupes caractéristiques et
fonctions.
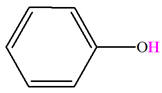
-
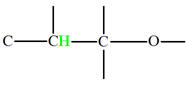
Les molécules organiques comportent deux parties :
-
Un squelette carboné,
-
Et des groupes caractéristiques.
-
Les molécules qui possèdent le même groupe
caractéristique ont des propriétés chimiques communes.
-
Ces propriétés chimiques communes définissent une
fonction chimique.
-
Tableau des différentes fonctions chimiques rencontrées
en première S.
|
Fonction |
Alcool |
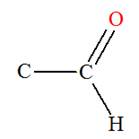
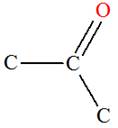
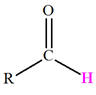
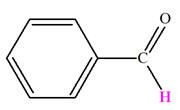
Aldéhydes |
Cétones |
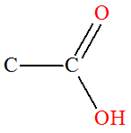
Acide
carboxylique |
|
Groupe caractéristique |
R
–
O
– H |
|
|
|
|
Nom |
Hydroxyde |
Carbonyle |
Carbonyle |
Carboxyle |
-
Tableau des différentes fonctions chimiques rencontrées
en Terminale S.
|
Fonction |
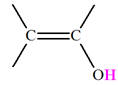
Alcène |
Ester |
Amine |
Amide |
|
Groupe caractéristique |
|
|
|
|
|
Nom |
Alcène |
Ester |
Amine |
Amide |
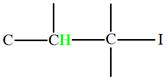
2)- Nomenclature des alcanes,
alcools, aldéhydes, cétones et acides carboxyliques.
-
Cours de première S :
-
Les alcanes :
1sch06.htm (Chim. N° 06 De
la structure aux propriétés. Cas des alcanes et des alcools.
Cours)
-
Les aldéhydes, cétones et acides carboxyliques :
1sch08.htm (Chim. N° 08
Composés organiques oxygénés)
3)- Nomenclature des alcènes :
a)-
Définition.
-
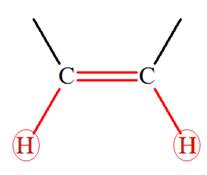
Les alcènes sont des hydrocarbures insaturés, non
cycliques, qui possèdent une double liaison carbone ‑ carbone
C = C.
-
Leur formule brute générale :
CnH2n.
-
Remarque : les atomes de carbone de la double liaison
sont trigonaux.
b)-
Nomenclature.
-
Le suffixe
-ène caractérise les alcènes.
-
On obtient le nom d'un alcène de la manière suivante :
-
On cherche la chaîne carbonée la plus longue contenant la
double liaison.
- On compte le nombre d'atomes de carbone de cette chaîne principale et on obtient le nom de l'alcène grâce au
- préfixe
grec indiquant le nombre d'atomes de carbone suivi du
suffixe -ène.
-
On numérote les atomes de carbone de la chaîne principale
de façon à avoir les plus petits indices pour les atomes de
carbone doublement liés.
-
La place de la double liaison est indiquée par son indice
de position placé avant le suffixe
- ène.
-
C'est la place de la double liaison qui impose le sens
de numérotation.
-
Comme pour les alcanes, on indique les groupes
substituants de la chaîne principale avec leur indice de
position.
c)-
L’isomérie
Z et
E ou stéréo-isomérie.
-
Autour d’une simple liaison carbone – carbone
C ─ C,
il y a libre rotation alors qu’il n’existe pas de libre rotation
autour d’une double liaison carbone ‑ carbone
C = C.
-
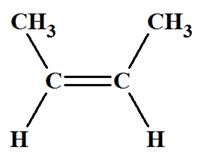
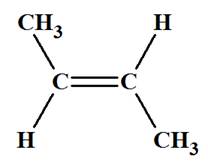
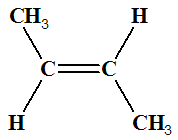
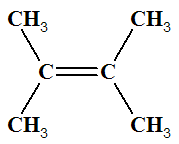
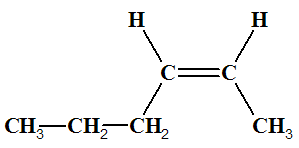
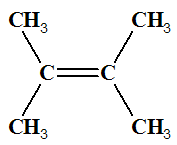
Exemple : Que peut-on dire des molécules suivantes ? Les
nommer.
|
Molécule
A But-2-ène |
Molécule B But-2-ène |
-
Les molécules
A et
B différent par la
position, par rapport à l’axe de la double liaison, des deux
atomes d’hydrogène.
-
Les deux molécules ne sont pas superposables.
-
Pour passer de la molécule
A à la molécule
B,
il faut rompre certaines liaisons et en reformer d’autres.
-
Il n’y a pas libre rotation autour d’une double liaison
carbone ‑ carbone
C = C.
-
Les molécules
A et
B sont des molécules
distinctes que l’on peut séparer.
-
La température d'ébullition normale du (Z)-but-2-ène est
de
-
Les molécules
A et
B sont des
stéréo-isomères.
-
On dit que le but-2-ène existe dans deux configurations :
|
La configuration Z (de l'allemand Zusammen : ensemble) où les deux atomes d’hydrogène sont situés du même côté de la double liaison, et la configuration
E (de
l'allemand
Entgegen :
opposé) où les deux atomes d’hydrogène sont situés de part et
d'autre de la double liaison. |
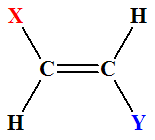
►
Définition :
|
Définition : Si, dans un alcène de formule générale CHX = CHY, les deux atomes d’hydrogène sont dans le même demi-plan par rapport à l’axe de la double liaison C = C, le
stéréo-isomère est Z, dans le cas contraire, il est
E.
|
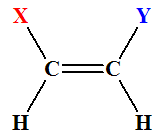
-
Cas du but-2-ène :
|
(Z)But-2-ène |
(E)But-2-ène |
d)-
Application 1.
|
|
|
|
H Pent-1-éne |
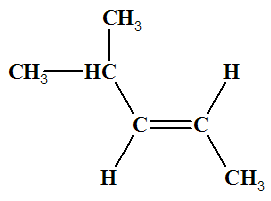
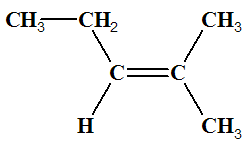
I (Z)-pent-2-éne |
|
|
|
|
J
(E)-pent-2-éne |
K 2,3-dimethylbut-2-éne |
-
Remarque : on peut construire les molécules avec le
logiciel Nomenclature, mais on ne peut pas développer la double
liaison (le logiciel a ses limites).
-
On peut utiliser le logiciel
gratuit ChemSketch.
e)-
Application 2.
-
Écrire la formule semi-développée des composés suivants,
puis faire la vérification.
|
L (Z)-hex-2-ène |
N (E)-4-méthylpent-2-ène |
|
|
|
|
M 2-méthylpent-2-ène |
O 2,3-diméthylbut-2-ène |
|
|
|
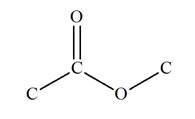
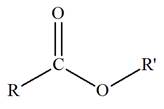
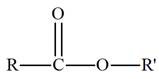
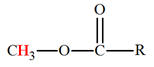
a)-
Groupe caractéristique :
-
Ils possèdent le groupe caractéristique suivant :
|
Groupe
caractéristique |
Formule développée |
Autre formulation |
|
|
|
|
-
Le groupement
R peut désigner une chaîne carbonée
ou un atome d’hydrogène.
-
Alors que
R’ désigne nécessairement une chaîne
carbonée.
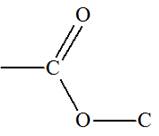
b)-
Nomenclature :
-
Le nom de l’ester comporte deux termes :
-
Le premier, qui se termine en
oate, désigne la chaîne
principale provenant de l’acide carboxylique.
-
Le second, qui se termine en
yle, est le nom du
groupe alkyle provenant de l’alcool.
-
Exemples :
|
|
|
|
Éthanoate
de méthyle |
Méthanoate de
propyle. |
-
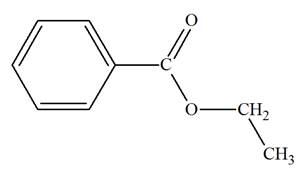
Application : soient les esters
CH3COOC2H5et
C6H5COOC2H5
:
-
Quels sont l'acide et l’alcool entrant dans la
préparation de chaque ester ?
-
Donner le nom de chaque constituant.
|
|
|
|
Éthanoate d'éthyle
|
Benzoate d'éthyle
|
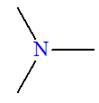
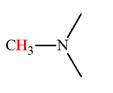
a)-
Définition.
|
Définition des amines : On appelle amine tout composé organique obtenu en remplaçant dans la molécule d’ammoniac NH3, un, deux ou trois atomes d’hydrogène
par un, deux ou trois groupes alkyles.
|
- Formule générale : R ─ NH2
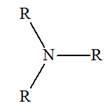
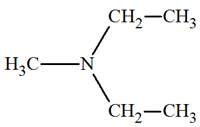
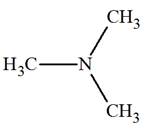
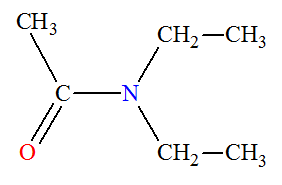
► Les amines secondaires et tertiaires symétriques.
-
Formule générale :
|
Amines secondaires symétriques. R ─ NH ─ R |
Amines tertiaires symétriques
|
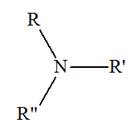
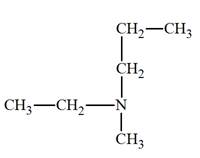
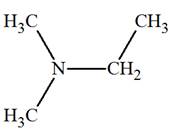
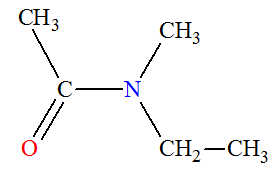
► Les amines secondaires et tertiaires non
symétriques.
-
Formule générale :
|
Amines secondaires non symétrique R ─ NH
─ R’ |
Amine tertiaire non symétrique
|
b)-
Nomenclature.
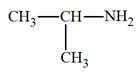
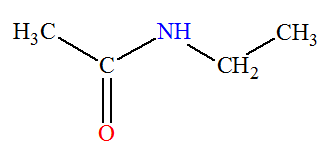
► Les amines primaires.
-
Formule générale :
R
─ NH2
- Nomenclature :
- On nomme l’amine à partir du nom de
l’alcane R
─ H
correspondant, avec élision du
e, que l’on fait
suivre de la terminaison amine en précisant la position
du groupe ─ NH2.
►
Les amines secondaires et tertiaires symétriques.
- Nomenclature :
- On fait suivre le nom de l’alkyle R
─, précédé de
di ou
tri, de la terminaison
amine.
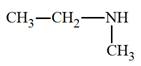
► Les amines secondaires et tertiaires non
symétriques.
-
On les nomme comme des dérivés de substitution sur
l’azote de l’amine R
─ NH2
où R
─
est le groupe le
plus long.
-
On écrit le ou les groupes substituants sur l’azote dans
l’ordre alphabétique, précédé(s) de la lettre
N et
suivis du nom de l’amine R
─ NH2.
c)-
Applications 1.
-
Reproduire et nommer les molécules suivantes, puis faire
la vérification.
|
|
|
|
|
|
V1 propan-2-amine |
W1 éthanamine |
X1
N-méthyléthanamine |
Y1 |
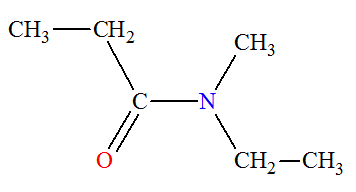
d)-
Application 2.
-
Écrire la formule semi-développée des composés suivants,
puis faire la vérification.
|
Z1 N-éthyl-N-méthyléthanamine |
B2 N,N-diméthylméthanamine triméthylamine |
|
|
|
|
A2
diméthyléthanamine |
C2
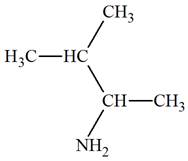
3-méthylbutan-2-amine |
|
|
|
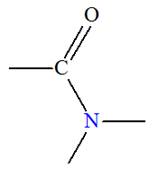
a)-
Groupe caractéristique :
-
Les amides dérivent des acides carboxyliques par
remplacement du groupement
– OH
par un groupe
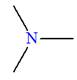 .
.
-
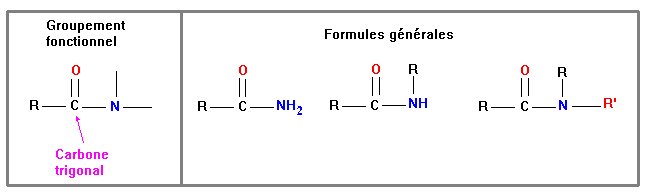
Le groupement fonctionnel et les différentes formules
générales :
b)-
Nomenclature.
-
Le nom découle de celui de l’acide correspondant en
remplaçant la terminaison
oïque
par la terminaison
amide.
-
Exemples :
-
Amides simples :
|
|
|
|
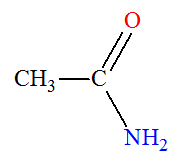
Éthanamide (Acétamide) |
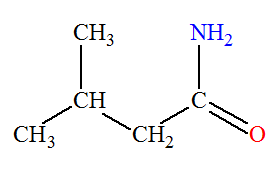
3-méthylbutanamide |
-
amides
substitués sur l’azote :
-
Lorsque l’atome d’azote est lié à des groupes alkyles, le
nom de l’amide est précédé de la mention N-alkyl.
-
On écrit le ou les groupes substituants sur l’azote dans
l’ordre alphabétique.
|
|
|
|
N-éthyléthanamide (N-éthylacétamide) |
N-N-diéthyléthanamide (N-N-diéthyacétamide) |
|
|
|
|
N-éthyl-N-méthyléthanamide |
N-éthyl-N-méthypropanamide |
-
La spectroscopie est l’étude des interactions entre la
lumière et la matière.
-
Lorsque la lumière traverse une solution, elle est en
partie absorbée et en partie transmise par diffusion et
réflexion.
a)-
Mesure de l’absorbance d’une solution par
spectrophotométrie.
-
On utilise le fait que toute solution colorée absorbe la
lumière visible (400 nm < λ0 < 800 nm).
-
Lorsqu’un faisceau de lumière monochromatique traverse un
milieu absorbant, l’intensité lumineuse
I du faisceau
transmis est inférieure à l’intensité lumineuse
I0
du faisceau incident.
-
Pour évaluer cette diminution, on utilise :
-
La transmittance
T :
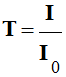
-
L’absorbance
A :
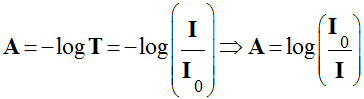
-
La transmittance s’exprime en pourcentage.
-
À une transmittance
T de 100 % (T = 1)
correspond une absorbance nulle :
A = 0.
-
à une
transmittance de 1 % (T = 0,01) correspond une absorbance
A =log 100 = 2.
-
Exemple de réaction :
-
On peut utiliser cette méthode lorsqu’une espèce colorée
se forme ou disparaît au cours de la réaction.
-
Réaction entre l’eau oxygénée et les ions iodure : il se
forme du diiode qui est une espèce chimique colorée.
Exemple : Suivi temporel d'une transformation par une méthode physique.
b)-
Principe de fonctionnement.

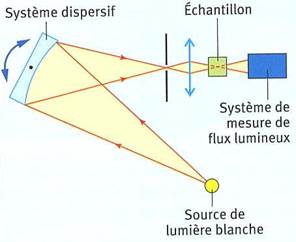
-
Un système dispersif (prisme ou réseau) permet de
sélectionner une radiation lumineuse de longueur d’onde
λ
donnée.
- Cette radiation est dirigée vers l’échantillon à analyser.
- Le flux lumineux transmis est mesuré et converti en
valeur d’absorbance A.
c)-
Les spectres UV-visible.
►
Les spectres A = f (λ)
-
Dans tous les spectres,
-
La longueur d’onde
λ des radiations est portée en
abscisse ;
-
L’absorbance
A, grandeur liée à la proportion de
lumière absorbée, est portée en ordonnée.
-
La région visible du spectre correspond à des longueurs
d’onde dans le vide ou dans l’air comprise entre 400 nm et 800
nm.
-
La région ultra-violette du spectre correspond à des
longueurs d’onde dans le vide ou dans l’air comprise entre 200
nm et 400 nm.
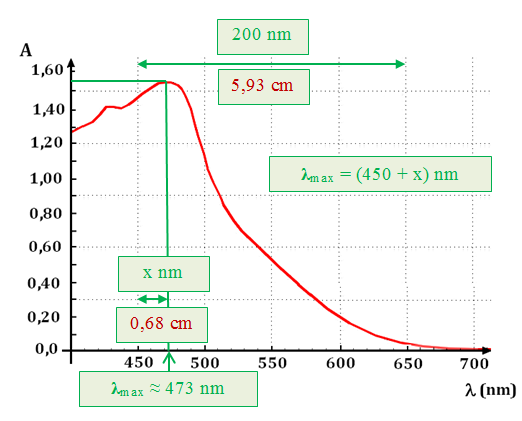
![]() Exemple de spectre : spectre d’une solution
aqueuse de diiode.
Exemple de spectre : spectre d’une solution
aqueuse de diiode.
-
On donne l’absorbance d’une solution de diiode en
fonction de la longueur d’onde dans le domaine 400 nm à 700 nm
- Pour une solution de diiode de concentration C = 1,0 mmol / L, on mesure l’absorbance A pour différentes longueurs d’ondes.
- La plage de variation de la longueur d’onde
se situe dans l’intervalle suivant :
-
400 nm <
λ < 700 nm.
- On règle la longueur d’onde sur la valeur souhaitée, on fait le blanc avec la solution étalon, puis on mesure l’absorbance.
- Il faut répéter le mode opératoire pour chaque
mesure.
-
Courbe obtenue :
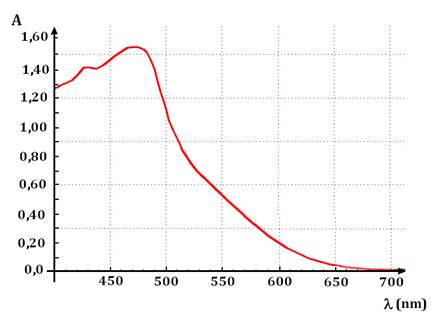
-
Une espèce chimique est caractérisée en spectroscopie par
la longueur d’onde de maximum d’absorption
λmax
et par la valeur du coefficient d’absorption molaire
ε (λ).
![]() Longueur
d’onde de maximum d’absorption
λmax :
Longueur
d’onde de maximum d’absorption
λmax :
-
On peut déterminer sa valeur dans le cas de la solution
de diiode étudiée.
-
λmax ≈ 473 nm
![]() Coefficient
d’absorption molaire ε (λ) :
Coefficient
d’absorption molaire ε (λ) :
-
ε (λ) est appelé coefficient d’extinction
molaire ou coefficient d’absorption molaire.
-
Il dépend de la nature de l’espèce dissoute et de la
longueur d’onde de la radiation utilisée.
-
Il dépend également du solvant et de la température.
-
Unité : (mol
– 1.L.cm
– 1).
-
Pour
λ = 450 nm,
e = 1,436
x 10 3
mol – 1.L.cm
– 1
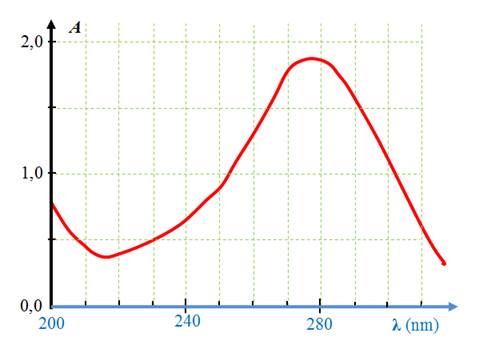
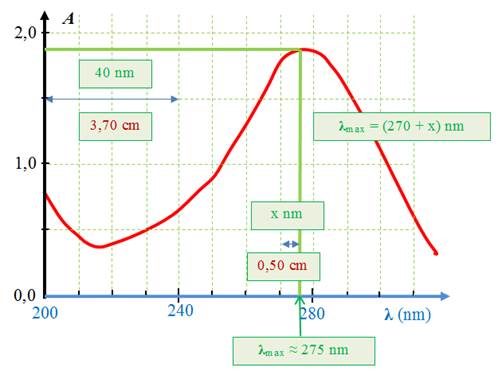
![]() Exemple de spectre : spectre de l’acétone.
Exemple de spectre : spectre de l’acétone.
-
On donne l’absorbance d’une solution de propanone
(acétone) en fonction de la longueur d’onde dans le domaine 200
nm à 300 nm
-
La solution absorbe principalement entre 260 nm et 290 nm
(région des UV).
![]() Longueur
d’onde de maximum d’absorption
λmax :
Longueur
d’onde de maximum d’absorption
λmax :
-
Une exploitation graphique permet de déterminer la valeur
de λmax.
-
λmax ≈ 275 nm
d)-
Loi de Beer-Lambert.
|
Enoncé : L’absorbance d’une solution diluée contenant une espèce colorée est proportionnelle à la concentration (effective) C de cette espèce et à l’épaisseur ℓ (cm) de la solution
traversée par le faisceau lumineux.
|
-
Les unités :
|
Grandeurs
physiques |
Unités |
|
Absorbance A |
Nombre sans
unité |
|
Coefficient d’absorption
molaire ε (λ) |
(mol – 1.L.cm
– 1) |
|
Épaisseur ℓ de la
solution traversée |
cm |
|
Concentration C de cette
espèce chimique |
mol . L–1 |
e)-
Couleur perçue et longueur d’onde
λmax.
- La solution aqueuse de diiode absorbe dans le visible.
- C’est une solution colorée.
- Comme λmax ≈ 473 nm, elle absorbe principalement dans le bleu-
- La solution est orange clair à
brune (cela dépend aussi de la concentration de la solution)
-
La solution aqueuse de propanone n’absorbe que dans
l’ultraviolet, λmax ≈ 275 nm
-
Éclairée en lumière blanche, la solution est incolore.
►
Couleurs et ordre de grandeur des longueurs
d’onde :
Deux couleurs
complémentaires sont diamétralement opposées.
Absorption et
couleur complémentaire
-
Une espèce incolore n’absorbe aucune radiation du spectre
visible.
-
Lorsqu’une espèce chimique n'absorbe que dans un seul
domaine de longueurs d’onde du visible, sa couleur est la couleur
complémentaire de celle des radiations absorbées.
-
La solution aqueuse de diiode qui absorbe dans le bleu
donne des solutions de couleur orange.

-
Les ions cuivre II en solution aqueuse,
Cu2+
(aq), qui absorbent dans le rouge-orangé (λmax ≈ 700
nm) donnent des solutions de couleur bleue.

-
Lorsqu’une espèce chimique absorbe plusieurs domaines de
longueurs d’onde, sa couleur résulte de la
synthèse additive
des couleurs complémentaires des radiations absorbées.
f)-
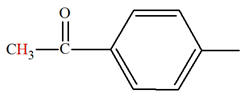
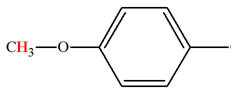
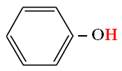
Lien entre couleur perçue et structure chimique.
-
Cas des molécules présentant des doubles liaisons
conjuguées. (Chim. N° 01 Pigments et colorants. Cours de
première S)
-
Deux doubles liaisons entre atomes sont conjuguées si
elles ne sont séparées que par une simple liaison.
-
Exemple : (3E)-penta-1,3-diene
-
Formule brute :
C5H18
-
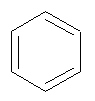
Tableau : Formules, longueurs d’onde des maxima
d’absorption et couleurs des dérivés du benzène.
|
Nom |
Formule |
Longueurs d’onde λmax |
Couleur |
|
Benzène |
|
254 nm |
Incolore |
|
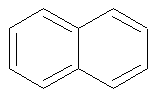
Naphtalène |
|
314 nm |
Incolore |
|
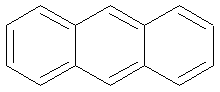
Anthracène |
|
380 nm |
Jaune |
|
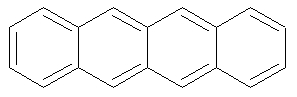
Naphtacène |
|
480 nm |
Orange |
|
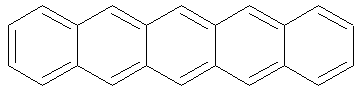
Pentacène |
|
580 nm |
Violet |
-
Remarque :
-
On constate que, plus le nombre de liaisons conjuguées
est élevé, plus λmax de quelques composés
dérivés du benzène est élevé.
![]() Plus
une molécule comporte de doubles liaisons conjuguées, plus les
radiations absorbées ont une grande longueur d’onde.
Plus
une molécule comporte de doubles liaisons conjuguées, plus les
radiations absorbées ont une grande longueur d’onde.
-
Une molécule organique possédant un système conjugué d’au
moins sept doubles liaisons forme le plus souvent un matériau
coloré, ceci en l’absence de groupe caractéristique,
-
La couleur perçue correspond à la couleur complémentaire
de la (ou des) radiation(s) absorbée(s).
-
De façon générale, la longueur d’onde de la lumière
absorbée augmente lorsque le nombre de doubles liaisons
conjuguées augmente.
-
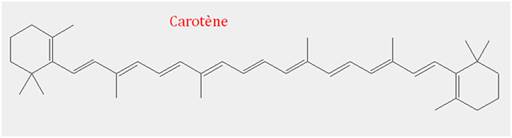
Exemple de molécule colorée : le
carotène (rouge-orangé)
-
Formule brute :
C40H56
-
Cette molécule est à l’origine d’une couleur
rouge-orangé.
-
Elle présente une suite ininterrompue de simples et de
doubles liaisons.
-
Le système conjugué comprend 11 doubles liaisons, la
molécule forme un matériau coloré.
-
Éclairé en lumière blanche, le carotène absorbe des
radiations bleues et vertes et apparaît rouge-orangé.
-
La couleur prise par les feuilles en automne est due à la
présence de carotène.
1)- Présentation d’un spectre.
-
La spectroscopie
IR est une spectroscopie
d’absorption.
-
Les composés organiques absorbent aussi dans le domaine
de l’infrarouge.
-
Pour ces spectres, on fait figurer :
-
La transmittance
T ou intensité lumineuse
transmise par l’échantillon analysé en ordonnée (elle s’exprime
en pourcentage)
-
Le nombre d’ondes
σ en abscisse.
-
Le nombre d’ondes
σ est l’inverse de la longueur
d’onde λ.
-
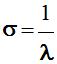
-
Unité :
-
Généralement, le nombre d’ondes
σ s’exprime en cm–1
en chimie organique.
-
En chimie organique, les radiations infrarouges
exploitées vont de 400 cm–1 à 4000 cm–1.
(25 μm à 250 μm)
-
Cette spectroscopie peut se faire en phase gazeuse ou en
phase condensée.
-
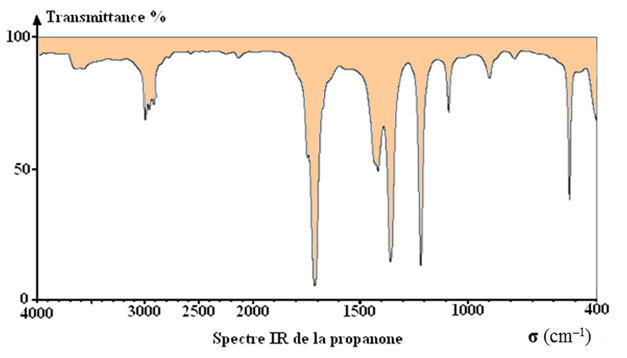
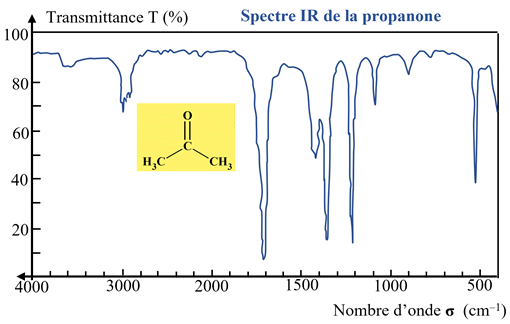
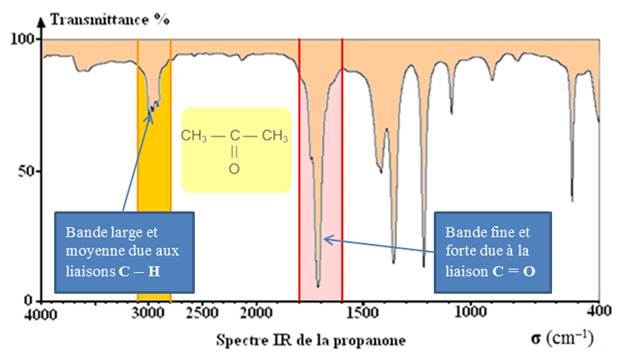
Exemple : spectre de la propanone.
-
Remarque :
-
Une faible valeur de transmittance correspond à une forte
absorption.
-
Les bandes d’absorption sont orientées vers le bas.
- L’axe des abscisses est orienté vers la gauche.
- Cette
échelle n’est pas toujours linéaire.
-
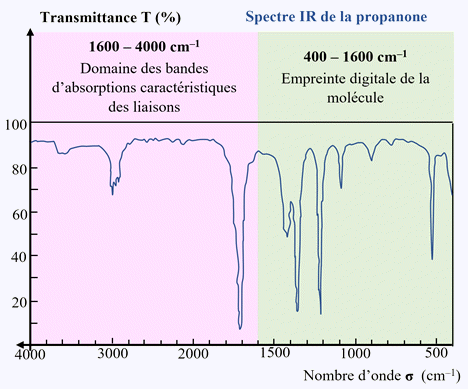
On distingue deux zones principales dans le spectre
IR :
►
Le nombre d’onde compris entre 1600 et 4000 cm–1.
-
Cette zone ne contient qu’un nombre limité de bandes,
correspondant à des types de liaisons particuliers.
-
Chaque bande est caractérisée par :
-
Sa position dans le spectre (la valeur du nombre d’onde
du minimum de transmittance,
-
Sa largeur (bande large ou fine),
-
Son intensité (faible, moyenne ou forte), correspondant à
la valeur minimale de la transmittance.
►
Le nombre d’onde compris entre 400 et 1600 cm–1.
-
Il s’agit d’une zone très riche en bandes d’absorption
pour les molécules organiques possédant un ou plusieurs atomes
de carbone.
-
Elle est généralement exploitée qu’en comparaison avec un
spectre de référence.
-
Cette zone s’appelle l’empreinte digitale de la molécule.
-
Les spectres
IR sont constitués d’une série de
bandes d’absorption.
-
Chaque bande d’absorption est associée à un type de
liaison, principalement caractérisé par les deux atomes liés et
la multiplicité de la liaison.
-
Un spectre infrarouge renseigne sur la nature des
liaisons présentes dans une molécule.
-
Les bandes d’absorption associées à chacune des liaisons
rencontrées en chimie organique correspondent à un domaine de
nombre d’ondes bien précis.
-
Une table des absorptions caractéristiques des liaisons
dans le domaine de l’IR donne les fourchettes des nombres
d’onde (souvent l’allure des bandes) pour différents types de
liaison.
-
Les spectres
IR sont liés au fait que les atomes
d’une molécule ne sont pas fixes, ils vibrent autour d’une
position d’équilibre.
-
Les vibrations peuvent correspondre à une élongation
longitudinale :
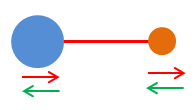
-
Les vibrations peuvent correspondre à une déformation
angulaire :
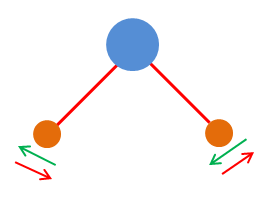
-
Les vibrations des liaisons d’une molécule sont à
l’origine de son spectre infrarouge.
-
Un spectre infrarouge renseigne sur la nature des
liaisons présentes dans une molécule et sur les groupes
caractéristiques qui sont présents dans la molécule.
4)- Bandes d’absorption
caractéristiques.
-
À chacune des liaisons rencontrées en chimie organique
correspond un domaine de nombre d’ondes
σ bien précis.
-
Pour chacune des liaisons rencontrées en chimie
organique, les nombres d’ondes correspondant au maximum
d’absorption sont donnés dans le tableau ci-dessous.
|
Liaison |
σ (cm–1) |
Intensité |
|
–
O
–
Hlibre |
3580 à 3650 |
Forte |
|
–
O
–
Hlié |
3200 à 3400 |
Forte |
|
|
3100 à 3500 |
Moyenne |
|
|
3000 à 3100 |
Moyenne |
|
|
3030 à 3080 |
Moyenne |
|
|
2800 à 3000 |
Forte |
|
|
2750 à 2900 |
Moyenne |
|
–
O
–
HAcide
carb |
2500 à 3200 |
Forte |
|
|
1700 à 1740 |
Forte |
|
|
1650 à 1730 |
Forte |
|
|
1680 à 1710 |
Forte |
|
|
1625 à 1685 |
Moyenne |
|
|
1450 à 1600 |
Moyenne |
|
|
1415 à 1470 |
Forte |
|
|
1050 à 1450 |
Forte |
|
|
1000 à 1250 |
Forte |
-
Les notations :
-
L’intensité traduit l’importance de l’absorption.
-
– O
– Hlibre sans
liaison hydrogène et
–
O – Hlié
avec
liaison hydrogène.
-
Ctri correspond à un carbone trigonal
engagé dans une double liaison.
-
Ctét correspond à un carbone tétragonal
engagé dans quatre liaisons simples.
-
Remarque :
►
Bandes C – H :
-
Le nombre d’ondes
σC–H est voisin de
3000 cm–1 et dépend de la nature du carbone.
-
Il est plus faible pour un atome de carbone tétragonal (Ctét)
que pour un atome de carbone trigonal (Ctri).
-
Ceci permet de repérer un groupe alcène de type
H – C
= C.
- Le spectre des alcanes présente aussi une absorption intense vers 1460 cm–1.
- Elle est liée à la
déformation angulaire des liaisons
C – H.
-
Les liaisons
C – H se retrouvant dans de très
nombreuses molécules organiques, des bandes d’absorption aux
alentours de 1460 cm–1 et 3000 cm–1 se
retrouvent dans la plupart des spectres infrarouges.
►
Bande C = C
-
La liaison
C = C des alcènes se repère par une
bande d’absorption intense vers 1640 cm–1.
-
Lorsque la liaison
C = C
est conjuguée à d’autres
doubles liaisons, la liaison C = C
est affaiblie et le
nombre d’onde correspondant diminue.
►
Bande C = O
-
La liaison
C = O est présente dans de nombreuses
molécules organiques telles que les aldéhydes, cétones, acide
carboxyliques, esters, amides,…
-
La position de la bande d’absorption dépend de la nature
de la fonction.
-
Elle est généralement comprise entre 1650 cm–1
et 1750 cm–1.
-
Lorsque la liaison
C = O
est conjuguée à d’autres
doubles liaisons, la liaison C = O
est affaiblie et le
nombre d’onde correspondant diminue.
►
Bande C – O
-
La liaison
C – O est présente dans les alcools,
les acides carboxyliques,…
-
Sa bande d’absorption se situe entre 1070 cm–1
et 1450 cm–1.
►
Bande N – H
-
La liaison
N – H est présente dans certaines
amines et certains amides.
-
Sa bande d’absorption se situe entre 3100 cm–1
et 3500 cm–1.
-
Le spectre infrarouge permet de différencier les amines
primaires de type R – NH2 des amines
secondaires de type R – NH – R’.
- La présence de deux atomes d’hydrogène dans la molécule R – NH2 conduit à une bande d’absorption qui se dédouble dans sa partie terminale,
- ce qui n’est pas le cas
pour la molécule R – NH – R’.
- La spectroscopie IR permet d’identifier la présence de certains types de liaison au sein d’une molécule et, la plupart du temps,
- d’en déduire la nature des groupes
caractéristiques de cette molécule.
-
Exemple : cas de la propanone :
5)- Cas de la liaison
O – H ;
liaison hydrogène.
-
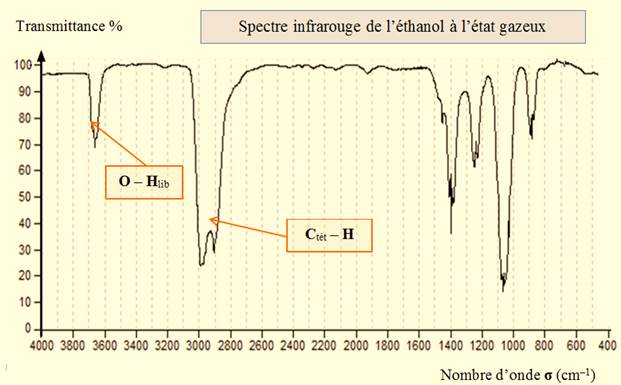
Spectre de l’éthanol à l’état gazeux :
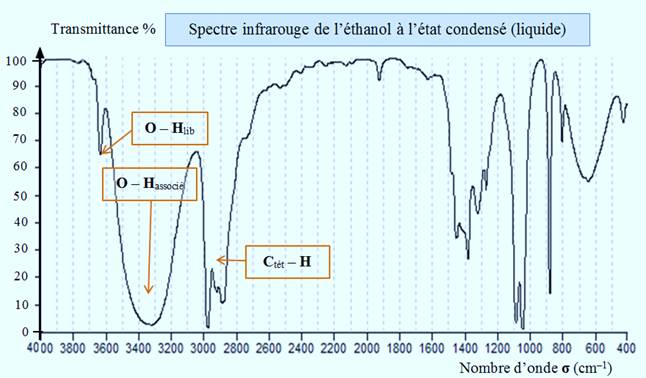
-
Spectre de l’éthanol à l’état liquide :
-
Ci-dessus, on peut observer les spectres infrarouges de
l’éthanol à l’état gazeux et à l’état liquide.
►
À l’état gazeux :
-
La liaison
O – H donne une bande moyenne et fine
vers 3620 cm–1.
-
Il n’existe pas de liaison hydrogène entre les molécules
d’éthanol, la liaison O – H est dite libre, que l’on note
O – Hlib.
►
À l’état liquide :
-
La liaison
O – H se manifeste par une bande
d’absorption forte et large de 3200 cm–1à 3400 cm–1.
-
Les liaisons hydrogène établies entre les molécules
d’éthanol affaiblissent les liaisons covalentes
O – H et
conduisent à un abaissement du nombre d’onde
σO – H.
-
De plus, la bande s’élargit, la liaison
O – H est
dans ce cas dite associée, on la note
O – Hassocié.
-
Ce résultat est général.
|
par liaison hydrogène provoque la diminution de la valeur du nombre d’onde σO – H et
l’élargissement de la bande d’absorption. |
-
La spectroscopie par
Résonance
Magnétique
Nucléaire ou
RMN est basée sur l’énergie que possèdent
certains noyaux lorsqu’ils sont soumis à un champ magnétique et
à un rayonnement électromagnétique.
-
On limitera l’étude à la
RMN du noyau de l’atome
d’hydrogène 1H ou
RMN du proton.
-
En
RMN, on emploie le terme proton pour désigner
le noyau de l’atome d’hydrogène 1H d’une
molécule.
-
Analogie :
-
Le noyau de l’atome d’hydrogène
1H a un
comportement magnétique analogue à celui d’une aiguille
aimantée.
-
En l’absence de tout champ magnétique, une aiguille
aimantée s’oriente de façon quelconque.
-
En présence d’un champ magnétique, elle s’oriente dans la
même direction et le même sens que ce champ magnétique.
-
Pour modifier l’orientation de l’aiguille aimantée, il
faut lui apporter de l’énergie.
-
Le phénomène est similaire avec les noyaux
1H
d’une molécule.
-
Leur propriété magnétique, analogue à celle d’une
aiguille aimantée, fait que les noyaux
1H
d’une molécule vont s’orienter dans la même direction et le même
sens que le champ magnétique d’un spectromètre.
-
Pour modifier cette orientation, il faut apporter au
noyau 1H un quantum d’énergie grâce à une onde
électromagnétique de fréquence particulière, appelée fréquence
de résonance.
-
Ce phénomène s’appelle résonance magnétique nucléaire (RMN).
-
Dans un spectromètre
RMN, l’échantillon contenant
l’espèce étudiée est soumis à un champ magnétique intense et est
traversé par des ondes électromagnétiques.
-
L’appareil mesure les fréquences de résonance des
différents noyaux contenus dans l’espèce étudiée.
-
Il les convertit en une grandeur appelée déplacement
chimique, qui ne dépend pas du champ magnétique de l’appareil de
mesure, contrairement à la fréquence de résonance.
-
Plus le champ magnétique du spectromètre utilisé est
grand, plus le spectre obtenu est précis.
-
Un point important :
-
La fréquence de résonance du noyau d’un atome d’hydrogène
dépend de leur environnement électronique, c’est-à-dire des
autres atomes de la molécule étudiée.
2)- Première lecture d’un spectre
RMN :
a)-
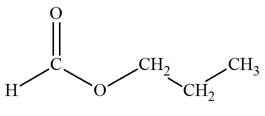
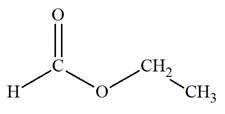
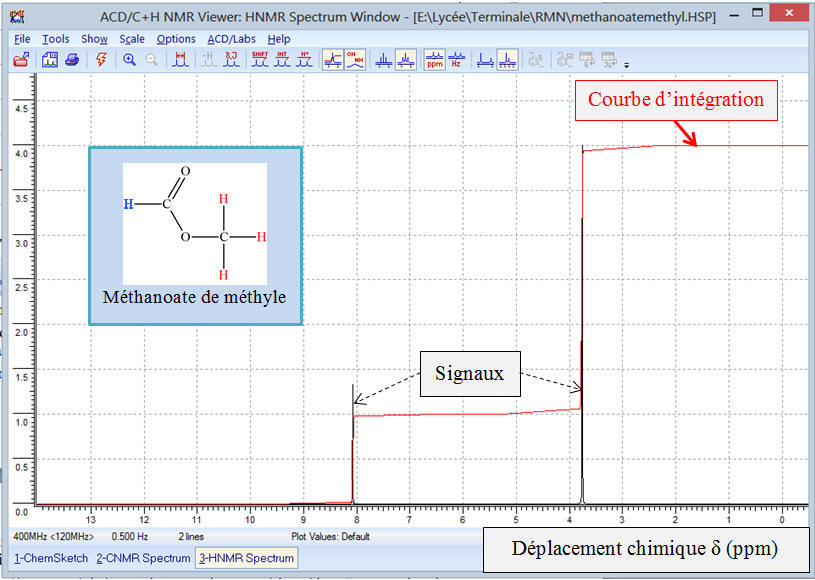
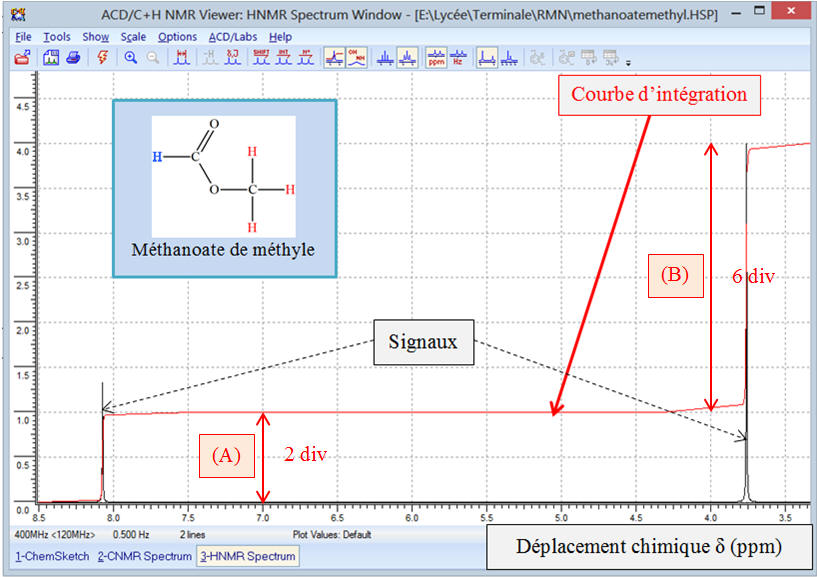
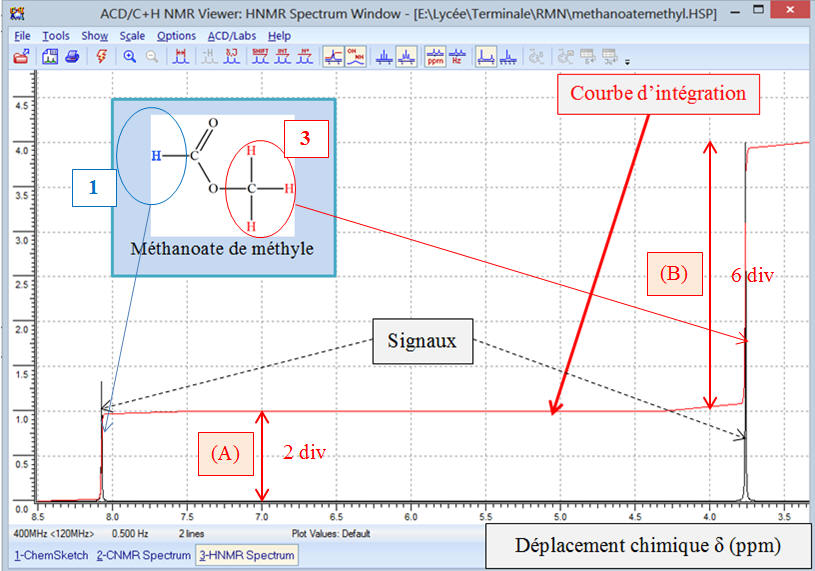
Exemple 1: Spectre de
RMN du proton et formule
développée du méthanoate de méthyle.
-
Spectre
RMN réalisé avec Chemsketch
(ACD/Labs).
Zoom
►
Observations :
-
Abscisse et ordonnée :
-
L’abscisse d’un spectre de
RMN représente une
grandeur liée à la fréquence de résonance des noyaux
d’hydrogène, appelée déplacement chimique, noté
δ.
-
Le
déplacement chimique
δ est exprimé en
ppm (parties par million).
-
L’axe des abscisses est orienté de droite à gauche (de 0
à 14 ppm)
-
La grandeur de l’axe des ordonnées n’est usuellement pas
indiquée, car elle n’apporte pas d’information particulière.
-
Le spectromètre permet de tracer deux courbes qui
utilisent le même axe des abscisses :
-
Une courbe est formée des signaux de résonance des noyaux
d’hydrogène de la molécule,
-
L’autre courbe, appelée
courbe d’intégration
est formée de paliers.
►
Étude du spectre
RMN du méthanoate
de méthyle :
-
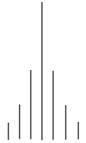
Ce spectre comprend deux signaux et chaque signal est
constitué d’un pic.
-
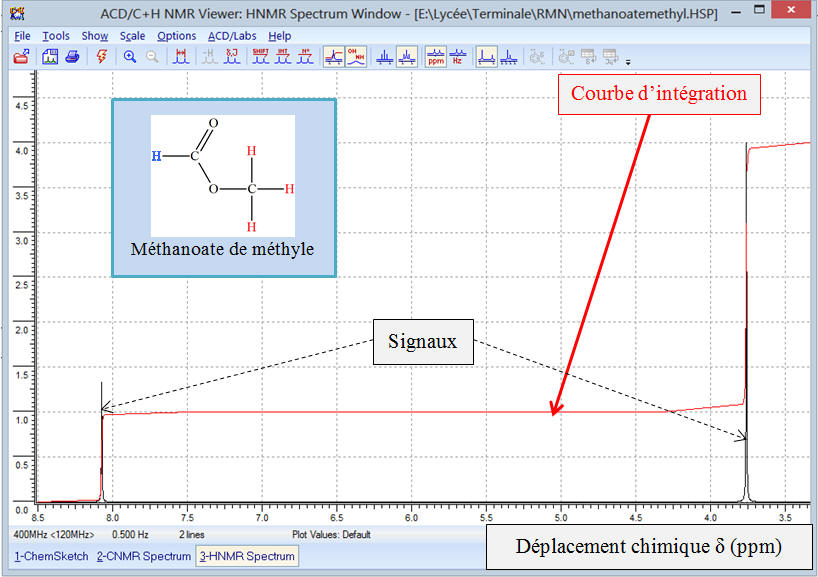
Si on analyse la courbe d’intégration, on remarque que
l’on observe deux paliers.
-
Si on mesure la hauteur du saut de chaque palier,
-
Le saut du palier (B) est le triple du saut du
palier (A).
►
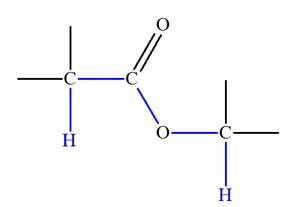
Analyse de la molécule de méthanoate de méthyle :
-
Formule développée :
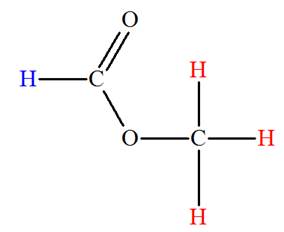
-
La molécule possède un atome d’hydrogène
H lié à l’atome de
carbone fonctionnel et les trois atomes d’hydrogène du
groupement méthyl.
-
Les trois noyaux des atomes d’hydrogène du groupement
méthyl possèdent le même environnement chimique.
-
Ces noyaux des atomes d’hydrogène sont appelés protons
équivalents.
-
La molécule possède donc deux groupes de protons
équivalents et le spectre RMN comprend deux signaux
constitués chacun d’un seul pic.
-
Chaque groupe de protons équivalents donne un signal sur
le spectre RMN.
-
L’étude de la courbe d’intégration montre que le rapport
des hauteurs des sauts de palier et le rapport du nombre de
noyaux responsable de chaque signal est le même.
-
La hauteur d’un saut de palier est proportionnelle au
nombre de noyaux responsable du signal produit.
-
Ces résultats sont généraux.
-
On peut associer à chaque signal un groupe de noyaux
d’atomes d’hydrogène de la molécule :
b)-
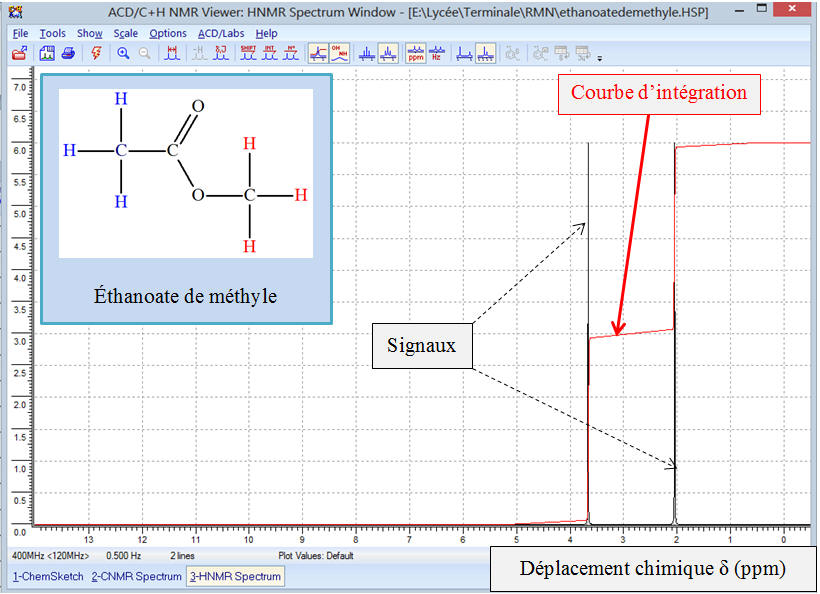
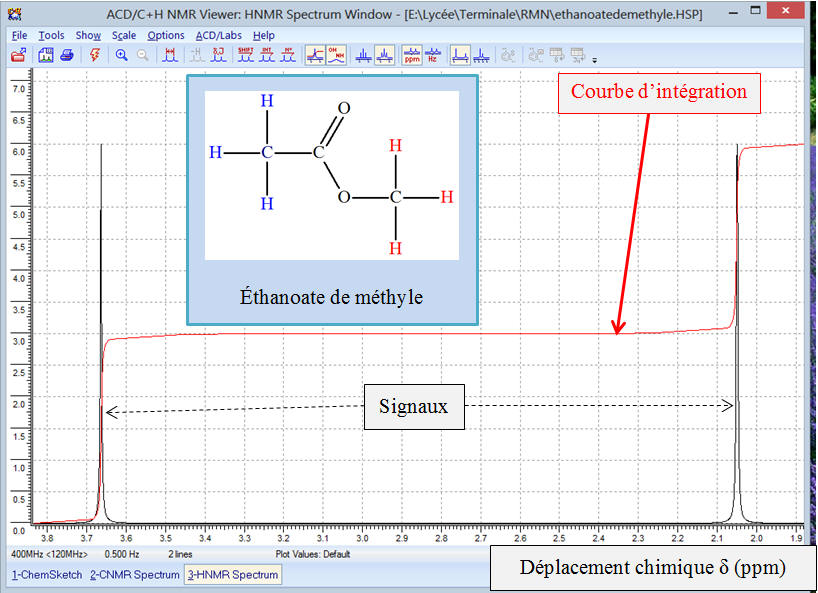
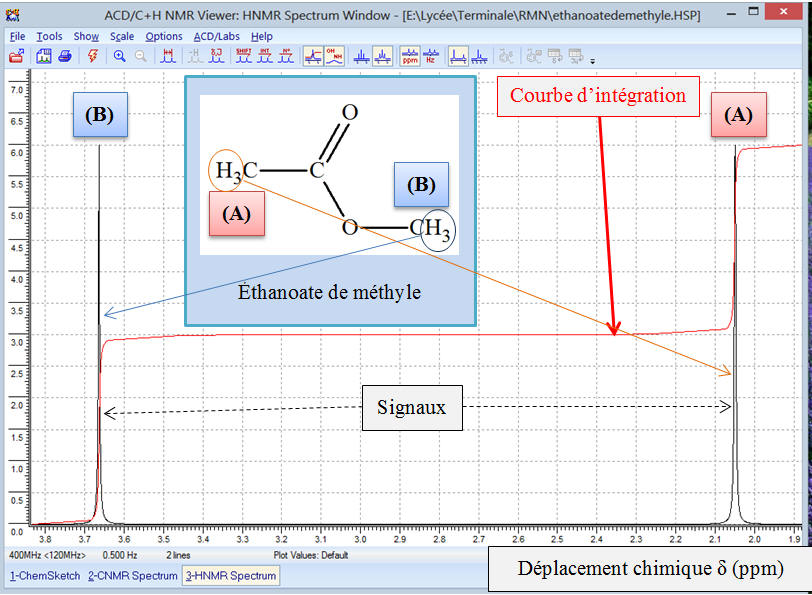
Exemple 2 : Spectre
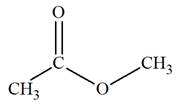
RMN de l’éthanoate de méthyle
![]() Comment
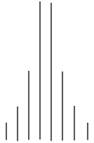
se présente ce spectre ? Peut-on donner son allure ?
Comment
se présente ce spectre ? Peut-on donner son allure ?
-
Étudions la formule développée de la molécule :
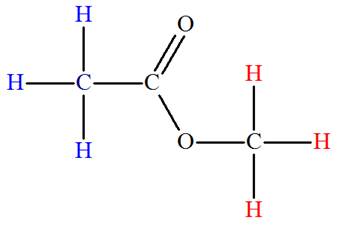
-
La molécule possède deux groupes de noyaux d’atomes
d’hydrogène équivalents.
-
Chaque groupe possède le même nombre de protons
équivalents.
-
Sur le spectre, on doit observer deux signaux et des
sauts de palier de même hauteur pour la courbe d’intégration.
-
Allure du spectre donné par ACD/Labs :
Zoom
-
Attribution à chaque signal d’un groupe d’atomes
d’hydrogène de la molécule :
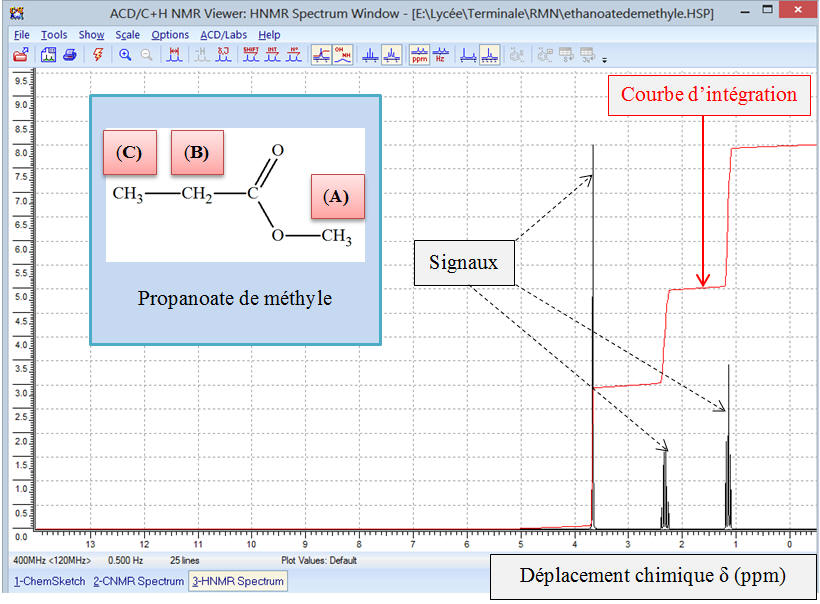
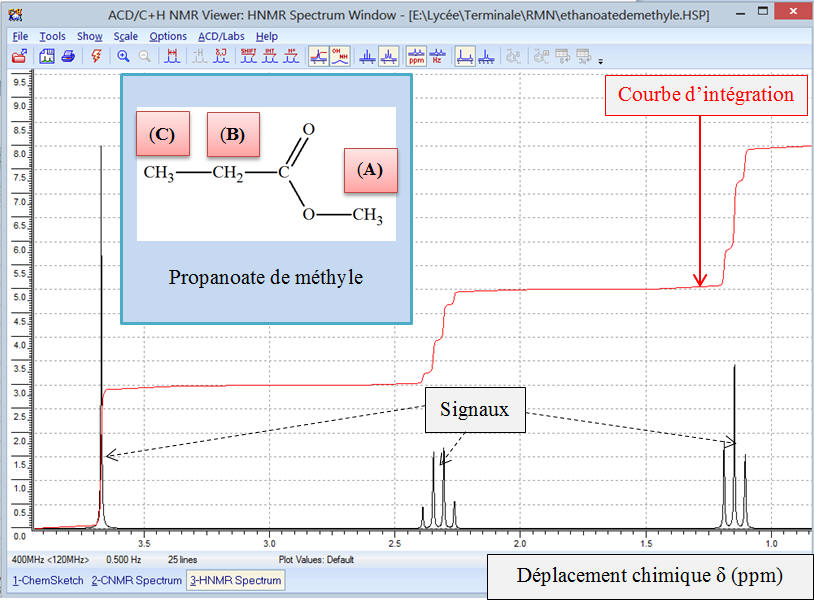
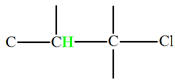
c)-
Exemple 2 : Spectre
RMN du propanoate de méthyle.
-
Formule semi-développée de la molécule de propanoate de
méthyle.
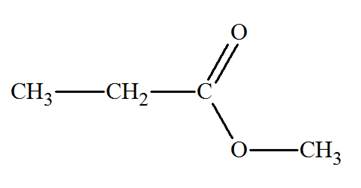
-
Cette molécule présente trois groupes de noyaux d’atomes
d’hydrogène équivalents.
-
On note ces groupes (A), (B) et (C).
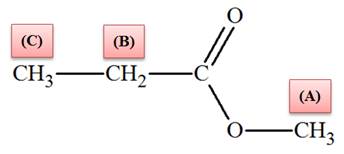
-
Données du spectre
RMN :
|
Groupe |
Déplacement chimique δ (ppm) |
|
(A) |
3,674 |
|
(B) |
2,324 |
|
(C) |
1,148 |
►
Étude du spectre
RMN du propanoate
de méthyle :
Zoom
-
Ce spectre comprend trois signaux comme on pouvait le
prévoir car il y a trois groupes de protons équivalents
-
Le signal de déplacement chimique
δ(A) =
3,674 ppm est constitué d’un seul pic.
-
Le signal de déplacement chimique
δ(B) =
2,324 ppm est formé de quatre pics, un tel signal est appelé
quadruplet.
-
Le signal de déplacement chimique
δ(C) =
1,148 ppm est formé de trois pics, un tel signal est appelé
triplet.
-
Si on analyse la courbe d’intégration, on remarque que
l’on observe trois paliers.
-
On remarque que le saut du palier (A) et le saut
du palier(C) ont la même hauteur :
-
h (A) = h (C) = 6 div
-
Le saut du palier (B) a une hauteur
h (B)
= 4 div
![]() Comment
peut-on interpréter ces résultats ?
Comment
peut-on interpréter ces résultats ?
►
Analyse de la molécule de propanoate de méthyle :
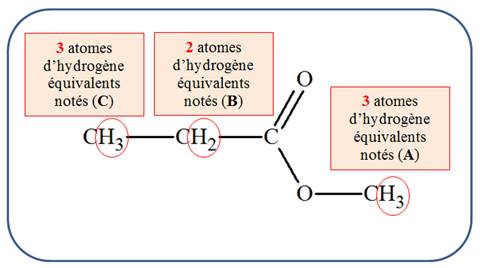
-
La structure d’un signal donne des informations sur
l’environnement des noyaux des atomes d’hydrogène responsables
de ce signal, c’est-à-dire de la structure de la molécule.
![]() Règle :
Protons voisins :
Règle :
Protons voisins :
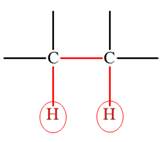
![]() Deux
protons séparés par trois liaisons (simples ou multiples) sont
dits voisins.
Deux
protons séparés par trois liaisons (simples ou multiples) sont
dits voisins.
|
3 liaisons |
3 liaisons |
5 liaisons |
|
Protons voisins entourés en
rouge |
Protons voisins entourés en
rouge |
Protons non voisins en bleu |
-
Le signal de déplacement chimique
δ(A) =
3,674 ppm est constitué d’un seul pic.
-
C’est le groupe (A) qui est responsable de ce
signal, il comprend 3 protons équivalents.
-
Les protons équivalents de ce groupe ne possèdent pas de
protons voisins.
-
Le signal ne comprend qu’un seul pic.
-
Le signal de déplacement chimique
δ(B) =
2,324 ppm est constitué de quatre pics.
-
C’est le groupe (B) qui est responsable de ce
signal, il comprend deux protons équivalents.
-
Les protons équivalents de ce groupe possèdent trois
protons voisins.
-
Le signal comprend
quatre pics.
-
Le signal de déplacement chimique
δ(C) =
1,148 ppm est constitué de trois pics.
-
C’est le groupe (C) qui est responsable de ce
signal, il comprend trois protons équivalents.
-
Les protons équivalents de ce groupe possèdent
deux
protons voisins.
-
Le signal comprend
trois pics.
-
Récapitulatif :
|
Atomes
d’hydrogène |
Groupe (A) |
Groupe (B) |
Groupe (C) |
|
Déplacement
chimique |
3,674 ppm |
2,324 ppm |
1,148 ppm |
|
Nombre de pics
du signal |
1 |
4 |
3 |
|
Nombre de
protons Équivalents
voisins |
0 |
3 |
2 |
-
Remarque : on peut tirer une remarque que l’on peut
généraliser
-
Si un groupe de noyaux d’atomes d’hydrogène équivalents
possède n noyaux d’atomes d’hydrogène voisins, alors le
signal correspondant à ce groupe de noyaux d’atomes d’hydrogène
équivalents comprend (n +1) pics
![]() La
multiplicité d’un signal sur un spectre
RMN est
liée à l’environnement des noyaux des atomes d’hydrogène
responsables de ce signal.
La
multiplicité d’un signal sur un spectre
RMN est
liée à l’environnement des noyaux des atomes d’hydrogène
responsables de ce signal.
3)- Conclusion : règles générales.
a)-
Le déplacement chimique
δ :
-
Dans un spectre
RMN, chaque signal, quasi
symétrique, est caractérisé par sa position sur un axe orienté
de droite à gauche, ou déplacement chimique
δ, exprimé en
ppm (parties par million).
-
La valeur est mesurée par rapport à un signal référence :
-
Le déplacement chimique est défini par la relation
suivante :
- 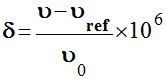
-
La grandeur
υ est la fréquence de résonance du
proton dans la molécule étudiée.
-
La grandeur
υ0 est la fréquence de
résonance du proton isolé.
-
La grandeur
υref est la fréquence de
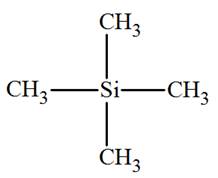
résonance du proton dans la molécule de référence (le
tétraméthylsilane, TMS, de formule
Si(CH3)4)
-
106 est un facteur multiplicatif permettant de
faire apparaître sur l’axe des abscisses des valeurs sans
puissance de 10.
-
Tétraméthylsilane (TMS) :
-
L’origine de l’axe des abscisses est le signal du
TMS.
-
δ (TMS) = 0 ppm
-
Les valeurs de déplacement chimique
δ sont
comprises entre 0 et 14 ppm.
►
Tableau de déplacement chimique δ (ppm) de
quelques protons :
|
Groupe méthyle
CH3 – |
|
|
Proton |
δ (ppm) |
|
CH3
– C |
0,9 |
|
CH3
– C – O |
1,4 |
|
CH3
– C = C |
1,6 |
|
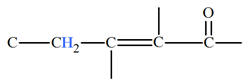
|
2,3 |
|
|
2,2 |
|
|
2,6 |
|
|
2,0 |
|
|
2,4 |
|
|
2,0 |
|
CH3
– O – R |
3,3 |
|
CH3
– OH |
3,4 |
|
|
3,8 |
|
|
3,7 |
|
|
2,3 |
|
|
2,0 |
|
CH3
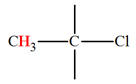
– Cl |
3,0 |
|
|
1,5 |
|
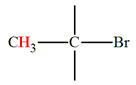
CH3
– Br |
2,7 |
|
|
1,7 |
|
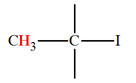
CH3
– I |
2,2 |
|
|
1,9 |
|
|
2,0 |
|
Groupe méthylène
–
CH2
– |
|
|
Proton |
δ (ppm) |
|
C – CH2
– C |
1,3 |
|
C – CH2
– Ccycle |
1,5 |
|
C – CH2
– C – O |
1,9 |
|
C – CH2
– C = C |
2,3 |
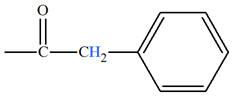
|
|
2,7 |
|
|
2,4 |
|
|
2,2 |
|
C – CH2
– O – R |
3,4 |
|
C – CH2
– O – H |
3,6 |
|
|
4,3 |
|
|
4,1 |
|
C – CH2
– N |
2,5 |
|
|
2,4 |
|
C – CH2
– Cl |
3,4 |
|
C – CH2
– C – Cl |
1,7 |
|
C – CH2
– Br |
3,3 |
|
C – CH2
– C – Br |
1,7 |
|
C – CH2
– I |
3,1 |
|
C – CH2
– C – I |
1,8 |
|
|
2,3 |
|
C – CH2
– C – C = C
|
1,5 |
|
|
3,8 |
|
Proton |
δ (ppm) |
|
|
1,5 |
|
|
2,0 |
|
|
3,0 |
|
|
2,7 |
|
|
3,7 |
|
|
3,9 |
|
|
4,8 |
|
|
2,8 |
|
|
4,0 |
|
|
1,6 |
|
|
3,6 |
|
|
1,7 |
|
|
4,2 |
|
|
1,9 |
|
|
2,7 |
|
Autres groupes |
|
|
Proton |
δ (ppm) |
|
|
5,3 |
|
|
5,1 |
|
C6H6 |
7,2 |
|
|
7,0 – 9,0 |
|
|
3,1 |
|
|
9,9 |
|
|
9,9 |
|
|
8,0 |
|
|
8,0 |
|
|
8,5 - 13 |
|
|
11 - 17 |
|
R – OH |
0,5 – 5,5 |
|
|
4,5 – 7,1 |
|
|
0,6 - 5 |
|
|
5 – 8,5 |
|
Proton |
δ (ppm) |
|
CH3
– C |
0,9 |
|
CH3
– C – O |
1,4 |
|
CH3
– C – O – CO |
1,3 |
|
CnH2n+1
– CO –H |
9,9 |
|
|
3,0 |
|
|
7,9 |
|
– CO – OH |
8,5 – 13 |
|
CnH2n+1
– OH |
0,5 – 5,5 |
|
|
4,2 – 7,1 |
|
C – CH2
– O – H |
3,6 |
|
C – CH2
– O – CO |
4,1 |
|
|
2,2 |
|
|
2,7 |
|
C – CH2
– C |
1,3 |
|
C – CH2
– Ccycle |
1,5 |
b)-
Protons équivalents :
-
Dans une molécule, les noyaux des atomes d’hydrogène sont
équivalents s’ils ont le même environnement chimique.
-
Des protons équivalents (par abus de langage, on parle
aussi d’atomes d’hydrogène équivalents) ont le même déplacement
chimique δ.
-
Deux protons sont magnétiquement équivalents s’ils ont la
même fréquence de résonance υ.
-
Ils sont représentés par le même signal sur le spectre.
-
Le nombre de signaux dans un spectre
RMN est égal
au nombre de groupes de protons équivalents présents dans la
molécule étudiée.
-
Lorsqu’une molécule présente une symétrie, des protons
portés par des atomes de carbone différents peuvent être
équivalents.
-
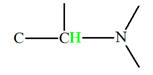
Exemple : la molécule de propanone
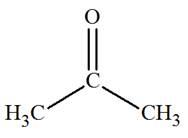
c)-
Multiplicité d’un signal, protons voisins et couplage :
- Un signal de résonance n’est pas toujours un pic fin et unique.
- Il peut comporter plusieurs pics et est alors appelé
multiplet.
-
Dans une molécule, les protons portés par un atome de
carbone interagissent avec les protons portés par les atomes de
carbone voisins, on dit qu’il y a couplage entre protons.
-
Des protons équivalents appartenant à un même groupe (à
un même atome de carbone) ne se couplent pas.
-
Dans les cas simples, on peut utiliser la règle des (n+1)-uplets :
-
Un groupe de protons équivalents (A), ayant pour
voisins n protons non équivalents à (A), présente
un signal de résonance sous forme d’un multiplet de (n+1)
pics.
|
Nombre de
protons équivalents
voisins |
Multiplicité |
Nom du signal et symbole |
Représentation du signal |
|
0 |
1 |
0 + 1 singulet (s) |
|
|
1 |
2 |
1 + 1 doublet (d) |
|
|
2 |
3 |
2 + 1 triplet (t) |
|
|
3 |
4 |
3 + 1 quadruplet (q) |
|
|
4 |
5 |
4 + 1 quintuplet
(quin) |
|
|
5 |
6 |
5 + 1 sextuplet (sex) |
|
|
6 |
7 |
6 + 1 septuplet (sep)
|
|
|
7 |
8 |
7 + 1 octuplet (oct) |
|
d)-
Courbe d’intégration :
-
La courbe d’intégration est constituée de paliers
successifs.
-
La hauteur de chaque saut de la courbe d’intégration est
proportionnelle au nombre de protons équivalents responsables du
signal correspondant.
4)- Méthode d’analyse d’un spectre
RMN.
-
Première étape : on compte le nombre de signaux du
spectre. Ceci permet de déterminer le nombre de groupes de
protons équivalents.
-
Deuxième étape : on utilise la courbe
d’intégration. Ainsi, on peut déterminer la proportion de
protons équivalents associés à chaque signal.
-
Troisième étape : on analyse la multiplicité de
chaque signal. On peut ainsi déterminer le nombre de protons
équivalents voisins des protons responsables du signal.
-
Quatrième étape : on utilise une table de valeurs
de déplacement chimique pour vérifier ou confirmer la formule de
la molécule.
5)-
Simulation de spectre RMN
avec le logiciel HNMR Spectrum.
2)- Exercices :
a)-
Exercice 8 page 104 : Utiliser un spectre pour déterminer
une couleur.
b)-
Exercice 10 page 104 : Reconnaître un groupe
caractéristique.
c)-
Exercice 11 page 105 : Nommer des composés organiques.
d)-
Exercice 14 page 105 : écrire une formule topologique à
partir d’un nom.
e)-
Exercice 16 page 105 : Reconnaître des bandes
d’absorption.
f)-
Exercice 18 page 106 : Utiliser un spectre pour
identifier une fonction (tableau)
g)-
Exercice 21 page 106 : Attribuer des déplacements
chimiques.
h)-
Exercice 23 page 107 : Relier la multiplicité du signal
au nombre de voisins.
i)-
Exercice 24 page 107 : Reconnaître des signaux par leur
multiplicité.
j)-
Exercice 29 page 108 : Spectres infrarouge et oxydation.
k)-
Exercice 31 page 108 : Spectre infrarouge d’acides
carboxyliques.
l)-
Exercice 34 page 109 : à chacun son rythme.
m)-Exercice 39 page 111 : analyse élémentaire et spectres.
n)-
Exercice 41 page 112 : identifier une molécule.
|
|