L’éthanoate de linalyle est une espèce chimique dont l’odeur rappelle celle
de la banane.
Cette espèce chimique est de ce fait utilisée comme arôme de banane dans
certains déserts.
Elle est synthétisée au laboratoire de la façon suivante.
 Mode
opératoire :
Mode
opératoire :
-
Dans un ballon bien sec, introduire 5 mL de linalol.
-
Sous la hotte, ajouter
- 10 mL d'acide éthanoïque
et
- 2 mL d'acide sulfurique
mesurés à l'aide d'une éprouvette bien sèche.
- Boucher.
- Agiter doucement en maintenant le
bouchon.
- Réaliser le montage à reflux et
chauffer pendant 20 minutes.
- Après refroidissement, le contenu du
ballon est versé dans une ampoule à décanter.
- Après séparation des phases, la phase
inférieure donne un test positif au sulfate de cuivre anhydre.
- Données :
Pictogrammes
a)- À l’aide des
données de l’énoncé, expliquer pourquoi il est nécessaire de boucher le mélange
linalol, acide éthanoïque et acide sulfurique.
- Quelles précautions faut-il prendre pour manipuler l’acide sulfurique ?
En citer
deux.
- L’acide éthanoïque est une espèce chimique irritante.
- L’acide sulfurique est une espèce chimique corrosive.
- Il faut la manipuler avec les gants et porter des
lunettes de sécurité.
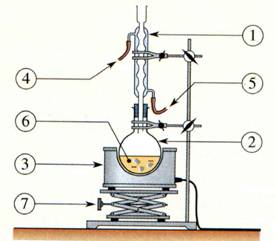
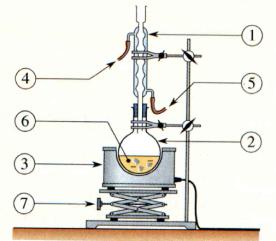
b)- Faire un
schéma légendé du montage à expérimental. Quel est le rôle d’un montage à
reflux ?
- Schéma du chauffage à reflux.
- Ce montage permet de chauffer les réactifs et les
produits du mélange réactionnel.
- Il permet de condenser les réactifs et les produits
grâce au réfrigérant vertical et évite les pertes.
- Les espèces volatiles ne peuvent s’échapper dans
l’atmosphère.
c)- Décrire
succinctement les étapes de la synthèse de l’éthanoate de linalyle.
- Étapes de la synthèse de l’acétate de linalyle :
- Chauffage à reflux pendant 20 min.
- Refroidissement du mélange réactionnel.
- Séparation des différentes phases.
- Extraction par un solvant.
- Évaporation du solvant.
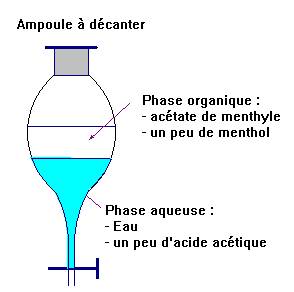
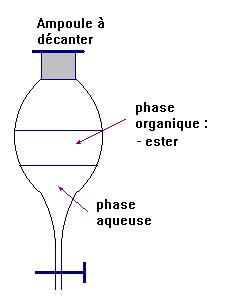
d)- Rappeler le
rôle de l’ampoule à décanter.
- Rôle de l’ampoule à décanter :
- elle
permet l’extraction par un solvant et elle permet aussi la séparation des
différentes phases non miscibles.
- Schéma :
e)- Quelle est
l’espèce chimique mise en évidence par le test au sulfate de cuivre anhydre ?
- Le
test au sulfate de cuivre anhydre met en évidence
l’eau.
f)- À l’aide des informations fournies dans le tableau ci-dessus, préciser ce qui
permet d’affirmer que l’éthanoate de linalyle
n’est pas présent dans la même
phase que l’espèce chimique mise en évidence à la question e)-.
- L’éthanoate de linalyle (ester) est principalement
présent dans la phase organique.
-
Il est moins dense que l’eau et peu soluble
dans l’eau.
g)- Sachant que
l’acide sulfurique n’est pas consommé au cours de la transformation chimique,
donner les réactifs et les produits de la synthèse.
- Décrire par une phrase la synthèse de l’éthanoate de linalyle.
- Les réactifs : linalol et acide éthanoïque.
- Les produits : éthanoate de linalyle et eau.