|
|
|
Chim. N° 11 |
Contrôle d'évolution d'une transformation chimique. Cours |
|
|
Programme 2012 : Transformations en chimie organique : aspect macroscopique Transformations en chimie organique : aspect microscopique Une chimie du développement durable Programme 2012 : Physique et Chimie Programme 2020 : Physique et Chimie |
| Exercices : | |
Pour aller plus loin :
|
Mots clés : synthèse d'un ester, hydrolyse d'un ester ; saponification ; savons ; propriétés des savons ; hydrophile ; hydrophobe ; amphiphile ; détergents ; agent tensioactif ; ... |
I-
Synthèse totale et rapide d’un ester.![]()
1)- Synthèse de l'éthanoate d’éthyle.
- Pour la préparation de l’éthanoate d’éthyle, on peut faire réagir l’acide éthanoïque et l’éthanol.
- Cette réaction est lente, limitée et il faut travailler à température élevée en présence d’un catalyseur.
- Une autre méthode consiste à faire réagir de l’anhydride éthanoïque avec l’éthanol.
- À température modérée (50 – 60 °C), l’anhydride éthanoïque réagit avec l’éthanol pour donner de l ‘éthanoate d’éthyle et de l’acide éthanoïque.
- La réaction ‘’assez’’ rapide a pour équation :
- La réaction d’hydrolyse de l’ester est impossible car il n’y a pas d’eau dans le système.
- La réaction entre l’anhydride éthanoïque et éthanol est une réaction totale.
- L’avancement final est égal à l’avancement maximal.
2)- Généralisation.|
- La réaction d’un anhydride d’acide avec un alcool (ou un phénol) donne un ester selon une réaction : - "assez rapide" et totale. L’avancement final est égal à l’avancement maximal. - Un anhydride d’acide est nettement plus réactif que l’acide correspondant. |
- Équation de la réaction :
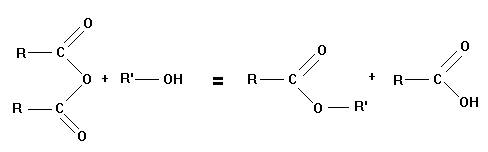
- Synthèse de l’aspirine à partir de l’anhydride éthanoïque et de l’acide salicylique :
- TP Chimie N° 11 : Synthèse de l'aspirine.
II- Contrôle chimique de l’évolution de la réaction d’hydrolyse d’un ester.
1)- L’hydrolyse basique.
- La réaction d’hydrolyse d’un ester est une réaction limitée.
- Pour la rendre totale, une méthode consiste à neutraliser l’acide carboxylique formé au moyen d’une base comme la soude.
- On réalise de ce fait une hydrolyse basique ou saponification.
- Une hydrolyse basique ou saponification correspond à l’action des ions hydroxyde HO – en solution aqueuse sur un ester.
- Il se forme un alcool et un ion carboxylate.
- Équation de la réaction d’hydrolyse basique (saponification) :

- Caractéristiques de la réaction : c’est une réaction lente mais totale.
- La réaction de saponification étant totale, elle est utilisée industriellement pour préparer :
- Des alcools et après acidification du milieu, des acides carboxyliques.
- Exemple : hydrolyse basique du benzoate d’éthyle. Écrire l’équation de la réaction.
- Quel acide peut-on préparer à partir de cette réaction ?
- Écrire l’équation de la nouvelle réaction. Quel alcool peut-on aussi préparer ?
- On peut préparer l’acide benzoïque :
- Il faut ajouter de l’acide chlorhydrique à la solution et l’acide benzoïque précipite en milieu acide ( pK A = 4,2)
- On peut préparer l’éthanol.
- La principale application de l’hydrolyse basique reste la fabrication des savons.
III- Les savons : des produits de la saponification.
- Le mot saponification vient du latin sapo qui signifie «savon ». - C’est l’une des plus vieilles réactions chimiques connues. - Elle permet la fabrication des savons à partir d’esters naturels présents
dans les corps gras d’origine animale ou végétale. - Les corps gras font partie de composés organiques, les lipides présents dans les tissus animaux et végétaux. - Ce sont des lipides simples caractérisés par leur insolubilité dans l’eau et leur toucher onctueux.- L’Histoire des corps gras se confond avec celle de l’Humanité. - On retrouve des lampes à huile et des chandelles chez les Égyptiens (3000 ans A.V J.C). - Ils utilisaient les huiles comme lubrifiant : huile de palme, huile d’olive. - Homère mentionne l’usage de l’huile d’olive pour faciliter le tissage des fibres. - La fabrication du savon était connue du temps des Phéniciens plusieurs siècles avant notre ère. - Pline (le vieux) décrit les savons et spécifie même qu’il y en a des durs et des mous. - Ce n’est que vers 1815 que Michel Eugène CHEVREUL (1786-1889) prouve la nature chimique exacte des corps gras. - Il décrit ses travaux dans l’ouvrage paru en 1823 : Recherche chimique sur les corps gras d’origine animale. |
- Un corps gras est un triester d'acide gras et du glycérol. Les corps gras sont encore appelés triglycérides.
- Le glycérol est un trialcool : le propan-1, 2, 3 -triol.
- Un acide gras est un acide carboxylique à chaîne linéaire, saturée ou non, possédant en général un nombre pair d'atomes de carbone, entre 4 et 22.
|
|
|
|
- Les acides gras : on distingue :
- Les acides gras saturés : acide stéarique ou acide octadécanoïque C18 : C17H35COOH.
- ![]()
-
acide palmitique ou hexadécanoïque en
C16 :
C15H31COOH.
- ![]()
- Les acides gras mono-insaturés : acide oléique ou acide (9Z)-octadéc-9-énoïque : C17H33COOH.
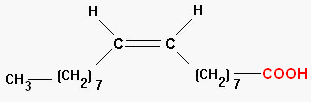
![]()
Cliquer sur l'image pour l'agrandir
- Les acides poly-insaturés : ―
- acide linoléique : C17H31COOH :
- CH3― (CH2)4― CH=CH― CH2― CH=CH― (CH2)7― COOH
- l'acide linolénique : C17H29COOH :
- CH3― (CH2― CH=CH)2― CH2― CH=CH― (CH2)7― COOH
- Les triglycérides ou corps gras sont des triesters des acides gras et du glycérol.
- Les triglycérides sont dits simples si R = R' = R''.
- Sinon les triglycérides sont mixtes.
- Exemple : le palmitate de glycéryle est un triglycéride simple provenant de l'estérification de l'acide palmitique avec le glycérol.
- Exemple : le stéaropalmitooléate de glycéryle est un triglycéride mixte provenant de l'estérification d'un mélange d'acide stéarique, palmitique et oléique avec le glycérol.
- Un savon s’obtient par hydrolyse basique d’un corps gras avec une solution aqueuse d’hydroxyde de sodium ou de potassium.
- Avec la soude : on obtient un savon dur type savon de Marseille.
- Avec la potasse : on obtient un savon mou, type savon noir.
- La saponification est une réaction lente mais totale.
- Une température élevée et un excès de base forte permettent d’augmenter la vitesse de cette transformation.
- Équation de la réaction :
- Le glycérol est un sous produit de la saponification.
- On peut le récupérer par distillation.
- Le relargage permet de récupérer le savon.
- Le relargage consiste à verser le mélange réactionnel dans une solution saturée de chlorure de sodium.
- Le savon précipite.
- Pourquoi agite-t-on au cours de la réaction ?
- Le corps gras et la solution de soude ne sont pas miscibles, on agite pendant l'expérience pour maintenir les réactifs en contact.
- Pourquoi ajoute-t-on de l'éthanol ?
- L'utilisation de l'éthanol rend le mélange réactionnel plus homogène.
- Pourquoi effectue-t-on le relargage avec une solution saturée de chlorure de sodium ?
- La présence des ions chlorure et des ions sodium diminue la solubilité du savon et facilite la précipitation.
- Un savon est un mélange de carboxylate de sodium ou de potassium. - On peut donner la formule générale suivante : (R― COO – + Na+) ou (R― COO – + K+). - Dans les savons, on trouve l’ion carboxylate du type R― COO –, R est une chaîne carbonée constituée de plus de 10 atomes de carbone et ― COO – le groupe carboxylate. - Le groupe carboxylate est hydrophile (il s’entoure de molécules d’eau polaire), il est lipophobe car il n’a pas d’affinité pour les chaînes carbonées présentes dans les graisses. - La chaîne carbonée R est hydrophobe car elle n’est pas polaire, mais elle est lipophile car elle a beaucoup d’affinité pour les chaînes carbonées. - Les ions carboxylates possèdent : - une extrémité hydrophile ― COO – tête hydrophile - une extrémité lipophile R― queue hydrophobe - Ce sont des espèces amphiphiles.
|
- Les savons sont peu solubles dans l'eau :
|
Eau |
||
|
(R― COO Na) (s) |
= |
R― COO – (aq) + Na +(aq) |
- Une solution aqueuse de savon est basique du fait de la présence de l'ion carboxylate R― COO - (aq).
- En milieu acide, l'acide carboxylique : R― COOH précipite. Un milieu acide est défavorable à l'action d'un savon.
- D'autre part une solution aqueuse de chlorure de sodium fait précipiter le savon contenu dans une solution aqueuse, elle permet le relargage du savon.
- En présence d'ions calcium et magnésium, il y a précipitation de carboxylate de calcium et de magnésium.
|
2 R― COO – (aq) + Ca 2+(aq |
= |
(R― COO)2 Ca (s) |
|
2 R― COO – (aq) + Mg 2+(aq |
= |
(R― COO)2 Mg (s) |
- Les eaux dures qui contiennent des ions calcium et magnésium sont défavorables à l'action d'un savon.
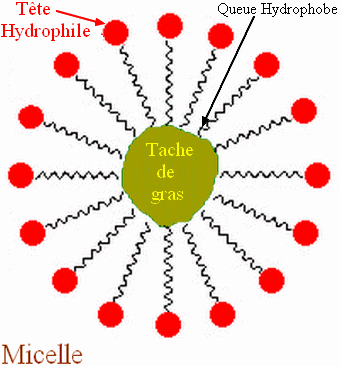
- Dans l’eau les particules de savon se regroupent sous forme de micelles.
- Les parties hydrophobes (R un radical alkyle) qui fuient l’eau se rassemblent entre elles.
- Elles sont solubilisées grâce à l’affinité pour l’eau des extrémités hydrophiles (le groupe carboxylate).
- Les parties hydrophobes sont solubles dans les huiles et les graisses constituant la saleté du linge.
- Ainsi les particules savonneuses peuvent s’enfoncer dans les tâches organiques et les retirer du tissu.
- Les gouttelettes d’huile se retrouvent enfermées dans un film polaire soluble dans l’eau.
- Les micelles chargées négativement vont se repousser et se retrouver dispersées et forment une émulsion.
- Le savon donne naissance à une mousse qui entraîne les particules mouillées.
- En s’interposant entre le tissu et la saleté, en détruisant son adhérence, un savon abaisse les tensions superficielles.
- C'est un agent tensioactif.
- Les savons ont de ce fait des propriétés :
- Mouillantes
- Émulsifiantes
- Moussantes.
- Ce sont de bons détergents.
V- Importance du choix des conditions expérimentales.
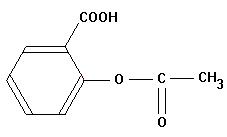
- C’est la forme la plus simple de l’aspirine.
- Ces comprimés sont généralement dosés à 500 mg d’acide acétylsalicylique.
- Ils contiennent un minimum d’additifs :
- De l’amidon,
- Du gel de silice (pour maintenir la poudre agglomérée).
- L’aspirine possède un groupe acide carboxylique :

- C’est un acide faible en solution aqueuse pK A = 3,5 à 25 °C.
- Et un groupe ester

![]() Quelles sont les réactions possibles sur l’aspirine lorsque l’on
fait agir une base forte comme la soude ?
Quelles sont les réactions possibles sur l’aspirine lorsque l’on
fait agir une base forte comme la soude ?
a)- Réaction acide – base.
- On peut utiliser cette réaction pour doser l’acide acétylsalicylique car la réaction est totale et rapide.
-
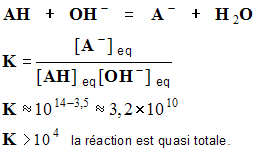
b)- réaction de saponification.
- Il se produit une réaction de saponification entre la fonction ester et les ions hydroxyde.
- Cette réaction est totale mais elle est très lente à la température de 25 °C.
- Il faut chauffer pour accélérer la réaction.
- Équation de la réaction :
- Aux températures usuelles, la réaction de saponification n’a pas le temps de se faire.
- Le dosage de l’aspirine par la soude revient à un dosage acide - base (pK A ≈ 3,5).
- On peut réaliser un dosage pH-métrique ou un dosage colorimétrique (phénolphtaléine).
- Le dosage en retour consiste :
- À faire réagir l’acide acétylsalicylique à doser avec un excès connu de soude jusqu’à saponification complète de la fonction ester,
- Puis à doser la soude restante par une solution d’acide chlorhydrique.
- On en déduit le titre ou la concentration de l’acide acétylsalicylique.
- Remarque :
- Il y a trois réactions en compétition qui se produisent simultanément.
-
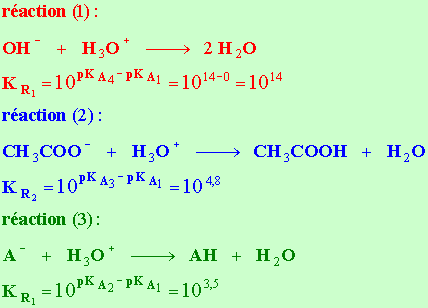
- La réaction (1) est prépondérante devant les deux autres.
- Si l’on fait un dosage pH-métrique, la première partie de la courbe correspond au dosage base forte - acide fort et
- la deuxième partie de la courbe correspond à un dosage base faible - acide fort.
- Remarque : si l'on effectue un dosage colorimétrique, on utilise la phénolphtaléine au lieu du B.B.T comme indicateur coloré.
- Lors d'un dosage acide fort base forte, le pH à l'équivalence est égal à 7,
- mais ici, il faut éviter que les ions oxonium réagissent avec les bases faibles présentes dans la solution :
- les ions éthanoate et les ions salicylate.
a)- Mode opératoire. - Dans un ballon de 250 mL, on introduit avec précaution 20,0 mL d'une solution aqueuse de soude de concentration C = 8,0 mol / L, 11,0 mL d'une huile alimentaire, 10,0 mL d'éthanol et quelques grains de pierre ponce. - On chauffe à reflux le mélange durant 30 min. - Ensuite, on verse le mélange réactionnel dans une solution de chlorure de sodium pour effectuer le relargage du savon. - Une filtration est réalisée, puis le savon obtenu est lavé et séché. b)- Données. - On considère que l'huile alimentaire n'est constituée que d'oléine qui est le triester du propane-1,2 ,3-triol (glycérol) et de l'acide oléique ; - Sa masse volumique est ρ = 0,90 g / mL et sa masse molaire est M = 884 g / mol. - Formule de l'acide oléique : : acide oléique ou acide (9Z)-octadéc-9-énoïque C17H33COOH. c)- Questions. - Quels sont les rôles du chauffage et du reflux ? - Quel est le but du relargage ? - Écrire la formule semi-développée de l’acide oléique et du glycérol. - Écrire la formule semi-développée de l'oléine. - Écrire l'équation bilan de la réaction de saponification de l'oléine. - Déterminer la quantité de matière n1 d'ions hydroxyde introduit dans le ballon. - Déterminer la quantité de matière n2 d'oléine introduite dans le ballon. - Déterminer la masse maximale m de savon sec que l'on peut espérer recueillir. |
|
Corrigé. - En chauffant, on accélère la réaction de saponification qui est une réaction lente. - Le chauffage à reflux permet de condenser les vapeurs des réactifs et
des produits dans le réfrigérant et de les faire retourner à l'état liquide
dans le ballon. - L'ajout d'un composé ionique tel que le chlorure de sodium dans le mélange
réactionnel diminue la solubilité du savon, qui de ce fait, précipite. - Formule semi-développée de l’acide oléique :
- Formule semi-développée du glycérol :
- Formule semi-développée de l'oléine :
- Équation bilan : - Avec
R qui
remplace :
- Quantité de matière d'ions hydroxyde : - n1 = C . V = 8,0 x 20 x 10 – 3 - n1 ≈ 0,16 mol - Quantité de matière d'oléine :
-
Masse de savon : la soude est en excès, c'est l'oléine qui limite la
réaction. -
Masse molaire de l'oléate de sodium :
M (oléate de sodium) = 304 g /
mol. - m = 3 n2 . Msavon = 3 x 0,011 x 304 - m ≈ 10 g |
||||||||||||||||||||||||||||||||||||