|
|
Synthèse Exercices |
|
|
|
|
1)- Exercice 04 page 148 : Recherche des pictogrammes de danger :
|
Recherche des pictogrammes de danger : Associer à chaque pictogramme de danger sa signification. Choisir dans la liste ci-dessous :
-
Corrosif
-
Inflammable
-
Dangereux pour l’environnement
-
Dangereux pour la santé. |
|
Recherche des pictogrammes de danger :
|
2)- Exercice 06 page 148 : Prélever un liquide :
|
Prélever un liquide : Lors d’une synthèse , on doit prélever 0,10 mol d’anhydride
éthanoïque noté A.
-
Décrire le prélèvement de cette
espèce liquide en précisant le matériel utilisé.
-
Données relatives à l’anhydride
éthanoïque :
-
ρ (A)
= 1,08 g . mL–1
-
M (A)
= 102,1 g . mol–1.
-
Pictogrammes :
|
|
Prélever un liquide : Lors d’une synthèse , on doit prélever 0,10 mol d’anhydride
éthanoïque noté A.
-
Prélèvement de cette espèce liquide
-
le matériel utilisé.
-
Quantité de matière d’anhydride
éthanoïque à prélever :
-
n (A)
= 0,10 mol
-
Masse
m d’anhydride éthanoïque
à prélever :
-
m (A)
=
n (A)
.
M (A)
-
m (A)
= 0,10 × 102,1
-
m (A)
≈ 10,21 g
-
m (A)
≈ 10 g
-
Matériel utilisé :
gants, lunettes, blouse, - Ne pas approcher l’espèce chimique d’une source de chaleur
ou d’une étincelle - Bécher ou erlenmeyer de 50 mL, balance et pipette pour ajuster
la valeur de la masse.
-
Mode opératoire :
-
Verser une quantité suffisante
d’anhydride éthanoïque dans un bécher
-
Placer l’erlenmeyer sur la balance et
appuyer sur le bouton « Tare ».
-
Verser environ 9,0 g d’anhydride
éthanoïque dans l’erlenmeyer
-
Puis ajuster la valeur avec une
pipette.
-
Enfin, verser le liquide dans le
ballon réactionnel.
-
On peut travailler avec le volume
puisque l’espèce chimique est liquide :
-
Volume d’anhydride éthanoïque à
prélever :
-
-
Matériel utilisé :
gants, lunettes, blouse , - Ne pas approcher l’espèce chimique d’une source de chaleur ou
d’une étincelle - Bécher ou erlenmeyer de 50 mL, pipette graduée de 10,0 mL munie
de sa propipette.
-
Mode opératoire :
-
Verser une quantité suffisante
d’anhydride éthanoïque dans un bécher
-
Remplir la pipette graduée de 10 mL.
-
Verser la quantité nécessaire (9,5
mL) dans l’erlenmeyer.
-
Enfin, verser le liquide dans le
ballon réactionnel. |
3)- Exercice 07 page 148 : Calculer des quantités de réactifs :
|
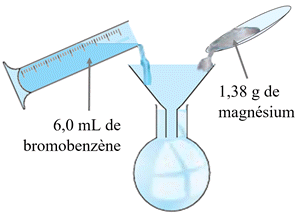
Calculer des quantités de réactifs : - Calculer les quantités de matière des réactifs introduits dans le ballon schématisé ci-dessous.
-
Données :
-
Bromobenzène :
-
ρ1 = 1,08 g .
mL–1
-
M1
= 157,0 g . mol–1.
-
Magnésium :
-
M2
= 24,3 g . mol–1 |
Calculer des quantités de réactifs : -
Quantités de matière des réactifs
introduits dans le ballon.
-
Quantité de matière
n1 de
bromobenzène :
-
-
Quantité de matière
n2 de
magnésium :
-
-
Le magnésium est utilisé en chimie organique pour
fabriquer des réactifs de Grignard. -
La réaction entre le bromobenzène et le magnésium, en
présent d’éther anhydre comme solvant, permet de préparer le
bromure de phénylmagnésium. -
Le bromure de phénylmagnésium est un organomagnésien
(réactif de Grignard) qui permet de réaliser la
synthèse de l’acide benzoïque. -
Acide benzoïque : Victor Grignard (1871-1935)
- L'éther éthylique ou éthoxyéthane est
un composé de la famille des éthers.
-
Il est souvent utilisé comme solvant
et autrefois comme anesthésique général.
-
C’est un liquide incolore très
inflammable (Teb
= 35 ° C) à l’odeur caractéristique.
-
Il est faiblement soluble dans l’eau
(Solubilité dans l’eau à 20℃ : 60 g . L–1).
-
Formule semi-développée : CH3–
CH2 – O –
CH2 –
CH3
-
Formule topologique : - Modèle 3 D :
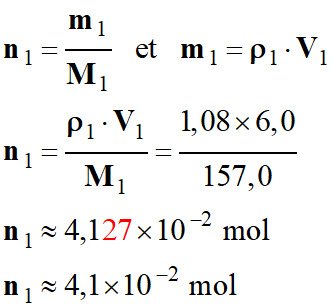
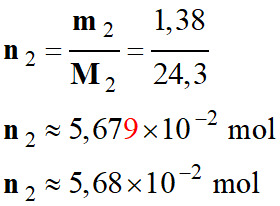
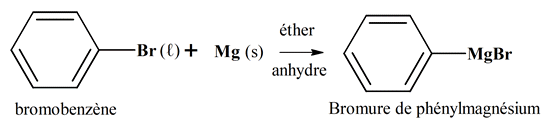
prix Nobel de
Chimie 1912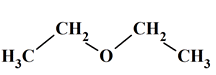

![]()
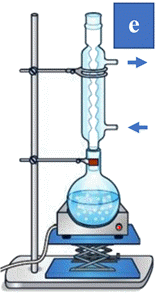
4)- Exercice 10 page 149 : Associer un schéma à une étape :
|
Associer un schéma à une étape : Les étapes de préparation d’un savon au laboratoire sont
présentées ci-dessous : Étape 1 : Mélanger dans un ballon : 18 mL d’huile de soja, 40 mL d’une solution de concentration 50 g . L–1 en
hydroxyde de sodium 2 mL d’éthanol. Chauffer à reflux pendant 30 min. Étape 2 : Laisser refroidir le mélange quelques minutes, Puis transvaser dans un bécher contenant une solution aqueuse de
chlorure de sodium. Étape 3 : Filtrer sous vide le
précipité obtenu, Rincer à l’eau salée, sécher et peser. La masse obtenue expérimentalement est mexp =
10,5 g. - Pour chaque étape de la synthèse, choisir le dispositif adapté parmi ceux proposés ci-dessous.
|
Associer un schéma à une étape : Les étapes de préparation d’un savon au laboratoire sont
présentées ci-dessous :
- Le dispositif adapté aux différentes
étapes de la synthèse, Étape 1 : Mélanger dans un ballon : 18 mL d’huile de soja, 40 mL d’une solution de concentration 50 g . L–1 en
hydroxyde de sodium 2 mL d’éthanol. Chauffer à reflux pendant 30 min. Étape 2 : Laisser refroidir le mélange quelques minutes, Puis transvaser dans un bécher contenant une solution aqueuse de
chlorure de sodium. Étape 3 : Filtrer sous vide le
précipité obtenu, Rincer à l’eau salée, sécher et peser. La masse obtenue expérimentalement est mexp =
10,5 g.
-
L’huile de soja est constituée en
majeure partie d’un mélange de triglycérides issus des acides gras suivants :
-
L’acide
a-linolénique (8 %) ;
-
L’acide linoléique (51 %) ;
-
L’acide oléique (23 %) ;
-
Elle contient :
-
De l’acide oléique
-
De l’acide linoléique et de l’acide
α–linolénique. Acide gras
Formule semi-développée
Formule
simplifiée
Acide
α-linolénique
CH3
– CH2 – (CH = CH – CH2)3
– (CH2)6 – COOH
C17H29
–
COOH
Acide
linoléique
CH3
–
(CH2)4
– (CH= CH
–
CH2)2
–
(CH2)6
– COOH
C17H31
– COOH
Acide
oléique
CH3
–
(CH2)7
– CH=CH
–
(CH2)7
– COOH
C17H33
–
COOH
![]()
5)- Exercice 12 page 149 : Isoler un produit solide :
|
Isoler un produit solide : Le bénorilate est un solide très soluble à chaud et peu soluble à froid dans un mélange eau-éthanol. Pour le synthétiser, on introduit, dans 100 mL d’un mélange d’eau-éthanol :
-
18,0 g d’aspirine :
-
15,1 g de paracétamol
-
Quelques gouttes d’acide
sulfurique concentré. Le mélange est ensuite chauffé à reflux pendant 30 min. - Rédiger un protocole expliquant comment isoler les cristaux de bénorilate après
refroidissement du mélange. |
|
Isoler un produit solide :
-
Chauffage à reflux :
-
On chauffe pour accélérer la réaction
qui est lente à température ambiante.
-
On chauffe aussi pour rendre le
milieu réactionnel plus homogène.
-
Le chauffage à reflux permet de
chauffer tout en évitant les pertes par évaporation. - Ce montage permet de maintenir le milieu réactionnel à une température constante, en l'occurrence
pratiquement la température d'ébullition du solvant. - Les vapeurs sont condensées dans le réfrigérant et retournent à l'état liquide dans le ballon.
-
Les réactifs et les produits restent
dans le milieu réactionnel.
-
Il permet d’accélérer la réaction
sans perte de matière. - Protocole expliquant comment isoler les cristaux de bénorilate après refroidissement du mélange :
-
On réalise la trempe du mélange
réactionnel pour faire précipiter le bénorilate. - C’est-à-dire que l’on refroidit brusquement le mélange réactionnel pour obtenir les cristaux de
bénorilate.
-
On peut laver les cristaux avec un
mélange glacé eau-éthanol.
-
On réalise une recristallisation pour
purifier le bénorilate. - Pour se faire, on dissout le bénorilate dans un mélange eau-éthanol que l’on chauffe.
-
Puis on refroidit brusquement pour
obtenir à nouveau les cristaux de bénorilate.
-
On filtre le mélange réactionnel sous
pression réduite.
-
On place les cristaux dans une boîte
de Pétri.
-
On utilise une étuve pour effectuer
le séchage du bénorilate. - Le Salipran® est un médicament di-antalgique utilisé notamment contre la douleur.
-
Le principe actif en est le
bénorilate. - C’est le seul produit organique obtenu lors de la réaction entre l’aspirine et le
paracétamol.
- Synthèse du bénorilate (Un di-antalgique, le Salipran®)
-
La synthèse du bénorilate est une
réaction d’estérification.
-
L’inverse de cette réaction est
l’hydrolyse de l’ester.
-
La synthèse du bénorilate est une
réaction sélective. - Le groupe hydroxyle du paracétamol réagit avec le groupe carboxyle de l’aspirine. - Les fonctions amide et ester de ces deux réactifs ne sont pas concernées par cette synthèse.
-
Lors de l’hydrolyse, on obtient le
paracétamol et l’aspirine. - Le bénorilate est un « di-antalgique » car lors de l’hydrolyse, il libère deux molécules antalgiques, le paracétamol et l’aspirine. |
6)- Exercice 14 page 149 : Connaître des techniques d’analyse.
|
Connaître des techniques d’analyse :
-
Citer une technique d’analyse
permettant d’identifier :
-
Un liquide
-
Un solide
-
Un
solide ou un liquide. |
|
Connaître des techniques d’analyse :
- Identifier une espèce chimique
liquide : - On peut mesurer son indice de réfraction (on utilise un réfractomètre). - On peut mesurer sa densité
- On peut mesurer sa température de
fusion au banc Köfler
- Identifier une espèce chimique solide
ou liquide :
- On peut réaliser une chromatographie
sur couche mince C.C.M.
|
7)- Exercice 15 page 149 : Proposer une technique d’analyse :
|
Proposer une technique d’analyse : Le camphre est le principal constituant du baume du tigre.
-
Du camphre est synthétisé au
laboratoire.
-
Expliquer comment l’identifier en
mesurant l’une de ses caractéristiques.
-
Données :
-
Tfus (camphre)
= 175 ° C
-
Téb (camphre)
= 209 ° C |
|
Proposer une technique d’analyse :
-
Synthèse du camphre : - C’est un solide blanc que l’on peut obtenir par entrainement à la vapeur de l’écorce, des racines et des
branches du camphrier.
-
Le camphre peut être synthétisé par
oxydation du bornéol ou de l’isobornéol.
-
L’oxydation peut être réalisée avec
des sels de chrome qui sont extrêmement toxiques
-
L’oxyde de chrome
CrO3 (s) est oxydé en ion
Cr3+ en milieu acide.
-
Alors que le bornéol ou l’isobornéol
est réduit en cétone.
-
« Oxydation verte » : - Afin de ne pas utiliser les sels de chrome dans certains sont cancérogènes, on préfère utiliser l’eau de
javel comme source d’ions hypochlorite
CℓO–.
fusion du solide
obtenu au banc Köfler (à réaliser sous la hotte). - Attention : - Les cristaux sont très fins et « volants ». - De plus, le
camphre se sublime facilement et il est inflammable.
-
On peut réaliser une
C.C.M.
-
On dissout le solide blanc dans un
solvant adapté (éthoxyéthane ou propanone). - On fait sur une plaque de silice un dépôt d’isobornéol, de camphre pur et du produit synthétisé. - Comme éluant on choisit un mélange de cyclohexane et d’éthanoate d’éthyle (80 % et 20 %)
-
La révélation :
-
Comme révélateur, on choisit une
solution diluée de permanganate de potassium - Après élution, on plonge la plaque CCM dans une solution diluée de permanganate de potassium.
-
Puis, on sèche la plaque
CCM (sèche-cheveux)
-
Formule brute :
C10H16O
-
Nom :
1,7,7-triméthylbicyclo[2.2.1]heptan-2-one
-
Formule semi-développée :
-
Formule topologique :
|
8)- Exercice 16 page 150 : Interpréter un chromatogramme :
|
Interpréter un chromatogramme : La synthèse de lidocaïne est réalisée en faisant agir de la N-chloroacétyl-2,6-diméthylaniline (notée A) et de la diéthylamine (notée
B). Sur une plaque à chromatographie, on dépose une solution :
-
Du réactif
A, en 1
-
Du produit synthétisé, en 2
-
De lidocaïne commerciale, en 3. Après révélation, on obtient le chromatogramme ci-dessous.
-
Quelles conclusions peut-on tirer de
l’analyse du chromatogramme. |
|
Interpréter un chromatogramme :
-
Analyse du chromatogramme :
-
Dépôt 1 : réactif
A
-
Dépôt 2 : Produit synthétisé,
-
Dépôt 3 : lidocaïne commerciale :
-
Le produit synthétisé n’est pas pur
car on observe deux taches.
-
C’est un mélange :
-
Du réactif
A : on observe une tache
à la même hauteur que le réactif
A - De lidocaïne commerciale : on observe une tache à la même hauteur que la
lidocaïne commerciale.
-
En conséquence, soit :
-
La réaction de synthèse n’était pas
terminée
-
La réaction de synthèse n’est pas
totale
-
La lidocaïne a été introduite en
excès. ADDITIF :
-
Synthèse de lidocaïne - La lidocaïne est un anesthésique local très utilisé en pédiatrie et un antiarythmique de la
famille des amino-amides.
-
Équation chimique de la synthèse :
-
Molécule
A (familles des amides) :
- Nom : N-chloroacétyl-2,6-diméthylaniline ou 2-chloro-N-(2,6-dimethylphenyl)acétamide
-
Formule brute :
C10H12CℓNO
-
Molécule
B (famille des
amines) :
-
Nom : diéthylamine ou
N-éthyléthanamine.
-
Formule brute :
C4H11N
-
La lidocaïne (famille des amides) :
-
Nom : 2-(diéthylamino)-N-(2,6-diméthylphényl)acétamide
-
Formule brute :
C14H22N2O
-
Molécule
C :
-
Nom : chlorure d’hydrogène :
-
Formule brute :
HCℓ
|
9)- Exercice 18 page 150 : Calculer le rendement :
|
Calculer le rendement : Un ester de formule C12H22O2 peut être préparé à partir d’une quantité n1 = 0,193 mol d’acide éthanoïque C2H4O2 et d’une quantité n2 = 0,100 mol de menthol C10H20O. L’équation de la réaction
est : C10H20O
(ℓ) + C2H4O2
(ℓ) → C12H22O2
(ℓ) + H2O (ℓ) Dans ces conditions, on obtient une masse m = 12,0 g
d’ester. 1.
Identifier le réactif limitant. 2.
Calculer le rendement de la synthèse.
-
Donnée :
-
M (Ester) = 198 g . mol–1. |
Calculer le rendement :
-
Quantité de matière d’acide
éthanoïque : n1 = 0,193 mol
-
Quantité de matière de menthol : n2
= 0,100 mol
-
Tableau d’avancement de la réaction : Équation
C10H20O
(ℓ)
+
C2H4O2
(ℓ)
→
C12H22O2
(ℓ)
+ H2O
(ℓ)
État du
système
Avancement
n (C10H20O)
n (C2H4O2)
n (C12H22O2)
n
(H2O)
État initial
(mol)
x =
0
n1
= 0,193
n2
= 0,100
0
0
État
intermédiaire
0 ≤ x ≤ xf
0,193 – x
0,100 – x
x
x
État final
(mol)
x = xf
0,193 – xf
0,100 – xf
xf
xf
État
maximal
(mol)
x = xmax
0,193 – xmax
0,100 – xmax
xmax
xmax
xmax
= 0,100
0,093
0
0 ,100
0,100
-
La réaction se fait mole à mole.
-
L’acide éthanoïque a été introduit en
excès.
-
Le menthol est le réactif limitant. 2.
Rendement de la synthèse.
-
Masse d’ester obtenue : m =
12,0 g.
-
Quantité de matière d’ester
obtenue :
-
-
Rendement de la réaction :
-
le
rendement se calcule par rapport au réactif limitant (le menthol)
-
On appelle rendement, noté η,
de la synthèse, le quotient de la quantité de produit P
effectivement obtenue nP par la quantité maximale
attendue nmax :
-
-
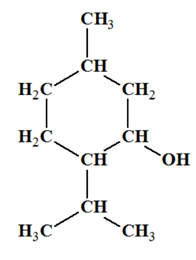
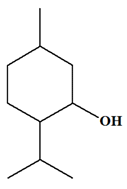
ADDITIF :
-
Le menthol :
-
Il fait partie de la famille des
alcools. C’est un alcool secondaire.
-
Nom :
5-méthyl-2-(propan-2-yl)cyclohexan-1-ol
-
Formule brute : C10H20O
-
Formule semi-développée :
Nom
Menthol
Formule brute
C9H18CHOH
Formule
topologique
Température
d’ébullition
215 °
C
Température
de
fusion
43 °
C
Solubilité
dans
l’eau
faible
Densité
0,89
-
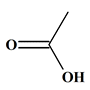
L’acide acétique : acide
éthanoïque.
-
Il fait partie de la famille des
acides carboxyliques.
-
Formule brute : C2H4O2
-
Formule semi-développée : CH3–COOH Nom
Acide
éthanoïque
Formule brute
C2H4O2
Formule
topologique
Température
d’ébullition
118 °
C
Température
de
fusion
16 °
C
Solubilité
dans
l’eau
Grande
Densité
1,05
-
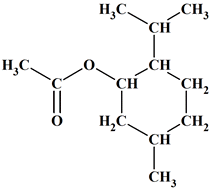
Acétate de menthyle ou
éthanoate de menthyle :
-
Il fait partie de la famille des
esters.
-
On la trouve dans l’huile essentielle
de menthe des champs (50 à 70 % de menthol, 5 à 20 % de menthone et
2 à 7 % d’acétate de menthyle).
-
C’est un monoterpène naturel qui
contribue à l’odeur et à la saveur de la menthe poivrée (mentha
piperata).
- La menthe poivrée a
des propriétés anti-inflammatoires et antivirales,
dues entre autres
au menthol et à l’eucalyptol.
-
On la trouve
traditionnellement dans les pastilles contre
le mal
de gorge.
-
L’huile essentielle
est obtenue par hydrodistillation des
feuilles de
menthe poivrée.
Menthe pivrée :
-
Il amplifie la touche "florale" des eaux de lavande
commerciales. - On le trouve dans la composition de certains parfums.
-
Nom : acétate de
5-méthyl-2-(propan-2-yl)cyclohexyle
-
Formule semi-développée : Nom
Acétate de menthyle
Formule brute
C12H22O2
Formule
topologique
Température
d’ébullition
227 °
C
Température
de
fusion
< 0 °
C
Solubilité
dans
l’eau
Très
faible
Densité
0,92
-
La
réaction d’estérification est une réaction lente, limitée et
athermique.
-
Le
rendement de l’estérification dépend de la classe de l’alcool
utilisé. Pour des mélanges équimolaires, le rendement est de :
-
67 % pour un alcool primaire.
-
60 % pour un alcool secondaire
-
5 % pour un alcool tertiaire.
- le
rendement est défini par rapport au réactif limitant.
-
On peut
améliorer le rendement d’une réaction limitée en ajoutant :
-
Un excès
de l’un des réactifs de la réaction,
-
Ou en
éliminant d’un des produits de la réaction.
-
Équation de la réaction :
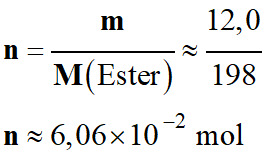
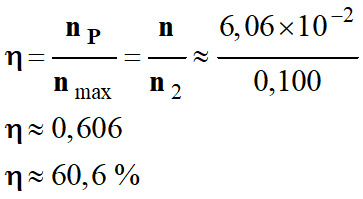



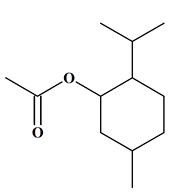
![]()
10)- Exercice 21 page 151 : La betterave sucrière :
|
La betterave sucrière : Le saccharose contenu dans une betterave sucrière est extrait
avec de l’eau. À la fin de l’extraction, on recueille une solution aqueuse
S de
saccharose. On réalise ensuite une hydrolyse du saccharose contenu dans cette solution à l’aide du montage à reflux. Cette hydrolyse peut être modélisée par la réaction d’équation :
1.
Groupes
présents : a. Identifier et nommer l’un des groupes caractéristiques présents dans la molécule de saccharose. b.
Proposer une explication à la grande
solubilité du saccharose dans l’eau. 2.
Montage utilisé : a.
Schématiser et légender le montage de
chauffage à reflux. b.
Préciser le rôle du réfrigérant. 3.
Afin de suivre la réaction d’hydrolyse, on
réalise une chromatographie sur couche mince :
-
Dépôt
A : solution de
saccharose de référence
-
Dépôt
B : solution de glucose
de référence
-
Dépôt
C : solution de fructose
de référence
-
Dépôt
D : solution
S de saccharose
-
Dépôt
E : échantillon prélevé
au cours de l’hydrolyse
-
Dépôt
F : échantillon prélevé à
la fin de l’hydrolyse . Après élution et révélation, on obtient le chromatogramme ci-dessous sur lequel les taches correspondant aux dépôts D, E et F ont été masquées. Retrouver leurs positions.
-
Données :
-
Formule semi-développée du
saccharose :
- On suppose que la transformation est totale, que l’eau est en excès et qu’initialement la betterave ne contenait ni glucose et ni
fructose. |
|
La betterave sucrière : 1.
Groupes présents : a.
Identification et nom des groupes
caractéristiques présents dans la molécule de saccharose.
-
Groupe
hydroxyle : – OH (famille des alcools)
-
Groupe éther oxyde :
C – O – C (famille des éthers)
b.
La grande solubilité du saccharose dans
l’eau. - La grande solubilité du saccharose dans l’eau est liée à la présence de liaisons hydrogène entre les molécules d’eau et les molécules de saccharose. Ceci est lié à la
présence des groupes hydroxyle :
– OH. 2.
Montage utilisé : a.
Schéma et légende du montage de chauffage à
reflux.
b.
Rôle du réfrigérant.
-
Les vapeurs sont condensées dans le
réfrigérant et retournent à l'état liquide dans le ballon.
-
Les réactifs et les produits restent
dans le milieu réactionnel.
- Dépôt D : solution S de saccharose : on obtient une tache à la même hauteur que le dépôt A. Le saccharose
contenu initialement dans une betterave sucrière ne contient ni
glucose et ni fructose. - Dépôt E : échantillon prélevé au cours de l’hydrolyse au cours de l’hydrolyse le mélange réactionnel contient encore du saccharose et il s’est formé du glucose et du fructose. On observe deux taches : un au niveau du saccharose et une au niveau du glucose et du fructose. Le glucose et
le fructose donne une tache à la même hauteur. - Dépôt F : échantillon prélevé à la fin de l’hydrolyse. En fin de réaction, tout le saccharose a disparu : c’est le réactif limitant de la réaction d’hydrolyse. On
observe une tache au niveau du glucose et du fructose ADDITF :
-
Le saccharose :
-
Formule brute :
C12H22O11
-
Nom :
2-{[3,4-dihydroxy-2,5-bis(hydroxyméthyl)oxolan-2-yl]oxy}-6-(hydroxyméthyl)oxane-3,4,5-triol
-
Formule semi-développée :
-
Formule topologique :
- Le glucose : - Formule brute : C6H12O6
-
Modèle du glucose linéaire :
- C
- Nom : 2,3,4,5,6-pentahydroxyhexanal
- Formule semi-développée :
-
Formule semi-développée du glucose (forme
cyclique) :
- Formule brute :
C6H12O6
- Modèle du fructose linéaire :
- Cette molécule possède un groupe carbonyle (famille des cétones) et 5 groupes hydroxyle (famille des alcools). - Nom :
1,3,4,5,6-pentahydroxyhexan-2-one
- C’est un hexose (sucre à 6 atomes de
carbone) qui présente la même formule brute que le glucose.
- Le fructose a tendance à former un cycle
de type pyranose (5 atomes de carbone et 1 atome d’oxygène).
fructopyranose
- Nom :
2-(hydroxyméthyl)oxane-2,3,4,5-tétrol
- Il peut former un cycle de type furanose
(4 atomes de carbone et 1 atome d’oxygène).
(fructofuranose)
- Nom :
2,5-bis(hydroxyméthyl)oxolane-2,3,4-triol
|
11)- Exercice 22 page 151 : Ester à odeur de rhum :
|
Ester à odeur de rhum : L’industrie alimentaire met sur le marché de nombreux produits à odeur de rhum mais, pour des raisons économiques, beaucoup de contiennent pas de rhum. Ces produits doivent leur odeur au méthanoate d’éthyle C3H6O2
que l’on peut synthétiser. L’équation de la réaction s’écrit : CH3 – CH2 –
OH (ℓ) + HCOOH (ℓ) → CH3 – CH2
– O – CO – H (ℓ) + H2O
(ℓ) ou SYNTHÈSE
►
Introduire dans un ballon :
-
Un volume
V1 = 15,0 mL
d’éthanol, CH3
– CH2 –
OH (ℓ)
-
Un volume
V2 = 10,0 mL
d’acide méthanoïque , HCOOH
(ℓ)
-
Environ 1 mL d’acide sulfurique
concentré
-
Et des grains de pierre ponce.
►
Réaliser le montage représenté
ci-dessous :
►
Lorsque la transformation est
terminée, REFROIDIR le ballon. 1.
Étude du montage : a.
Nommer, schématiser et légender le montage
ci-dessus. b.
Justifier que le liquide recueilli dans
l’erlenmeyer est du méthanoate d’éthyle. 2.
Quantités de matière : a.
Calculer les quantités de matière de
réactifs initialement introduits. b.
En déduire la quantité maximale nmax
de méthanoate d’éthyle attendue. c. Dans l’hypothèse d’un rendement de 100 % calculer le volume maximum du méthanoate d’éthyle attendu. d.
Quelles observations expérimentales
permettent de savoir que la réaction est terminée ? 3. Une analyse du produit obtenu donne un spectre infrarouge ci-dessous. En quoi ce spectre montre-t-il que le
produit est différent des réactifs introduits initialement.
-
Données :
-
Températures d’ébullition :
- Téb (C2H6O) = 78 °
C : Téb (HCOOH)
= 101 ° C
- Téb (C3H6O2)
= 57 ° C
-
Masses volumiques :
- ρ (C2H6O) = 0,789 g
. mL–1 ρ (HCOOH)
= 1,22 g . mL–1
- ρ (C3H6O2)
= 0,902 g . mL–1
-
Bandes de vibrations :
Groupe hydroxyle :
Groupe carbonyle :
Groupe carboxyle :
-
Classification périodique : |
|
Ester à odeur de rhum : 1. Étude du montage : a.
Nom, schéma et légende du montage :
-
Distillation fractionnée.
b.
Le distillat : le méthanoate d’éthyle.
-
Températures d’ébullition :
-
Téb (C2H6O) = 78 °
C : Téb (HCOOH)
= 101 ° C
-
Téb (C3H6O2)
= 57 ° C - Au cours de la distillation fractionnée, les réactifs et les produits se vaporisent
et monte dans la colonne à distillée.
-
Au cours de l'ascension, le mélange
s'enrichi en corps le plus volatil (ici l'ester).
-
C’est le méthanoate d’éthyle qui a la
température d’ébullition la plus faible. - En tête de colonne, le thermomètre affiche une température voisine de 57 ° C (cette température dépend de la pression atmosphérique)
-
En tête de colonne, on obtient le
corps le plus volatil (l’ester) pratiquement pur.
-
Le distillat, c’est-à-dire le
méthanoate d’éthyle, est ensuite condensé grâce au réfrigérant. 2.
Quantités de matière : a.
Quantités de matière de réactifs
initialement introduits.
-
Un volume
V1 = 15,0 mL
d’éthanol, CH3
– CH2 –
OH (ℓ)
-
Un volume
V2 = 10,0 mL
d’acide méthanoïque , HCOOH
(ℓ)
-
ρ1 =
ρ (C2H6O)
= 0,789 g . mL–1
-
ρ2 =
ρ (HCOOH) = 1,22 g . mL–1
-
Masse molaire de l’éthanol :
-
M1 =
M (C2H6O)
= 2 M (C) + 6
M (H) +
M (O)
-
M1 = 2 × 12,0
M (C) + 6 × 1,01 + 16,0
-
M1 ≈ 46,1 g .
mol–1
-
Quantité de matière d’éthanol :
n1
-
-
Masse molaire de l’acide
méthanoïque :
-
M1 =
M (HCOOH) = M (C)
+ 2 M (H) + 2 M (O)
-
M1 = 12,0
M (C) + 2 × 1,01 + 2 × 16,0
-
M1 ≈ 46,0 g .
mol–1
-
Quantité de matière d’acide
méthanoïque : n2
-
-
Remarque : l’acide sulfurique
catalyse la réaction d’estérification. b.
Quantité maximale nmax de
méthanoate d’éthyle attendue.
-
Tableau d’avancement de la réaction :
-
L’eau ne joue pas le rôle de solvant.
C’est un produit de la réaction.
-
La réaction d’estérification donne
lieu à un équilibre chimique. - Mais comme l’ester est éliminé du mélange réactionnel au fur et à mesure qu’il se forme, ceci entraîne un déplacement de l’équilibre chimique et la
réaction est totale.
-
La réaction se fait mole à mole.
-
Le réactif limitant est l’éthanol :
xmax
= n1
≈ 0,257 mol ≈ nmax
< n2 c.
Volume maximum du méthanoate d’éthyle
attendu.
-
Dans l’hypothèse d’un rendement de
100 % :
-
V (C3H6O2)
= Vmax
-
n (C3H6O2) ≈
0,257 mol
-
d.
Observations expérimentales permettant de
savoir que la réaction est terminée :
-
Au cours de l’expérience, il faut
surveiller la température affichée par le thermomètre. - Au cours de la réaction, le thermomètre affiche la température d’ébullition de l’espèce chimique la plus volatile présente dans le mélange réactionnel :
le méthanoate d’éthyle. - Lorsque la réaction est terminée, la température affichée par le thermomètre baisse momentanément puis augmente à nouveau.
-
On peut arrêter le chauffage.
-
On n’observe plus de gouttes de
distillat tomber dans l’erlenmeyer. 3.
Étude du spectre infrarouge.
-
On n'observe pas les bandes vibrations
caractéristiques des liaisons
– O – H :
-
Bande forte et large (3200 cm–1
– 3400 cm–1) pour les alcools
-
Bande forte et large (2600 cm–1
– 3200 cm–1) pour les acides carboxyliques.
-
En conséquence, le produit obtenu est
bien différent des réactifs. - Spectre IR de l'éthanol : - Spectre IR de l'acide méthanoïque : TP de chimie : Synthèse du méthanoate d'éthyle Exercice : Synthèse d'un liquide
|
||||||||||||||||||||||||||||||||||||||||||||||
|
|