|
Chim. N° 10 |
Estérification et hydrolyse. Cours. |
|
|
|
|
Programme 2012 : Transformations en chimie organique : aspect macroscopique. Transformations en chimie organique : aspect microscopique. Programme 2012 : Physique et Chimie Programme 2020 : Physique et Chimie |
|
2)- Réaction d’estérification.
|
|
VI - Contrôle d'évolution de l'équilibre. |
|
TP Chimie N° 10 : Synthèse des Esters. |
Pour aller plus loin :
|
Mots clés : Esters, estérification, Hydrolyse, évolution de l'équilibre , équilibre d'estérification et d'hydrolyse ; ... |
- On appelle alcool tout composé organique possédant un groupe hydroxyle ― OH lié à un atome de carbone tétragonal.
- Formule générale d’un alcool : ― OH.
- On distingue :
|
Les alcools primaires |
Les alcools secondaires |
Les alcools tertiaires |
|
R ― CH 2 ― OH |
|
|
- Exemples :
|
Éthanol |
propan-2-ol |
2-méthylpropan-2-ol |
|
CH 3 ― CH 2 ― OH |
|
|
- Complément :
|
Tous les alcools ont une grande importance industrielle.
Les alcools dont la chaîne carbonée comporte moins de 10 atomes de carbone sont des liquides incolores à la température ordinaire. La température d'ébullition des alcools est nettement plus importante que celle des alcanes correspondants. Cette particularité est liée à la présence du groupe hydroxyle. La plupart des alcools sont miscibles à l'eau en toutes proportions. Toutefois cette miscibilité décroît avec la longueur de la chaîne carbonée. La molécule d'un alcool possède deux parties : -
Une
partie hydrophobe : la chaîne carbonée -
Une
partie hydrophile : le groupe hydroxyle. La miscibilité est liée à l'importance relative de ces deux parties. Les deux alcools les plus importants sont : L'éthanol (alcool éthylique) que l'on retrouve dans les boissons alcoolisées. Des petites quantités d'éthanol provoque un état euphorique. Des doses plus importantes dépriment gravement le système nerveux : à consommer avec modération ! Le méthanol ou alcool de bois que l'on peut retrouver dans les alcools frelatés. Il provoque la cécité et la mort. On utilise les alcools comme solvant en pharmacie, en cosmétologie… |
- Un phénol est un composé organique dans lequel le groupe hydroxyle ― OH est porté par un cycle benzénique.
- Un phénol n’est pas un alcool car le carbone fonctionnel est trigonal.
|
Le phénol |
le thymol |
|
|
|
- Vis à vis de la formation des esters, on considère qu’un phénol se comporte comme un alcool.
3)- Les aldéhydes et les cétones.
- Les aldéhydes et les cétones sont des composés carbonylés. Ils possèdent le groupe caractéristique :
|
|
|
|
|
Groupe
carbonyle |
aldéhydes |
cétones |
- Le carbone fonctionnel est trigonal.
- Complément :
|
Le nom d'un aldéhyde dérive de celui de l'alcane de même squelette carboné, en remplaçant le e final par la terminaison al. Le carbone fonctionnel est toujours en bout de chaîne et porte le numéro 1.
Le nom d'une cétone dérive de celui de l'alcane de même squelette carboné, en remplaçant le e final par la terminaison one précédée de la position du groupe carbonyle dans la chaîne principale. Le
carbone fonctionnel ne peut pas être en bout de chaîne. Exemples
:
Le méthanal : Gazeux à la température ordinaire. La solution à 37 % dans l'eau, donne le formol qui permet la conservation des spécimens et sert à la fabrication de la bakélite et du formica.
Éthanal : Acétaldéhyde ou aldéhyde acétique a une odeur de pomme (Teb = 17 °C). Il sert à la fabrication de l'acide éthanoïque ou acide acétique.
L'acétone : Propanone sert comme solvant (dissolvant pour le rouge à ongle). |
- Les acides carboxyliques possèdent en commun le groupe caractéristique : ― COOH
|
|
|
R― COOH |
|
Groupe
carboxyle |
Formule
générale |
Autre
formulation |
- Le carbone fonctionnel est trigonal et il est lié à deux atomes d'oxygène.
- Complément :
|
Le nom de l'acide carboxylique dérive de celui de l'alcane de même squelette carboné en remplaçant le e final par la terminaison oïque, le tout étant précédé du mot acide. Exemples :
Les acides carboxyliques saturés dont la chaîne carbonée comprend moins de 9 atomes de carbone sont des liquides incolores à l'odeur piquante et désagréable. D'autant plus désagréable que la chaîne carbonée est longue. Ils sont assez solubles dans l'eau grâce au caractère hydrophile du groupe fonctionnel carboxyle.
Les acides à longue chaîne carbonée sont peu solubles dans l'eau le caractère hydrophobe de la chaîne carbonée devient prépondérant. Les solutions aqueuses ont un pH < 7, d'où le nom d'acide. L'acide méthanoïque (acide formique : formica fourmis), l'acide éthanoïque (acide acétique : acetum : vin aigre)
Acide butanoïque ou butyrique qui donne au beurre rance son odeur caractéristique.
L'acide pentanoïque ou valérique (odeur des racines de la valériane du latin valere être fort), Les acides hexanoïque (caproïque), octanoïque (caprylique), décanoïque (caprique) sont responsables de l'odeur insupportable des chèvres. |
- Un anhydride d’acide résulte de l’élimination d’une molécule d’eau entre deux molécules d’acide carboxylique.
- Il possède le groupe caractéristique suivant :
|
Groupe caractéristique |
Formule développée |
|
|
|
- Réaction chimique :
- nomenclature : On remplace l'appellation acide par anhydride.
- Un anhydride d’acide résulte de l’élimination d’une molécule d’eau entre deux molécules d’acide carboxylique.
- Exemples :
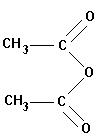 anhydride éthanoïque
anhydride éthanoïque
- Elle est obtenue par élimination d’une molécule d’eau entre deux molécules d’acide éthanoïque :
|
Anhydride
phtalique. |
|
|
- Préparation : On utilise généralement un puissant déshydratant : le décaoxyde de tétraphosphore P4O10.
- On peut donner l’équation simplifiée de l’équation bilan :
-
Remarques :
-
Les
anhydrides d’acide sont liquides ou solides à 25 ° C.
-
Ils
s’hydrolysent facilement en présence d’eau.
-
Ils
sont très corrosifs et il faut les manipuler sous la hotte aspirante et utiliser
une verrerie sèche.
- Ils possèdent le groupe caractéristique suivant :
|
Groupe caractéristique |
Formule développée |
Autre formulation |
|
|
|
|
- Le groupement R peut désigner une chaîne carbonée ou un atome d’hydrogène.
- Alors que R’ désigne nécessairement une chaîne carbonée.
2)- Réaction d’estérification.
- Les esters dérivent des acides carboxyliques par remplacement de leur groupement ― OH par un groupe ― OR provenant d’un alcool.
- équation de la réaction :
|
RCOOH |
+ |
R'OH |
= |
RCOOR' |
+ |
H2O |
|
Acide carboxylique |
|
Alcool |
|
Ester |
|
Eau |
- C’est la réaction d’estérification. Cette réaction sera étudiée en détail lors d’une séance de travaux pratiques.
- Le nom de l’ester comporte deux termes :
- Le premier, qui se termine en oate, désigne la chaîne principale provenant de l’acide carboxylique.
- Le second, qui se termine en yle, est le nom du groupe alkyle provenant de l’alcool.
- Exemples :
|
|
|
|
Éthanoate de méthyle |
méthanoate de propyle. |
- Application : soient les esters CH3COOC2H5 et C6H5COOC2H5:
- Quels sont les acides et l’alcool entrant dans la préparation de
chaque ester ?
- Donner le nom de chaque constituant.
|
|
|
|
Éthanoate
d'éthyle |
benzoate
d'éthyle |
- Complément :
|
A Température ambiante, la plupart des esters sont des liquides de densité inférieure à 1. On peut obtenir des esters solides si les chaînes carbonées de l’acide carboxylique et de l’alcool sont longues.
Les esters sont peu solubles dans l’eau, d’autant peu solubles que la chaîne carbonée est longue.
Exemples : éthanoate de méthyle très soluble ; éthanoate d’éthyle soluble ; éthanoate de propyle peu soluble ; éthanoate d’hexyle insoluble.
La solubilité d’un ester dans la phase aqueuse peut être encore diminuée si on sature la solution avec du chlorure de sodium. Cette opération est appelée Relargage.
Les esters sont complètement miscibles dans l’éthoxyéthane (éther). Exemples
: Esters
et Odeurs. Les esters aliphatiques ont un arôme caractéristique de fruit : l’éthanoate de butyle (odeur de pomme), acétate d’isoamyle (odeur de banane). Les esters cycliques : acétate de 4-tertiobutylcyclohexyle. L'isomère trans a une odeur boisée et l’isomère cis une odeur plus intense, plus fleurie.
|
III-
La réaction d’estérification.![]()
1)- Exemple : Devoir.
|
préparation de l’éthanoate d’isoamyle. TP chimie N° 10 Synthèse d'esters. - Chauffage à reflux. - Introduire dans le ballon : - 15 mL d'alcool isoamylique à 98 % (3-méthylbutan-1-ol). - 20 mL d'acide acétique à 99 % (acide éthanoïque). - Quelques grains de pierre ponce ou quelques billes de verre. - Adapter le réfrigérant et porter le mélange à l'ébullition douce pendant 45 min. - La réaction entre l’acide acétique et l’alcool isoamylique produit de l’acétate d’isoamyle et de l’eau. |
3)- Propriétés de la réaction d’estérification.
- Tableau d’évolution.
|
Équation |
Acide carboxylique |
+ |
Alcool |
= |
Ester |
+ |
Eau |
|
États |
mol |
|
mol |
|
mol |
|
mol |
|
E.I |
1 |
|
1 |
|
0 |
|
0 |
|
E.F |
n1 –
xf |
|
n2 –
xf |
|
xf |
|
xf |
- Si l’on trace la courbe représentant la quantité de matière d’ester formé au cours du temps
pour un mélange initial équimolaire en acide carboxylique et alcool, on obtient le graphe suivant :
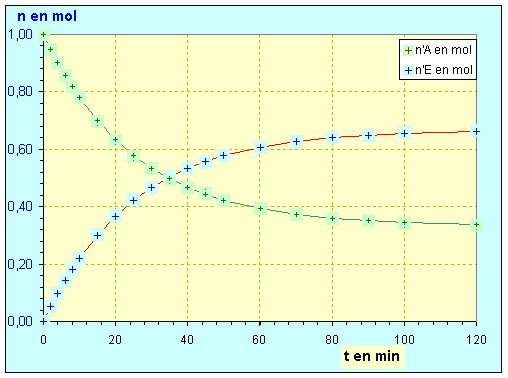
- La réaction d’estérification est une réaction lente, limitée et athermique
IV-
La réaction d’hydrolyse d’un ester.![]()
- L’eau hydrolyse tout ester pour donner un acide carboxylique et un alcool.
|
|
+ |
H2O
|
= |
|
+ |
R'–
OH
|
|
Ester |
|
eau |
|
Acide carboxylique |
|
Alcool |
- La réaction d’hydrolyse d’un ester est la réaction inverse de l’estérification.
2)- Propriétés de la réaction d’hydrolyse d’un ester.
- La réaction d’hydrolyse d’un ester est une réaction lente, limitée et athermique.
V-
L’équilibre d’estérification et d’hydrolyse d’un ester.![]()
- La réaction d’estérification est une réaction lente, limitée et athermique.
- Il en est de même de la réaction d’hydrolyse.
- Les réactions d’estérification et d’hydrolyse d’un ester sont des réactions inverses se produisant dans les mêmes conditions expérimentales.
-
L’état final obtenu est le même que l’on parte d’un mélange équimolaire
d’acide carboxylique et d’alcool ou d’ester et d’eau.
- Dans l’état final, les proportions des différents composés n’évoluent plus au cours du temps.
- On est en présence d’un état d’équilibre.
- C’est un équilibre chimique dynamique.
- Les vitesses des deux réactions inverses sont égales et annulent ainsi leurs effets.
|
RCOOH |
+ |
R'OH |
= |
RCOOR' |
+ |
H2O |
|
Acide carboxylique |
|
Alcool |
|
Ester |
|
Eau |
- Pour simplifier, on peut écrire :
- 
- Cette constante peut se réécrire en notant V le volume du système :
-

- Remarque : l’eau est un produit de la réaction et non un solvant.
- Le rendement d’une réaction est le rapport entre la quantité de produit formé et celle qui aurait été obtenue si la réaction avait été totale.
|
τ = |
Quantité de produit formé |
||
|
|
|
|
|
|
Quantité de produit obtenu pour une réaction totale |
- Le rendement de l’estérification dépend de la classe de l’alcool utilisé.
- Pour des mélanges équimolaires, le rendement est de :
- 67 % pour un
alcool primaire
- 60 % pour un alcool secondaire
- 5 % pour un alcool tertiaire.
VI-
Contrôle d’évolution de l’équilibre.![]()
1)- Influence de la température.
- La température est un facteur cinétique.
- Une élévation de la température du mélange réactionnel permet d’accélérer aussi bien la réaction d’estérification que la réaction d’hydrolyse.
- La température est sans effet sur la limite de l’équilibre.
- Elle ne modifie pas l’état d’équilibre elle permet seulement de l’atteindre plus vite.
- On est en présence d’une réaction athermique.
- Les ions oxonium catalysent aussi bien la réaction d’estérification que la réaction d’hydrolyse.
- Le catalyseur n’intervient pas sur la limite de la réaction.
- Un catalyseur est un corps qui augmente la vitesse d’une réaction chimique sans apparaître dans le bilan de la réaction.
►
Application :
|
- La réaction entre l’acide acétique et l’alcool isoamylique produit de l’acétate d’isoamyle et de l’eau. - Lorsque l’on fait réagir 1 mole d’acide acétique avec une mole d’alcool isoamylique, on obtient à l’équilibre, 0,67 mole d’acétate d’isoamyle. - Déterminer le quotient de réaction à l’état initial. - Déterminer les quantités de matière des différentes espèces présentes à l’équilibre. - En déduire la valeur de la constante d’équilibre K. Calculer le rendement de la réaction. - On recommence l’expérience en changeant les conditions initiales. - On part d’un mélange contenant 1 mole d’alcool isoamylique et de 5 moles d’acide acétique. - Déterminer les quantités de matière des différentes espèces présentes à l’équilibre. - Calculer le rendement de la réaction. |
►
Réponses :
- Tableau d’avancement de la réaction :
|
Équation
|
Acide
carboxylique |
+ |
Alcool |
=
|
Ester |
+ |
Eau |
|
États |
mol |
|
mol |
|
mol |
|
mol |
|
E.I |
1
|
|
1
|
|
0
|
|
0
|
|
E.F |
1
– xf |
|
1
– xf |
|
xf
= 0,67 |
|
xf
|
|
E.F |
0,33 |
|
0,33 |
|
0,67 |
|
0,67 |
- Valeur de la constante d’équilibre :
|
K = |
n ester . n eau |
0,67 x 0,67 |
|
|
|
≈ |
|
|
|
n acide . n alcool |
0,33 x 0,33 |
||
|
K ≈ |
4 |
||
- Rendement de la réaction :
|
τ = |
x f |
0,67 |
|
|
|
≈ |
|
|
|
x max |
1 |
||
|
τ ≈ |
67 % |
||
- Tableau d’avancement de la réaction.
|
Équation
|
Acide
carboxylique |
+
|
Alcool |
=
|
Ester |
+
|
Eau |
|
États |
mol |
|
mol |
|
mol |
|
mol |
|
E.I |
1
|
|
1
|
|
0
|
|
0
|
|
E.F |
5
– xf |
|
1
– xf |
|
xf
|
|
xf
|
- 
- Solutions : x’ = 7,1 et x’’ = 0,94.
- Or : 0 < xf < 1 , en conséquence, la bonne solution est : xf = 0,94 mol.
- Taux d’avancement de la réaction et rendement :
|
τ = |
x f |
||
|
|
|
|
|
|
x max |
|||
|
τ ≈ |
94 % |
||
- Lorsque l'on met un excès d'acide carboxylique le taux d'avancement de la réaction augmente.
- La réaction est déplacée dans le sens de l'estérification.
- le rendement est défini par rapport au réactif limitant.
- On peut améliorer le rendement d’une réaction limitée en ajoutant :
- Un excès de l’un des réactifs de la réaction,
- Ou en éliminant un des produits de la réaction.