|
|
Synthèse |
|
|
|
|
|
1)-
Exercice 04 page
148 : Recherche des pictogrammes de danger. 2)-
Exercice 06 page 148 :
Prélever un liquide. 3)-
Exercice 07 page 148 :
Calculer des quantités de réactifs. 4)-
Exercice 10 page 149 :
Associer un schéma à une étape. 5)-
Exercice 12 page 149 : Isoler
un produit solide. 6)-
Exercice 14 page 149 :
Connaître des techniques d’analyse. 7)-
Exercice 15 page 149 :
Proposer une technique d’analyse. 8)-
Exercice 16 page 150 :
Interpréter un chromatogramme. 9)-
Exercice 18 page 150 :
Calculer le rendement. 10)-
Exercice 21 page 151 : La
betterave sucrière. 11)-
Exercice 22 page 151 : Ester
à odeur de rhum. 12)-
DS 01 (20 min) : exercice 25
page 153 : Synthèse d’un solide. 13)-
DS 02 (30 min) : exercice 26
page 153 : Synthèse d’un liquide.
|
I-
Les étapes de la synthèse chimique.
►
Introduction.
-
Une synthèse est la
fabrication d’une espèce chimique au laboratoire.
-
Elle comprend en
général 4 étapes :

-
Dans certain cas, on
peut réaliser une étape de purification.
2)- Étape 1 : Prélèvement des réactifs.
►
Pour synthétiser un
composé organique, il faut choisir :
-
Les
réactifs appropriés
et leurs quantités (le plus souvent l’un des réactifs est introduit en excès, il
s’agit le plus souvent du moins cher)
|
-
Si le
réactif utilisé pour la synthèse est :
-
Un
solide : on pèse la masse m nécessaire ;
-
Un
soluté : on mesure un volume de solution Vsolution ;
-
Un
liquide : on pèse une masse m ou on mesure un volume V. |
-
Un
solvant adapté qui
permet de solubiliser les réactifs et de contrôler la température dans le milieu
réactionnel.
-
Un
catalyseur afin
d’accélérer la réaction.
-
Le
montage adapté à la
réaction.
-
Les paramètres
expérimentaux : température, pression, durée de la réaction, …
►
Remarques : Avant de
prélever les réactifs :
-
Il faut prendre en
compte les aspects liés à la sécurité.
-
Il faut connaître les
pictogrammes des espèces chimiques utilisées et produites.
-
Il faut appliquer les
consignes de sécurité relatives aux espèces chimiques utilisées.
-
Il faut aussi évaluer
le coût de la synthèse et l’impact sur l’environnement.
3)- Étape 2 : La transformation chimique.
a)-
La réaction chimique :
-
Le produit est formé
au cours de l’étape de la transformation chimique.
-
Certaines réactions
peuvent avoir lieu à froid, à la pression atmosphérique.
-
Parfois il faut
refroidir le milieu réactionnel, on peut aussi travailler sous pression réduite.
-
D’autres réactions
nécessitent un chauffage qui permet d’accélérer la réaction.
-
On peut aussi
chauffer et éliminer le produit obtenu au fur
et à mesure qu’il se forme.
-
Le plus souvent, le
chauffage du mélange réactionnel permet de dissoudre les réactifs solides et
d’augmenter le rendement de la réaction.
-
La technique utiliser
le plus souvent
est le
chauffage à reflux.
b)-
Le chauffage à reflux :
-
Le chauffage à reflux
permet de chauffer tout en évitant les pertes par évaporation.
-
Ce montage permet de
maintenir le milieu réactionnel à une température constante, en l'occurrence
pratiquement la température d'ébullition du solvant.
-
Les vapeurs sont
condensées dans le réfrigérant et retournent à l'état liquide dans le ballon.
-
Les réactifs et les
produits restent dans le milieu réactionnel.
-
Il permet d’accélérer
la réaction sans perte de matière.
► Exemple de montage lors de la synthèse de l’acide benzoïque :
a)-
Définition :
-
L’isolement consiste à
séparer au mieux le produit des réactifs n’ayant pas réagi, des produits
secondaires, du catalyseur, du solvant et des sous-produits dus à des réactions
parasites.
-
L’isolement conduit au
produit brut.
b)-
Les techniques employées :
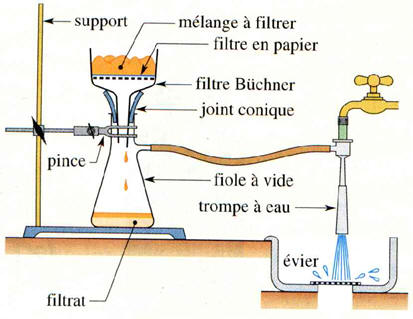
![]() La filtration sous
pression réduite :
La filtration sous
pression réduite :
-
Une fiole à vide munie
d’un entonnoir Büchner permet une filtration rapide et un essorage efficace sous
pression réduite.
-
Schéma :
![]() Extraction liquide
–liquide :
Extraction liquide
–liquide :
-
L’extraction liquide
–liquide permet de transférer sélectivement des espèces chimiques présentes dans
un solvant vers un autre solvant, non miscible au premier, dans lequel elles
sont plus solubles.
![]() extraction
du diiode présent dans une solution aqueuse : L’ampoule à décanter :
extraction
du diiode présent dans une solution aqueuse : L’ampoule à décanter :
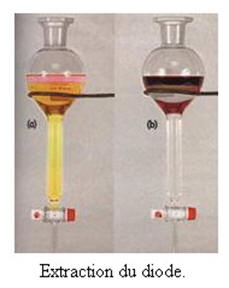
![]() Protocole
expérimental :
Protocole
expérimental :
-
Introduire le mélange
(solution aqueuse d’iodure de potassium et de diiode) dans l’ampoule à décanter
-
Puis
ajouter délicatement le solvant (hexane ou pentane : solvant organique : liquide
incolore moins dense que la solution aqueuse et non miscible)
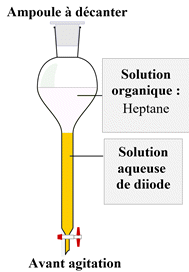
-
Agiter, laisser
décanter et dégazer.
-
On observe alors deux
phases :
-
La phase inférieure
qui est pratiquement décolorée et la phase supérieure qui contient le diiode
dans le solvant qui est violette.
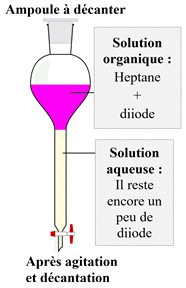
-
On dit que le diiode a
été extrait par le solvant.
-
On récupère la phase
contenant le diiode et le solvant.
-
Après séchage pour
éliminer l’eau de la phase organique (on peut utiliser un desséchant chimique
comme le sulfate de sodium anhydre Na2SO4),
-
Évaporation du solvant
(grâce à un évaporateur rotatif),
-
On recueille le diiode
(solide).
a)-
Utilité :
-
Elle permet
l’identification de l’espèce chimique obtenue et le contrôle de sa pureté.
-
Les étapes d’analyses
permettent de contrôler la pureté du produit synthétisé et de l’identifier à
partir de ses caractéristiques physiques.
b)-
Technique et matériel
utilisé :
-
Mesure de la
température de fusion pour les solides : Banc Kofler
-
Mesure de l’indice de
réfraction pour les liquides : Réfractomètre
-
Mesure de la
température d’ébullition : Thermomètre et colonne à distiller
-
Spectroscopie
IR et
RMN.
-
Chromatographie :
C.C.M.
a)-
Définition :
-
La purification
consiste à éliminer les faibles quantités d’impuretés, contenues dans le produit
brut afin d’obtenir le produit purifié.
-
Les deux méthodes
utilisées :
-
On utilise la
recristallisation
pour les solides et la distillation
pour les liquides.
b)-
La recristallisation :
-
La recristallisation
est une méthode de purification des solides fondée sur la différence de
solubilité du produit et des impuretés dans un solvant.
►
Exemple
recristallisation de l’acide acétylsalicylique obtenu par synthèse :
-
Le but de cette
manipulation est de purifier l’acide acétylsalicylique en utilisant la
différence de solubilité entre un corps et ses impuretés dans un solvant.
-
On dissout l’acide
acétylsalicylique impur à chaud dans un solvant approprié.
-
Lorsque la solution
refroidit, l’aspirine cristallise et les impuretés restent en solution.
![]() Manipulation.
Manipulation.
-
Dans un erlenmeyer
verser :
-
L’acide
acétylsalicylique impur (solide blanc) et 6 mL d’éthanol.
-
Chauffer au bain-marie
en agitant jusqu’à dissolution complète du solide.
-
Ajouter 15 mL d’eau
distillée à la température ambiante.
-
Laisser refroidir à
température ambiante, puis placer l’erlenmeyer dans un bain eau – glace.
-
Filtrer sur Büchner,
sécher et peser.
c)-
La distillation :
-
La distillation est
une méthode de purification des liquides fondée sur les différences de
température d’ébullition du produit et des impuretés.
►
La distillation
simple :
-
Une espèce chimique
volatile, non miscible à l’eau, peut être extraite par hydrodistillation.
-
Exemple : on extrait
par entraînement à la vapeur, l’huile essentielle des fleurs de lavande.
-
Dans l’entraînement à
la vapeur, l’ébullition du mélange d’eau et du produit crée un courant de
vapeurs.
-
Ce courant de vapeurs
est constitué de vapeurs d’eau et de vapeurs des huiles essentielles du produit.
-
On condense ce mélange
gazeux pour obtenir un distillat.
-
Ce
distillat est constitué d’eau à l’état liquide et des huiles essentielles à
l’état liquide.
-
Les
huiles essentielles étant peu miscibles avec l’eau et moins dense que l’eau,
elles surnagent.
-
Cette huile
essentielle est un mélange dont le principal constituant est l’acétate de
linalyle (ester peu soluble dans l’eau).
d)-
Distillation fractionnée :
|
(1)‑Chauffe-ballon. |
-
Elle permet de séparer
les espèces chimiques constituant un mélange liquide.
-
Le mélange à distiller
est placé dans un ballon surmonté d’une colonne à distiller :
-
Colonne de Vigreux.
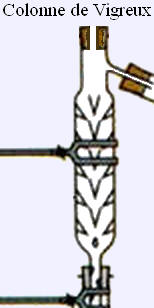
-
On chauffe le ballon
jusqu’à ébullition du mélange.
-
Les vapeurs des
différentes espèces chimiques montent dans la colonne à distiller.
-
La colonne à distiller
permet de séparer les différentes espèces chimiques.
-
En tête de colonne à
distiller, on trouve l’espèce chimique la plus volatile.
-
Les autres espèces
chimiques moins volatiles se condensent et retombent dans le ballon.
-
L’espèce chimique la
plus volatile est condensée grâce au réfrigérant.
-
On recueille le
distillat.
-
On appelle rendement,
noté η, de
la synthèse, le quotient de la quantité de produit
P effectivement
obtenue nP
par la quantité maximale attendue nmax :
-
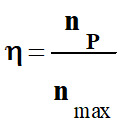
-
Si la synthèse du
produit demande plusieurs étapes, le rendement de la synthèse est égal au
produit des rendements de chaque étape.
2)- Les raisons d’un rendement faible :
-
La totalité du réactif
limitant n’a pas été consommée.
-
Le refroidissement n’a
pas permis à tout le solide de précipiter ;
-
Des pertes de produits
ont eu lieu lors des différentes manipulations ;
-
La réaction chimique
n’est pas totale,
-
Remarque :
-
Le rendement d’une
réaction est calculé par rapport au réactif limitant.
-
Dans le cas de la
réaction d’estérification, le fait de mettre l’un des réactifs en excès augmente
le rendement de la réaction.
1)- Synthèse d’un solide :
synthèse de l’acide benzoïque
2)- Synthèse d’un liquide :
synthèse de la propan-2-one.
Pour s'auto-évaluer
|
1)-
Exercice 04 page
148 : Recherche des pictogrammes de danger. 2)-
Exercice 06 page 148 :
Prélever un liquide. 3)-
Exercice 07 page 148 :
Calculer des quantités de réactifs. 4)-
Exercice 10 page 149 :
Associer un schéma à une étape. 5)-
Exercice 12 page 149 : Isoler
un produit solide. 6)-
Exercice 14 page 149 :
Connaître des techniques d’analyse. 7)-
Exercice 15 page 149 :
Proposer une technique d’analyse. 8)-
Exercice 16 page 150 :
Interpréter un chromatogramme. 9)-
Exercice 18 page 150 :
Calculer le rendement. 10)-
Exercice 21 page 151 : La
betterave sucrière. 11)-
Exercice 22 page 151 : Ester
à odeur de rhum. 12)-
DS 01 (20 min) : exercice 25
page 153 : Synthèse d’un solide. 13)-
DS 02 (30 min) : exercice 26
page 153 : Synthèse d’un liquide.
|