|
Chap. N° 09 |
Temps et évolution chimique : cinétique et catalyse. Cours. |
|
|
|
|
Exercices :
énoncé avec correction
a)-
Exercice 8 page 244 : Analyser des facteurs cinétiques. b)-
Exercice 9 page 244 : Repérer des facteurs cinétiques. c)-
Exercice 12 page 245 : Repérer des catalyseurs. d)-
Exercice 14 page 245 : Déterminer une durée de réaction et un temps de
demi-réaction. e)- Exercice 15 page 246 : De la concentration au temps de demi-réaction. f)-
Exercice 17 page 246 : Utilisation de la volumétrie. g)-
Exercice 18 page 247-247 : Exploitation de l’avancement. h)-
Exercice 25 page 250 : Suivi par spectrométrie. i)-
Exercice 26 page 251 : Saponification d’un ester : suivi par
conductimétrie. |
a)-
Définition :
- Une réaction chimique est rapide si sa durée est
inférieure à la seconde.
- On ne peut pas observer l’évolution de la réaction à
l’œil, elle semble achevée dès que les réactifs entrent en
contact.
- C’est le cas de certaines réactions de précipitation.
- La
formation du précipité se fait instantanément.
- C’est aussi le cas de quelques réactions
d’oxydo-réduction et des réactions acido-basiques.
b)-
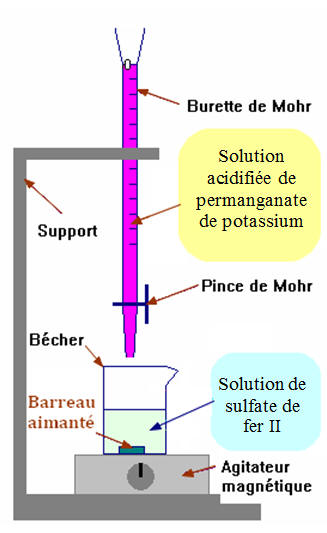
Expérience 1 : Réaction d’oxydo-réduction
|
dans un bécher contenant une solution
aqueuse acidifiée de sulfate de fer II. |
►
Observations :
- Il se produit une décoloration immédiate de la solution
de permanganate de potassium.
- La coloration violette de la solution de permanganate de
potassium est due à la présence des ions permanganate en
solution aqueuse.
- En présence des ions fer II en solution aqueuse, les ions
permanganate
MnO4 –
(aq) disparaissent instantanément.
- Il se produit une réaction d’oxydoréduction entre les
couples oxydant-réducteur suivants :
-
MnO4 –
(aq)
/ Mn
2+
(aq) et
Fe3+
(aq) /
Fe2+
(aq)
![]() Écrire
les demi-équations électroniques des couples
MnO4 –
(aq)
/ Mn2+
(aq) et
Fe3+
(aq) /
Fe2+
(aq).
Écrire
les demi-équations électroniques des couples
MnO4 –
(aq)
/ Mn2+
(aq) et
Fe3+
(aq) /
Fe2+
(aq).
![]() Écrire
l’équation de la réaction d’oxydoréduction entre les ions fer II
et les ions permanganate.
Écrire
l’équation de la réaction d’oxydoréduction entre les ions fer II
et les ions permanganate.
- Demi-équation électronique du couple
MnO4 –
(aq)
/ Mn2+
(aq)
- Conservation de l’élément manganèse :
|
MnO4
– (aq)
= Mn2+ (aq) |
- Conservation de
l’élément oxygène : on équilibre l’oxygène avec de l’eau :
|
MnO4
– (aq)
= Mn2+ (aq) + 4
H
2O
(ℓ) |
- Conservation de l’élément hydrogène : on équilibre
l’hydrogène avec H+
(aq) en milieu acide :
|
MnO4
– (aq) +
8 H
+(aq) =
Mn2+ (aq) +
4 H
2O
(ℓ) |
- Conservation de la charge : on équilibre la charge avec
les électrons :
|
MnO4
– (aq) +
8 H
+(aq) +
5 e
– =
Mn2+ (aq) +
4 H
2O
(ℓ) |
- Demi-équation électronique du couple :
Fe
3+
(aq) /
Fe
2+
(aq) :
|
Fe2+ (aq)
= Fe3+ (aq) +
e
– |
-
équation
de la réaction :
|
(
MnO4
– (aq) +
8 H+(aq) +
5
e
– =
Mn2+ (aq) +
4 H2O
(ℓ)
)
x
1 |
|
(
Fe2+
(aq)
=
Fe3+
(aq)
+
e
–
)
x
5 |
|
MnO4
– (aq)
+ 8
H+(aq)
+ 5 Fe2+
(aq)
→ Mn2+ (aq)
+ 4 H2O
(ℓ)
+ 5 Fe3+
(aq) |
c)- Expérience 2 : Réaction de précipitation.
![]() On verse quelques gouttes de soude dans un tube à
essais contenant une solution aqueuse de chlorure de fer III
On verse quelques gouttes de soude dans un tube à
essais contenant une solution aqueuse de chlorure de fer III
|
Fe(OH)3
(s) Précipité
rouille |
- Il se forme un précipité jaune orangé d’hydroxyde de fer III.
- La formation du précipité est immédiate.
- C’est une réaction rapide.
- Équation de la réaction de précipitation :
|
Fe3+
(aq) + 3 HO
– (aq)
→
Fe(OH)3 (s) |
a)-
Définition :
- Une réaction est lente si sa durée est de l'ordre de
quelques secondes à plusieurs minutes.
- On peut observer l'évolution de la réaction.
b)-
Expérience 1 : Oxydation des ions iodure par de peroxyde
d’hydrogène en milieu acide
|
On verse un volume V3 = 100 mL d’une solution d’iodure de potassium de concentration C3 = 0,20 mol / L et un volume V1 = 100 mL d’une solution d’eau oxygénée de concentration C1 = 5,6 x 10-2 mol / L dans un erlenmeyer de 250 mL. |
- On ajoute quelques gouttes d’acide sulfurique concentré.
- Le peroxyde d’oxygène est de l’eau oxygénée, c’est
l’oxydant du couple : H2O2
(aq) /
H2O
(ℓ)
► Observations :
- Au cours du temps, la solution contenue dans le bécher
prend une teinte brun orangé de plus en plus intense.
- On peut observer l’évolution de la transformation grâce
au changement de teinte de la solution.
- Le changement de teinte est dû à la formation de diiode
en milieu aqueux (pour simplifier).
- Autre couple qui intervient :
I2
(aq) /
I
– (aq)
►
Interprétation :
- Il se produit une
réaction d’oxydoréduction entre les ions iodure et l’eau
oxygénée en milieu acide.
- Cette
transformation est lente par rapport à l’échelle humaine.
![]() Écrire
l’équation de la réaction chimique.
Écrire
l’équation de la réaction chimique.
|
(
H2O2
(aq)
+ 2
H+(aq)
+ 2
e
–
=
2 H2O
(ℓ)
)
x
1 |
|
(
2 I
–
(aq)
=
I2 (aq)
+ 2
e
–
)
x
1 |
|
H2
O2
(aq)
+ 2
H+(aq)
+ 2
I–
(aq)
→ 2
H2O
(ℓ)
+ I2 (aq) |
c)-
Expérience 2 : Dismutation de l’ion thiosulfate en milieu
acide
|
-
45 mL de thiosulfate de sodium de concentration C1
= 0,13 mol / L, - 5 mL de solution d’acide chlorhydrique de concentration
C2 = 0,10 mol / L. |
►
Observation :
- on observe
la formation d’un précipité qui trouble peu à peu la solution.
- La transformation est lente, on peut observer son
évolution.
►
Interprétation :
- Le précipité
obtenu est un précipité jaune de soufre.
- Couples mis en jeu :
S2O32
–
(aq)
/
S
(s) et
SO2
(aq) /
S2
O32
–
(aq)
![]() Écrire
l’équation de la réaction de dismutation.
Écrire
l’équation de la réaction de dismutation.
- On dit que l’ion thiosulfate se dismute car il apparaît
dans deux couples différents en tant que réducteur dans un
couple et oxydant dans l’autre couple.
|
(
S2O32
–
(aq)
+ 6
H+(aq)
+ 4
e
–
= 2 S
+ 3
H2O
(ℓ)
)
x
1 |
|
(
S2O32
–
(aq)
+
H2O
(ℓ)
= 2
SO2
(aq)
+
2 H+(aq)
+ 4
e
–
)
x
1 |
|
2 S2O3
2
–
(aq)
+ 4
H+(aq)
→ 2 S (s)
+ 2 SO2
(aq)
+ 2 H2O
(ℓ) |
- La réaction de
dismutation de l’ion thiosulfate en milieu acide est une
transformation lente.
- Une réaction est infiniment lente si sa durée est de
l'ordre de plusieurs jours à plusieurs semaines.
- On ne peut pas observer l’évolution de la réaction à
l’œil.
- On dit que le système constitué par les réactifs est
cinétiquement inerte.
- L’étude de l’évolution temporelle de systèmes chimiques
constitue la cinétique chimique.
- Certains paramètres agissent sur la rapidité d’évolution
d’un système chimique.
- Ces paramètres sont appelés : les facteurs cinétiques de
la réaction.
II-
Facteurs cinétiques d’une réaction chimique.
1)- Influence de la concentration
des réactifs.
a)-
Expérience : Dismutation de l’ion thiosulfate en milieu
acide
►
Principe :
- On utilise la réaction précédente.
- En milieu acide, l’ion thiosulfate réagit lentement avec
les ions hydrogène et donne un précipité de soufre qui reste en
suspension.
- La solution devient peu à peu opaque.
- On utilise ce
phénomène pour évaluer la vitesse moyenne de formation de
soufre.
- On place, avant le début de l’expérience, sous le bécher, une feuille de papier portant une croix à l’encre noire.
- On
déclenche le chronomètre au moment où l’on mélange la solution
de thiosulfate de sodium et l’acide chlorhydrique.
- On note la durée nécessaire
Δt
pour que la croix ne soit plus visible.
- Pour que l’épaisseur à travers laquelle on observe la
croix soit toujours la même, on utilise des béchers identiques
et des volumes de solutions identiques.
- On admet que la quantité de matière
nd
de soufre nécessaire à la disparition du motif est la
même dans toutes les expériences.
![]() Influence de la concentration de la solution en
ions thiosulfate.
Influence de la concentration de la solution en
ions thiosulfate.
- Dans un bécher de 100 mL, on verse :
- 45 mL de thiosulfate de sodium de concentration
C1.
- 5 mL de solution d’acide chlorhydrique de concentration
C2
=
0,10 mol / L.
- tableau :
|
C1
(mol
/ L) |
0,13 |
0,26 |
0,39 |
|
Δt
(s) |
108 |
72 |
35 |
![]() Influence de la concentration de la solution
d’acide chlorhydrique.
Influence de la concentration de la solution
d’acide chlorhydrique.
- Dans un bécher de 100 mL, on verse :
- 45 mL de thiosulfate de sodium de concentration
C1 = 0,13
mol / L,
- 5 mL de solution d’acide chlorhydrique de concentration
C2
.
- tableau :
|
C1
(mol
/ L) |
0,10 |
0,20 |
0,30 |
|
Δt
(s) |
1 min 30 s |
45 s |
22 s |
b)-
Conclusion :
- De façon générale,
- L’évolution d’un système chimique est d’autant plus
rapide que les concentrations des réactifs sont élevées.
- Ce résultat peut s’interpréter à l’échelle microscopique.
►
Interprétation dans le cas des solutions
aqueuses :
- Une réaction chimique a lieu entre les espèces chimiques
A et
B si après rencontre
dans un solvant, il se forme les espèces chimiques
C et
D.
- Au cours de la réaction chimique des liaisons chimiques
ont été rompues et de nouvelles liaisons chimiques se sont
formées.
- Pour que la réaction chimique ait lieu entre les espèces
chimiques A et
B, il faut deux conditions :
- Il faut que les deux espèces chimiques
A et
B se
rencontrent,
- Il faut que le choc entre les deux espèces chimiques soit
efficace.
-
Les deux espèces
chimiques peuvent se rencontrer et entrer en collision, mais si
l’énergie n’est pas suffisante, il ne se passe rien.
- Si l’énergie est suffisante, il y a rupture de certaines
liaisons chimiques et les espèces chimiques
A et
B donnent les
espèces chimiques C
et D.
- En conséquence, plus la concentration des réactifs est
grande, plus la probabilité de rencontre est grande et plus la
transformation est rapide.
►
Interprétation dans le cas des solides :
- La réaction est d’autant plus rapide que la surface de
contact entre les réactifs est importante.
- Pour faire réagir le soufre et le fer, on prend du fer et
du soufre en poudre.
- On les mélange intimement et pour amorcer la réaction, on crée un point chaud.
- Il faut initier la réaction chimique.
- Le facteur cinétique essentiel pour un réactif solide est
l’étendue de sa surface de contact avec les autres réactifs.
- La réaction est d’autant plus rapide que la surface de
contact est grande.
2)- Influence de la température.
a)-
Expérience : Oxydation des ions iodure par l’eau
oxygénée.
- On observe l’évolution de la coloration de la solution au
cours du temps à différentes températures.
- Tableau :
|
Béchers 1 |
Béchers 2 |
Béchers 3 |
|
5 mL d’iodure de potassium 0,10 mol / L |
5 mL d’iodure de potassium 0,10 mol / L |
5 mL d’iodure de potassium 0,10 mol / L |
|
5 mL d’acide sulfurique 1 mol / L |
5 mL d’acide sulfurique 1 mol / L |
5 mL d’acide sulfurique 1 mol / L |
|
9 mL d’eau |
9 mL d’eau |
9 mL d’eau |
|
+ glace θ
= 0 ° C |
θ = 20 ° C (température ambiante) |
θ = 40 ° C |
- La température d’un mélange réactionnel est un facteur
cinétique.
- De façon générale,
- L’évolution d’un système chimique est d’autant plus
rapide que la température du mélange réactionnel est élevée.
- Ce résultat peut s’interpréter à l’échelle microscopique.
- Plus la température est élevée, plus l’énergie cinétique
des espèces chimiques sera importante.
- Il découle de ceci que le nombre de chocs efficaces entre
les espèces chimiques augmente avec la température.
- Une augmentation de la température permet à la
transformation chimique de se produire plus vite.
3)- Utilisation des facteurs
cinétiques.
a)-
Accélération et déclenchement d’une réaction chimique.
- Certaines réactions, trop lentes à température ambiante,
sont réalisées à température plus élevée, ainsi elles deviennent
plus rapides.
- Pour accélérer la cuisson des aliments, on utilise des
autocuiseurs.
- En augmentant la température, on diminue le temps de
cuisson des aliments.
- Les mélanges comburant-combustible sont en général cinétiquement inertes à température ambiante :
- Pour initier la réaction, on utilise une allumette ou une étincelle entre les deux électrodes d’une bougie de moteur.
- C’est le point chaud qui
déclenche la combustion.
b)-
Ralentissement ou arrêt d’une réaction chimique.
- La trempe :
- Elle désigne le refroidissement brutal d’un milieu
réactionnel pour le rendre cinétiquement inerte.
- On utilise ce procédé lors de dosages en séances de
travaux pratiques pour arrêter la réaction à un instant donné
t.
- D’autre part, pour ralentir les réactions indésirables,
on place les aliments au réfrigérateur ou au congélateur.
4)- Autres facteurs cinétiques.
►
L’éclairement :
- Pour accélérer certaines réactions, on peut utiliser
l’énergie lumineuse.
- L’éclairement d’un milieu réactionnel avec une radiation
de longueur d’onde appropriée peut accélérer une réaction
chimique.
- Exemple : la synthèse chlorophyllienne
- Les végétaux, grâce à leur chlorophylle et grâce à
l’énergie solaire, transforment le dioxyde de carbone
CO2
atmosphérique en molécules organiques, le glucose :
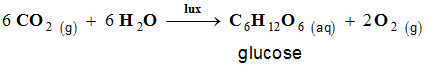
- E =
h .
υ
- C’est la synthèse chlorophyllienne.
►
Le solvant :
- Le solvant peut être un facteur cinétique.
- Ainsi, certaines réactions chimiques sont plus rapides
dans l’eau que dans l’éthanol.
-
Exemple :
|
(CH3)3
COH |
+ Cl– |
→ |
(CH3)3
CCl |
+ HO– |
|
2-méthylpropan-2-ol |
Ion chlorure |
|
2-chloro-2-méthylpropane |
Ion hydroxyde |
►
Les catalyseurs :
- Dans certaines réactions, la présence en faible quantité,
d’une substance chimique spécifique, différente des réactifs,
peut accélérer l’évolution du système chimique.
- De telles substances sont appelées catalyseurs.
1)- Expérience : La dismutation de
l’eau oxygénée
a)-
Étude de la solution d’eau oxygénée.
![]() Eau oxygénée à 20 volumes :
Eau oxygénée à 20 volumes :
- Le peroxyde d’hydrogène présent dans l’eau oxygénée n’est
pas stable.
- Il est impliqué dans deux couples oxydant / réducteur :
- Couple 1 :
H2O2
(aq) /
H2O (ℓ)
- Couple 2 :
O 2
(g) /
H2O 2
(aq)
- On peut envisager une réaction entre
H2O2
(aq)
, oxydant du
couple 1 et
H2O2
(aq) , réducteur du couple 2 :
-
Cette réaction est appelée réaction de
dismutation.
|
Dismutation |
Réaction d'oxydoréduction au cours de laquelle une espèce chimique joue à la fois le rôle d'oxydant et de réducteur (ici l'eau oxygénée H2O2 (aq))
H2O2 (aq) /
H2O |
- La transformation associée est spontanée mais très lente
à la température ordinaire.
2
H2O2
(aq) =
O2
(g) + 2
H2O
(ℓ)
- Cette réaction est très lente.
- Si l’on verse de l’eau oxygénée dans un bécher, il n’est
pas possible d’observer un dégagement de dioxygène.
b)-
Étude de la solution d’eau oxygénée en présence, d’ions
fer II, ions fer III et de platine.
![]() Bécher
A : eau oxygénée seule.
Bécher
A : eau oxygénée seule.
![]() Bécher
B : eau oxygénée + solution aqueuse
de sulfate de fer II
Bécher
B : eau oxygénée + solution aqueuse
de sulfate de fer II
![]() Bécher
C : eau oxygénée + solution de
chlorure de fer III
Bécher
C : eau oxygénée + solution de
chlorure de fer III
![]() Bécher
D : eau oxygénée + fil de platine
Bécher
D : eau oxygénée + fil de platine
►
Observations :
- Dans le bécher
A, pas d’évolution visible.
- Dans les autres béchers, on observe un dégagement intense
de dioxygène.
►
Conclusion
- Les ions fer
II, les ions fer III et le platine accélèrent
la réaction de dismutation du peroxyde d’hydrogène.
- Ce sont des catalyseurs de la réaction de dismutation du
peroxyde d’hydrogène.
c)-
Mode d’action d’un catalyseur. La dismutation de l’eau
oxygénée en présence d’ions fer III.
- Grâce à la présence du catalyseur, on remplace une étape
lente par deux étapes rapides.
- Étape 1 : réaction entre l’eau oxygénée est les ions fer
III. Réaction rapide :
|
|
H2O2
(aq) |
+ |
|
|
= |
O2 (g) |
+ |
2
H+ (aq) |
+ |
2
e
- |
|
|
2 ( |
Fe3+ (aq) |
+ |
e
- |
|
= |
Fe
2+
(aq) |
) |
|
|
|
|
|
|
H2O2
(aq) |
+ |
2
Fe3+ (aq) |
|
→ |
2 Fe2+
(aq) |
+ |
O2
(g) |
+ |
2
H+
(aq) |
(1) |
-
étape
2 : réaction entre l’eau oxygénée et les ions fer II.
|
|
H2O2
(aq) |
+ |
2 H+ (aq) |
+ 2 e
- |
= |
2 H2O
(ℓ) |
|
|
|
|
|
|
|
|
2 ( |
Fe2+ (aq) |
|
= |
Fe3+ (aq) |
+ |
e
- |
) |
|
|
|
|
H2O2
(aq) |
+ |
2 Fe2+ (aq) |
+ 2 H+ (aq) |
→ |
2 Fe3+ (aq) |
+ |
2 H2O
(ℓ) |
(2) |
||
- Bilan global de la réaction : Il faut combiner (1) et
(2).
|
|
H2O2 (aq) |
+ |
2
Fe3+ (aq) |
|
|
2 Fe2+ (aq) |
+ |
O2 (g) |
+ |
2 H+ (aq) |
(1) |
|
|
H2O2
(aq) |
+ |
2
Fe2+ (aq) |
+ 2 H
+ (aq) |
→ |
2 Fe3+ (aq) |
+ |
2 H2O (ℓ) |
|
|
(2) |
|
|
H2O2
(aq) + H2O2
(aq) |
→ |
O2
(g) |
+ |
2 H2O
(ℓ) |
|
|
||||
-
Le catalyseur d’apparaît pas dans le bilan de la
réaction.
2)- Caractéristiques d’un
catalyseur.
- Un catalyseur est une espèce chimique qui accélère une
réaction chimique.
- La formule du catalyseur n’apparaît pas dans l’équation
de la réaction.
- Un catalyseur modifie la nature des étapes permettant de
passer des réactifs aux produits.
- La réaction globale lente est remplacée par plusieurs
réactions rapides.
►
Catalyse homogène :
- La catalyse est dite homogène lorsque le catalyseur et le mélange réactionnel constituent une seule phase (forment un mélange homogène).
- C’est le cas des gaz et des liquides
miscibles.
- Exemples :
- Dismutation de l’eau oxygénée en présence
d’ions fer II ou d’ions fer III.
►
Catalyse hétérogène :
- La catalyse est dite hétérogène lorsque le catalyseur et
le milieu réactionnel se trouvent dans des phases différentes.
- Exemples :
- Expérience de la lampe sans flamme (on utilise un fil de
cuivre chauffé comme catalyseur)
|
|
|
Cu |
|
|
|
C2H5OH |
+ O2 |
→ |
CH3CHO |
+ 2 H2O |
- Dismutation de l’eau oxygénée catalysée par un fil de
platine.
|
|
|
Pt |
|
|
|
H2O2
(aq)
|
+
H2O2 (aq) |
→ |
O2 (g) |
+
2 H2O
(ℓ) |
►
Catalyse enzymatique :
- La catalyse est enzymatique lorsque le catalyseur est une
enzyme.
- Les enzymes sont des catalyseurs biologiques qui
permettent aux transformations chimiques nécessaires à la vie de
s’effectuer à vitesse élevée.
- Exemple :
- L’hydrolyse de l’amidon au laboratoire : il
faut travailler à température élevée et en milieu fortement
acide.
- Un catalyseur est sélectif si, à partir d’un système
initial susceptible d’évoluer selon plusieurs réactions
spontanées, il accélère préférentiellement l’une d’elles.
- Exemple : réactions avec l’éthanol :
- Déshydratation de l’éthanol :
|
|
|
Al2O3 |
|
|
|
CH3 – CH2OH |
|
→ |
CH2 = CH2 |
+ H2O |
|
Éthanol |
|
400 ° C |
Éthène |
|
- Déshydrogénation de l’éthanol :
|
|
|
Cu |
|
|
|
CH3 – CH2OH |
|
→ |
CH3 – CHO |
+ H2 |
|
Éthanol |
|
280 ° C |
Éthanal |
|
- Un catalyseur est spécifique à une réaction chimique.
- Un catalyseur permet d’éviter certaines réactions
parasites.
- Il permet de travailler dans des conditions de
température et de pressions plus faibles.
- Il peut permettre de diminuer les coûts de production.
- Les réactions se produisant dans les organismes vivants ou réactions biochimiques sont souvent catalysées par des macromolécules :
- Les enzymes.
- Les enzymes sont des protéines.
- Le nom d’une enzyme indique souvent la transformation
mise en jeu :
- L’amylase transforme l’amidon en maltose.
- La saccharase catalyse l’hydrolyse du saccharose en
glucose et fructose.
- Les réductases catalysent les réductions des groupes
carbonyles, acides et esters.
- Les enzymes sont très utilisées dans l’industrie
agroalimentaire :
- Fabrication du pain, préparation de boissons fermentées,
conservation des aliments, …
IV-
Le suivi de l’évolution d’un système.
a)-
Principe.
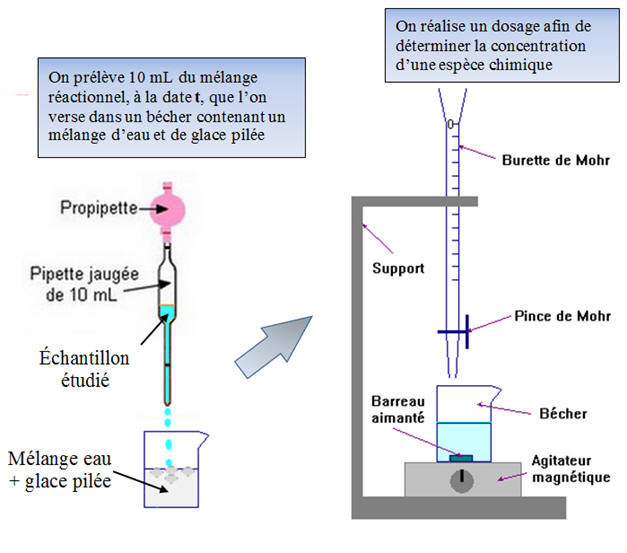
- L’analyse est réalisée sur des échantillons prélevés au milieu réactionnel en évolution.
- On effectue des prélèvements
(10 mL) dont le volume est faible devant celui du milieu
réactionnel (200 mL).
- L’échantillon prélevé est plongé dans de l’eau glacée à
la date t.
- On réalise la trempe de l’échantillon.
- Ceci permet de bloquer la réaction afin d’éviter
l’évolution du système.
- On réalise un dosage afin de déterminer la concentration d’une espèce chimique (réactif ou produit).
-
Chap. N° 18 Contrôle de qualité par dosage.
- Le choix de la réaction de dosage est très important.
- Elle doit être rapide, unique et elle doit pouvoir facilement
mettre en évidence l’équivalence du dosage.
b)-
Schéma du dispositif :
a)-
Principe
- L’avancement du système est déterminé à partir de la
mesure d’une grandeur physique :
- L’absorbance, la conductivité électrique, la pression, le
volume, …
b)-
Mesure de l’absorbance ou spectrophotométrie.
- On utilise le fait que toute solution colorée absorbe la
lumière visible (400 nm < λ < 800 nm).
- Lorsqu’un faisceau de lumière monochromatique traverse un
milieu absorbant, l’intensité lumineuse
I du faisceau
transmis est inférieure à l’intensité lumineuse
I0 du
faisceau incident.
- Pour évaluer cette diminution, on utilise :
- La transmittance
T :
![]()
- L’absorbance
A :
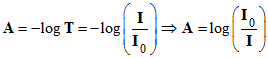
- La transmittance s’exprime en pourcentage.
- À une transmittance
T de 100 % (T = 1)
correspond une absorbance nulle :
A = 0.
- À une
transmittance de 1 % (T = 0,01) correspond une absorbance
A =log 100 = 2.
- Exemple de réaction :
- On peut utiliser cette méthode lorsqu’une espèce colorée
se forme ou disparaît au cours de la réaction.
- Réaction entre l’eau oxygénée et les ions iodure : il se
forme du diiode qui est une espèce chimique colorée.
- On réalise le mélange réactionnel et on déclenche
simultanément le chronomètre.
- On introduit le mélange dans la cuve du spectromètre et
on démarre l’acquisition des données.
- On relève la valeur A de l’absorbance et celle du temps t correspondant.
- L’acquisition peut être assistée par ordinateur.
- L’application de la loi de
Beer-Lambert permet de
déterminer la valeur de la concentration de l’espèce colorée est
d’en déduire l’avancement de la réaction.
c)-
Mesure de la conductivité ou conductimétrie.
- On mesure la conductance du milieu réactionnel en
fonction du temps à l’aide d’un conductimètre
- Hydrolyse du 2-chloro-2-méthylpropane : (CH3)3
CCl ou
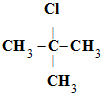
- Équation de la réaction :
|
(CH3)3
Cl |
+ H2O |
→ |
(CH3)3
OH |
+ Cl–
(aq) |
+ H+ (aq) |
|
2-chloro-2-méthylpropane |
|
|
2-méthylpropan-2-ol |
|
|
- La réaction produit des ions
H+ (aq) et
Cl– (aq) qui augmentent la conductivité du
milieu réactionnel.
- L’évolution du système peut être suivie par
conductimétrie.
d)-
Mesure de la pression ou manométrie.
- Lorsque la réaction consomme ou produit un gaz, la
pression du système, liée à la quantité de ces espèces gazeuses
varie.
- La mesure de la pression permet de déterminer la
composition du système et son avancement
x.
- Une solution d’acide acétique, de formule CH3COOH (aq), réagit avec le carbonate de calcium (calcaire) CaCO3 (s).
- L’un des produits formés est gazeux (dioxyde de carbone).
- La température et le volume étant connus, la mesure de la
pression de ce gaz permet de déterminer la quantité de matière
correspondante.
|
Équation de la
réaction :
2 CH3COOH
(aq) + CaCO3
(s)
→
2
CH3COO
–
(aq) + Ca2+
(aq) + (CO2,
H2O)
|

- La durée d’une réaction chimique est le temps tf
nécessaire à la consommation totale du réactif limitant.
- Pour
t =
tf, l’avancement
x
atteint la valeur maximale xmax.
- Le temps de demi-réaction, noté
t1/2, est
la durée nécessaire à la disparition de la moitié du réactif
limitant.
- Pour
t =
t1/2,
l’avancement, noté x1/2,
a atteint la moitié de sa valeur maximale
xmax.
- Le temps de demi-réaction fournit une échelle des temps
caractéristique du système étudié.
- L’expérience montre qu’un système siège d’une réaction
caractérisée par le temps de réaction
t1/2
cesse pratiquement d’évoluer au bout d’une durée de l’ordre de
quelques t
1/2 (4 à 7 suivant la précision recherchée).
- Le temps de demi-réaction permet d’évaluer la durée
nécessaire à l’achèvement de la transformation chimique étudiée.
►
Application :
- L’oxydation des ions iodure par le peroxyde d’hydrogène
est étudiée par dosage :
- L’équation de la réaction chimique est la suivante :
|
|
H2O2
(aq) |
+ |
2
I–
(aq) |
|
+ 2
H+
(aq) |
|
→ |
|
|
I2
(aq) |
+ |
2
H2O
(ℓ) |
|
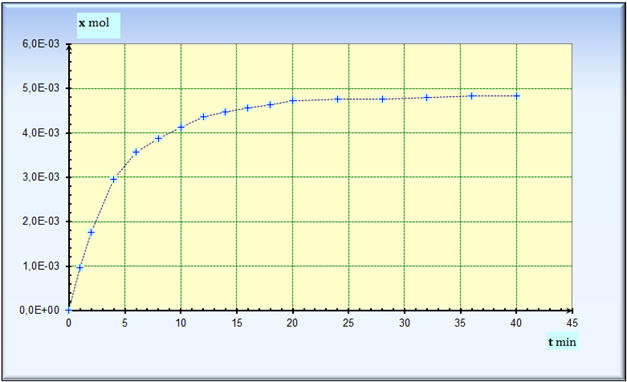
- On donne la courbe expérimentale représentant les valeurs
de l’avancement x de la réaction en fonction du temps
t.
- Tableau de valeurs :
|
t
min |
x
(t) |
|
0 |
0,0E+00 |
|
1 |
9,6E-04 |
|
2 |
1,8E-03 |
|
4 |
3,0E-03 |
|
6 |
3,6E-03 |
|
8 |
3,9E-03 |
|
10 |
4,1E-03 |
|
12 |
4,4E-03 |
|
14 |
4,5E-03 |
|
16 |
4,6E-03 |
|
18 |
4,6E-03 |
|
20 |
4,7E-03 |
|
24 |
4,8E-03 |
|
28 |
4,8E-03 |
|
32 |
4,8E-03 |
|
36 |
4,8E-03 |
|
40 |
4,8E-03 |
![]() Déterminer
la valeur de l’avancement maximal
xmax, le
temps de demi-réaction t1/2
et la durée de réaction
tf.
Déterminer
la valeur de l’avancement maximal
xmax, le
temps de demi-réaction t1/2
et la durée de réaction
tf.
- Exploitation graphique :
- Avancement maximal :
xmax ≈ 4,8
× 10–3 mol
- Temps de demi-réaction :
t1/2 ≈
4 min
- Durée de réaction :
tf
≈
28 min
2)- Exercices :
a)- Exercice 8 page 244 : Analyser des facteurs cinétiques.
b)- Exercice 9 page 244 : Repérer des facteurs cinétiques.
c)- Exercice 12 page 245 : Repérer des catalyseurs.
d)- Exercice 14 page 245 : Déterminer une durée de réaction
et un temps de demi-réaction.
e)- Exercice 15 page 246 : De la concentration au temps de
demi-réaction.
f)- Exercice 17 page 246 : Utilisation de la volumétrie.
g)- Exercice 18 page 247-247 : Exploitation de l’avancement.
h)- Exercice 25 page 250 : Suivi par spectrométrie.
i)- Exercice 26 page 251 : Saponification d’un ester : suivi
par conductimétrie.
|
|