|
|
Synthèse organiques Exercices |
|
|
|
|
|
|
1)- Exercice 04 page 202 : Représenter des formules topologiques :
|
Représenter des formules topologiques : Représenter les formules topologiques correspondant aux formules
semi-développées ci-dessous :
|
|
Représenter des formules topologiques : Formules topologiques correspondant aux formules semi-développées
ci-dessous :
|
2)- Exercice 06 page 202 :Reconnaître un groupe caractéristique :
|
Reconnaître un groupe caractéristique : 1. Repérer les groupes caractéristiques présents dans chaque molécule dont les formules sont données ci-dessous. Associer à chacun d’eux une
famille fonctionnelle. 2.
Pour chaque molécule, indiquer si son
squelette carboné est saturé ou non.
|
|
Reconnaître un groupe caractéristique : 1.
Les groupes caractéristiques présents dans
chaque molécule.
2.
Squelette carboné est saturé ou non.
|
3)- Exercice 08 page 203 : Justifier des noms :
|
Justifier des noms : On donne ci-dessous les formules topologiques de deux molécules
et le nom des espèces associées.
|
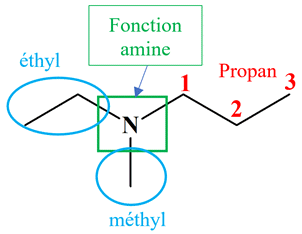
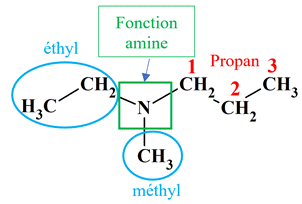
Justifier des noms. a
Ou
On
est en présence d’une amine substituée.
Les préfixes
éthyl et méthyl
sont précédés de la lettre N
et
placés dans l’ordre alphabétique
La
racine :
propan
(chaîne carbonée la plus longue)
Le
suffixe :
amine
(sur la carbone numéro 1)
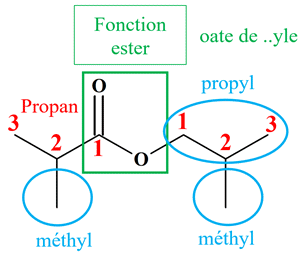
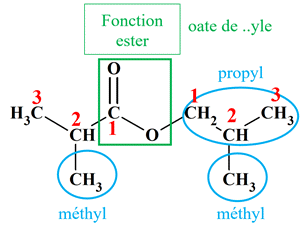
b
Ou
On
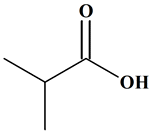
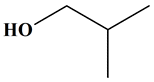
est en présence d’un ester qui découle :
-
De l’acide
2-méthylpropanoïque
-
De l’alcool :
2-méthylpropan-1-ol
Méthylpropanoate
de
2-méthylpropyle
2-méthylpropanoate
de
2-méthylpropyle
![]()
4)- Exercice 10 page 203 : Identifier des isomères de constitution :
|
Identifier des isomères de constitution :
|
Identifier des isomères de constitution : Molécules isomères :
-
Deux isomères de constitution sont
des molécules qui ont la même formule brute mais qui différent par la
nature ou l'ordre des liaisons qui relient les atomes entre eux.
-
Ils n'ont pas la même formule
développée ou semi-développée plane. a
C5H10O
Pentan-2-one
C5H12O
1-éthoxypropane
Ce ne sont pas
des molécules isomères.
Elles
n'ont pas la même formule brute.
b
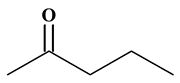
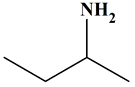
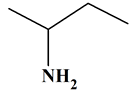
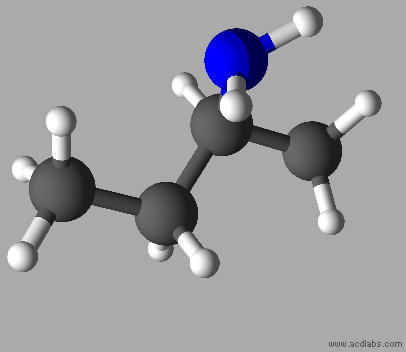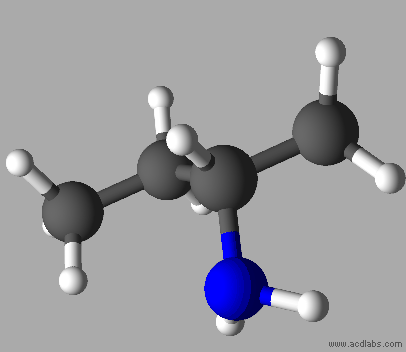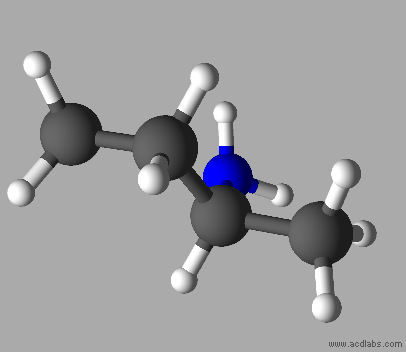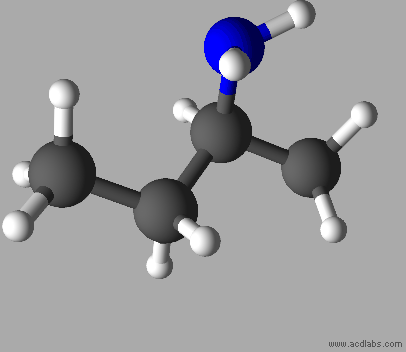
C4H11N
Butan-2-amine
C4H11N
Butan-2-amine
Ce ne
sont pas des molécules isomères.
Les
deux molécules sont identiques.
Elles
sont représentées dans des positions différentes
c
Butan-2-ol
C4H10O
2-méthoxypropane
C4H10O
Ce
sont des molécules isomères de constitution
Les
deux molécules ont la même formule brute.
Elles
ont des formules semi-développées différentes.
(Isomérie de fonction)
![]()
![]()
5)- Exercice 12 page 203 : Optimiser un rendement et une vitesse :
|
Optimiser un rendement et une vitesse : On synthétise l’espèce C
grâce à une transformation lente modélisée par deux réactions
opposée : L’équation s’écrit : A (ℓ) + B (ℓ) La constante d’équilibre associée à l’équation est
notée K 1.
Proposer deux opérations permettant
d’augmenter la vitesse de formation de l’espèce
C. 2.
Proposer deux méthodes d’optimisation du
rendement de cette synthèse. Justifier. |
|
Optimiser un rendement et une vitesse : A (ℓ) + B (ℓ)
La constante d’équilibre associée à l’équation est
notée K 1.
Les deux opérations permettant d’augmenter
la vitesse de formation de l’espèce C.
►
Les facteurs cinétiques d’une
réaction chimique :
-
De façon générale,
-
l’évolution d’un système chimique est
d’autant plus rapide que la température du mélange réactionnel est
élevée ;
-
l’évolution d’un système chimique est
d’autant plus rapide que les concentrations des réactifs sont
élevées.
►
Le catalyseur : - Dans certaines réactions, la présence en faible quantité, d’une substance chimique spécifique, différente des réactifs,
peut accélérer l’évolution du système chimique.
►
Pour augmenter la vitesse de de
formation de l’espèce C :
-
On augmente la température du mélange
réactionnel (chauffage à reflux).
-
On utilise un catalyseur. 2.
Les deux méthodes d’optimisation du
rendement de cette synthèse.
►
Le rendement d’une réaction
chimique : - On appelle rendement, noté η, de la synthèse, le quotient de la quantité de produit P effectivement obtenue nP
par la quantité maximale
attendue nmax :
-
- Si la synthèse du produit demande plusieurs étapes, le rendement de la synthèse
est égal au produit
des rendements de chaque étape.
-
Le rendement est défini par rapport
au réactif limitant.
►
Augmentation du rendement d’une
réaction chimique :
-
On peut améliorer le rendement d’une
réaction limitée en ajoutant :
-
Un excès de l’un des réactifs de la
réaction (le moins cher),
-
Ou en éliminant un des produits de la
réaction (distillation fractionnée : lorsque cela est possible).
►
Déplacement d’équilibre : élimination
d’un des produits
-
Quotient de réaction :
-
-
Au départ, on part des réactifs
A
(ℓ) et B (ℓ) : [C]i
= [D]i = 0 mol . L–1
-
Qr,i = 0
-
Équation de la réaction :
-
Qr,i <
K, la réaction évolue
dans le sens direct jusqu’à atteindre l’équilibre chimique :
-
Alors :
-
-
Or : On considère que les espèces
sont miscibles
-
-
La grandeur
V représente de volume du
mélange réactionnel.
-
-
Le quotient de réaction :
-
-
Si on élimine l’espèce
C au fur et à mesure qu’elle se
forme,
-
Alors :
-
Qr, <
K
-
Le système évolue de façon continue
dans le sens direct de l’écriture de l’équation.
-
Le rendement est proche de 100 %.
|
6)- Exercice 15 page 203 : Compléter des étapes d’une synthèse :
|
Compléter des étapes d’une synthèse :
1.
Déterminer les formules topologique des
molécules des espèces A et
B. 2.
Pour chaque étape décrite ci-dessus, le but
recherché est une modification de groupe caractéristique.
Justifier. |
|
Compléter des étapes d’une synthèse : 1.
Formules topologique des molécules des
espèces A et
B.
►
Réaction d’estérification :
-
La réaction est catalysée par les
ions H+ et
accélérée par une élévation de la température (chauffage
Δ).
-
Cette réaction fait intervenir un
acide carboxylique et un alcool.
-
L’acide carboxylique : acide
propanoïque
-
La molécule
A
est un alcool primaire le méthanol :
CH3
– OH - L’ester formé : propanoate de méthyle. - Il est utilisé dans l’industrie alimentaire et la
parfumerie comme arôme.
-
Il possède une odeur de fruit avec
une touche de rhum.
-
Réaction d’élimination : - Le cyclohexan-1-ol est déshydraté en présence d'acide sulfurique concentré
et d'acide phosphorique pour
donner du cyclohexène.
2.
Modification de groupe caractéristique.
Justifier. - Pour la réaction d’estérification, on passe de
la fonction acide
carboxylique
la
fonction ester
- Pour la réaction d’élimination (déshydratation) on passe d’un alcool (R – OH) à
un
alcène
|
7)- Exercice 16 page 204 : Attribuer une catégorie de réaction :
|
Attribuer une catégorie de réaction : On décrit ci-dessous deux étapes d’une synthèse. 1.
Attribuer une catégorie (addition,
élimination, substitution, acide-base) à chacune des réactions décrites
ci-dessus. 2.
Justifier que la première réaction
correspond aussi à une réaction de réduction. |
|
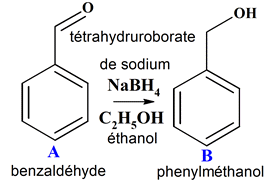
Attribuer une catégorie de réaction :
1.
Catégorie de
chacune des réactions :
-
Réaction
1 :
-
Réaction
d’addition : - On passe d’un aldéhyde à un alcool primaire
-
Le tétrahydruroborate est un
réducteur (c’est une source d’ions hydrure
H–)
- schéma simplifié :
-
Réaction
2 :
-
Réaction
de substitution :
-
Le groupe
OH a été remplacé par le
groupe
Br.
2.
Réaction de
réduction.
-
Le
propanal a été réduit en propan-1-ol.
|
8)- Exercice 20 page 204 : Représenter un motif :
|
Représenter un motif : Le polychlorure de vinyle (PVC) est un polymère
synthétique. Dans le bâtiment, il est utilisé pour la confection des fenêtres et des canalisations. On représente ci-dessous une partie de la formule topologique
d’une de ses macromolécules :
1.
Définir le terme polymère. 2.
Représenter le motif du PVC. 3.
Nommer un autre polymère synthétique et
donner son application. |
Représenter un motif : 1.
Définition du terme polymère.
-
Un polymère est une
macromolécule constituée d’un grand nombre d’unités répétitives,
les
monomères, qui sont unis
par des liaisons covalentes.
-
Dans la macromolécule, une unité
structurale appelée motif
se répète un grand nombre de fois. 2.
Représentation du motif du PVC.
Macromolécule
Motif
-
Réaction de polymérisation :
-
PVC
-
Le chlorure de vinyle polymérise
facilement sous l’action des rayons solaires, de la chaleur
ou au
contact de divers catalyseurs (oxydants puissants ou métaux tels que
cuivre, aluminium)
avec un risque d’incendie ou d’explosion.
-
Le polystyrène :
-
Polymérisation du styrène :
-
Il est utilisé comme isolant dans les
bâtiments (polystyrène expansé PSE et le polystyrène
extrudé XPS :
plus dense).
-
C’est un bon isolant thermique, mais
ce n’est pas un bon isolant phonique.


![]()
9)- Exercice 22 page 205 : Quelques réactions de synthèse :
|
Quelques réactions de synthèse : On donne ci-dessous 7 écritures simplifiées de réactions de
synthèse : a.
b. c. d. e.
:
f.
1.
Écrire les formules topologiques des
molécules des espèces notées J,
K et
L. 2. Recopier les formules topologiques des réactifs A, B, C, G, J, K et L. repérer les groupes
caractéristiques présents puis nommer la famille fonctionnelle
associée. 3.
Les réactions : a.
Déterminer les réactifs permettant de
réaliser les transformations a., e., f.. b.
Déterminer les formules topologiques des
molécules des espèces D ,
F, H
et I. 4. La transformation non totale b. est catalysée par l’ATPS. Déterminer le sous-produit de la réaction et proposer une
méthode permettant d’optimiser le rendement de la synthèse. 5. La transformation f. Conduit à la formation de deux isomères de constitution M et M’. Donner la formule topologique de
M’. 6.
Justifier que la transformation a.
correspond à une réaction d’oxydoréduction. 7.
Type de réaction : a.
Identifier, dans la liste de réaction
ci-dessus, une réaction d’élimination, d’addition et de substitution. b.
Identifier, dans la liste, une réaction dont
le but est :
-
Une modification de chaîne ;
-
Une modification de groupe. |
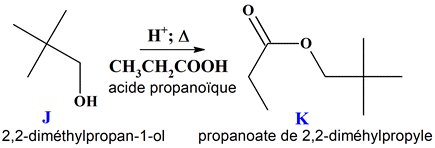
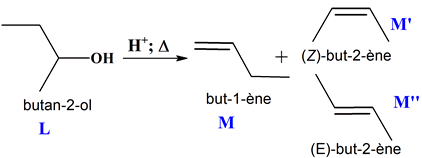
Quelques réactions de synthèse : 1.
Formules topologiques des molécules des
espèces notées J,
K et
L.
Nom
Formule topologique
2,2-diméthylpropan-1-ol
J
Propanoate de
2,2-diméthylpropyle
K
Butan-2-ol
L
2.
Formules topologiques des réactifs
A, B,
C,
G,
J, K et L, groupes
caractéristiques et famille fonctionnelle associée. Molécule
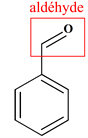
A
Benzaldéhyde
phénylméthanal
Famille
Aldéhyde
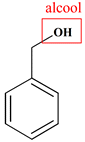
Molécule B
Phénylméthanol
Famille
Alcool (primaire)
Molécule C
Cyclohexanone
Famille
Cétone
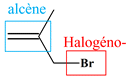
Molécule G
3-bromo-2-méthylprop-1-ène
Famille
Halogéno-alcène
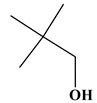
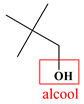
Molécule J
2,2-diméthylpropan-1-ol
Famille
Alcool (primaire)
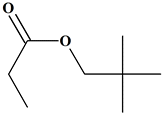
Molécule K
Propanoate de
2,2-diméthylpropyle
Famille
Ester
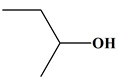
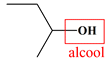
Molécule L
Butan-2-ol
Famille
Alcool (secondaire)
3.
Les réactions : a.
Réactifs permettant de réaliser les
transformations a., e., f..
►
Réactifs de la transformation a. :
-
Tétrahydruroborate de
sodium : NaBH4 :
-
Le tétrahydruroborate est un
réducteur (c’est une source d’ions hydrure H–)
-
L’éthanol :
C2H5OH :
►
Réactifs de la transformation e. :
-
C’est une réaction
d’estérification :
-
Acide propanoïque : CH3
– CH2 – COOH
-
Catalyseur : acide
sulfurique H2SO4
-
La réaction est catalysée
par les ions H+ et accélérée par une élévation de
la température (chauffage Δ).
►
Réactifs de la transformation f. :
-
C’est une réaction
d’élimination.
-
Le butan-2-ol est déshydraté
en présence d'acide sulfurique concentré et d'acide phosphorique pour donner : - le but-1-ène et - le but-2-ène ((Z)- but-2-ène et
(E)-but-2-ène).
-
Dans le cas du butan-2-ol,
on obtient principalement le but-2-ène
(97 %) et minoritairement le but-1-ène (3 %).
-
Le but-2-ène est obtenu sous
forme d’un mélange de ses deux diastéréoisomères,
-
le (E)-but-2-ène
légèrement majoritaire devant
-
et (Z )-but-2-ène
b.
Formules topologiques des molécules des
espèces D ,
F, H
et I.
Molécule
Formule topologique
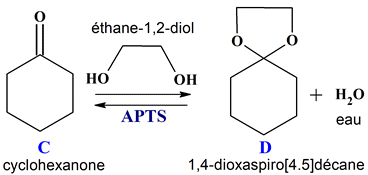
D
1,4-dioxaspiro[4.5]décane
F
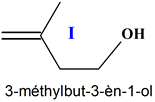
H
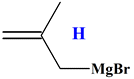
Bromure de 2-méthyl
-2-propénylmagnésium
(organomagnésien)
I
-
Molécule
D :
-
APTS : acide paratoluènsulfonique (acide 4-méthylbenzène-1-sulfonique)
-
L’acide
paratoluènesulfonique est un acide organique fort.
-
Il est utilisé comme
catalyseur acide en synthèse organique.
-
Il ne présente pas de
caractère oxydant comme l’acide sulfurique.
-
Il limite les réactions
secondaires (sa base conjuguée n’est pas nucléophile).
►
La réaction c. :
-
Elle se fait en deux
étapes :
►
Réaction d. : 4.
La transformation non totale b.
-
Sous-produit de la
réaction : c’est l’eau :
-
APTS : acide paratoluènsulfonique (acide 4-méthylbenzène-1-sulfonique)
-
L’acide
paratoluènesulfonique est un acide organique fort.
-
Il est utilisé comme
catalyseur acide en synthèse organique.
-
Il ne présente pas de
caractère oxydant comme l’acide sulfurique.
-
Il limite les réactions
secondaires (sa base conjuguée n’est pas nucléophile).
-
Méthode permettant
d’optimiser le rendement de la synthèse :
-
On peut améliorer le
rendement d’une réaction limitée en ajoutant :
-
Un excès de l’un des
réactifs de la réaction (le moins cher),
-
Ou en éliminant un des
produits de la réaction (distillation fractionnée : lorsque cela est
possible). 5.
Isomères de constitution
M et
M’.
-
Formule topologique de
M’.
-
La molécule
M’
est le but-2-ène
-
il est obtenu sous forme
d’un mélange de ses deux diastéréoisomères,
-
le (E)-but-2-ène
-
le (Z )-but-2-ène 6.
Transformation a. et réaction
d’oxydoréduction.
-
Réaction de réduction :
l’aldéhyde a été réduit en alcool (primaire)
Réduction
→
Ox
+ n e–
Red
R
– CHO
+ 2 H+ + 2 e–
R
– CH2
– OH
Aldéhyde
Oxydation
←
Alcool 7.
Type de réaction : a.
Identification une réaction
-
d’élimination : réaction
f. :
(élimination d’une molécule d’eau)
-
d’addition : réaction
a. :
(addition d’hydrogène
H)
-
de substitution : réaction
c. (changement du groupe
OH –
pour le groupe
CH3O –) b.
Identification, dans la liste, une réaction
dont le but est :
-
Une modification de chaîne :
réaction
d. :
(prop → but)
-
Une modification de groupe :
réaction
a. (
aldéhyde → alcool)


![1,4-dioxaspiro[4.5]décane](images10/ex22D01.gif)

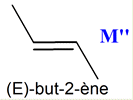 légèrement majoritaire devant
légèrement majoritaire devant 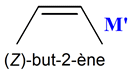
![]()
![]()
![]()
10)- Exercice 25 page 206 : Le nylon-6,6 :
|
Le nylon-6,6 : A.
Le nylon-6,6 : Le nylon-6,6 est un polyamide obtenu par une réaction de
polymérisation, il est utilisé comme « soie synthétique ». Cette fibre présente une meilleure élasticité que les fibres
naturelles. Le nylon-6,6 est obtenu par réaction entre l’hexane-1,6-diamine
et l’acide hexanedioïque On donne ci-dessous les formules topologiques des réactifs et
d’une macromolécule du polymère.
B.
Recyclage du nylon. Le procédé d’ammonolyse permet de recycler du nylon, le cœur du procédé est la dépolymérisation. Le nylon réagit avec un excès d’ammoniac entre 300 ° C et 350 ° C, à des pressions comprises entre 35 et 175 bars en présence d’un catalyseur au phosphate. Les
produits obtenus correspondent à un mélange de monomères et d’eau. D’après le site Ademe.fr 1.
Exploitation des formules : a.
Recopier les formules topologiques des
molécules des réactifs, repérer les groupes caractéristiques puis
nommer la famille fonctionnelle correspondante. b.
Justifier le nom de chacun des réactifs. c.
Nommer la catégorie (addition, élimination,
substitution) de la réaction de synthèse du nylon-6,6. 2.
Le polymère : a.
Justifier le nom de polyamide donné au
nylon-6,6. b.
Déterminer la formule semi-développée du
motif du nylon-6,6. 3.
Citer un autre polymère synthétique et un
polymère naturel. 4.
Le polymère (suite) : a. Dans la formule du polymère, n est appelé degré de polymérisation. Il est possible de déterminer la masse molaire M du polymère et donc le degré de polymérisation n par chromatographie. Rappeler le principe de la
chromatographie sur couche mince. b.
Calculer la masse molaire du motif du
nylon-6,6. c.
On détermine expérimentalement M =
1,2 × 105 g . mol–1. En déduire le degré de
polymérisation n. 5.
Pour la réaction d’ammonolyse : a.
Donner la formule du réactif secondaire mis
en jeu. b.
Indiquer l’intérêt d’éliminer en continu
l’eau du milieu réactionnel. c.
Expliquer le rôle du catalyseur.
-
Données :
-
Masses molaires :
-
M (C)
= 12,0 mol . L–1 ;
M (O) = 16,0 mol . L–1 ;
-
M (N)
= 14,0 mol . L–1 ;
M (H) = 1,01 mol . L–1 |
|
Le nylon-6,6 : 1.
Exploitation des formules : a.
Formules topologiques des molécules des
réactifs, groupes caractéristiques, la famille fonctionnelle
correspondante.
-
Molécule d’acide hexanedioïque (acide
carboxylique).
-
Molécule d’hexane-1,6-diamine (amine)
b.
Justification du nom de chacun des réactifs.
-
Molécule d’c :
-
Molécule d’hexane-1,6-diamine :
c.
Nom de la catégorie de la réaction de
synthèse du nylon-6,6.
-
Réaction de polycondensation : il y a
élimination de molécules d’eau 2.
Le polymère : a.
Justification du nom de polyamide donné au
nylon-6,6.
-
Le nylon-6,6 possède des groupes
amide
-
C’est un polyamide.
b.
Formule semi-développée du motif du
nylon-6,6. 3.
Autre polymère synthétique et un polymère
naturel.
-
Le PVC : Polychlorure de vinyle
-
La soie :
-
La soie est une fibre protéique
naturelle.
-
La soie brute est constituée
d'environ 65% de fibroïne, un polypeptide relativement simple.
-
La fibroïne de la soie du bombyx du
mûrier est une protéine fibreuse constituée de 17 aminoacides
principaux.
-
Elle est très riche en glycine (38%),
alanine (25%), sérine (13%) tyrosine (12%),...
-
la cellulose : c’est une chaîne
linéaire constituée de molécules de glucose (D-glucose) 4.
Le polymère (suite) : a.
Principe de la chromatographie sur couche
mince.
-
La chromatographie permet de séparer
les espèces chimiques présentes dans un mélange homogène.
-
Elle est basée sur la différence de
solubilité d’une substance dans deux phases non miscibles :
-
La phase stationnaire (ou fixe) et la
phase mobile.
-
Dans la chromatographie sur
CCM,
-
La phase fixe est constituée par une
fine couche de silice hydratée
-
La phase mobile est un solvant dans
lequel les constituants du mélange sont plus ou moins solubles.
-
L’éluant migre le long de la phase
fixe par capillarité en entraînant plus ou moins rapidement les
constituants du mélange à analyser.
-
C’est le phénomène d’élution.
-
La séparation des composants,
entraînés par la phase mobile résulte de leur différence de
solubilité entre les deux phases.
-
Les composés dissous déposés se
fixent sur la phase fixe pour s’en arracher et monter avec la phase
mobile.
-
Chaque constituant du mélange se
déplace avec sa propre vitesse derrière le front du solvant.
-
Ainsi, on peut séparer et identifier
les différents constituants d'un mélange. b.
Masse molaire du motif du nylon-6,6.
-
M (motif) =
M
(C12H22O2N2)
-
M (motif) = 12
M (C) + 2 M (O)
+ 2 M (N) + 22
M (H)
-
M (motif) ≈ 226 g . mol–1. c.
Degré de polymérisation n.
-
M = 1,2 × 105
g . mol–1.
-
M =
n .
M (motif)
-
5.
Pour la réaction d’ammonolyse : a.
Formule du réactif secondaire mis en jeu.
-
Le nylon réagit avec un excès
d’ammoniac : NH3 b.
Intérêt d’éliminer en continu l’eau du
milieu réactionnel.
-
En éliminant l’eau au fur et à
mesure, on déplace l’équilibre dans le sens de la réaction
d’ammonolyse et on augmente le rendement de la réaction. c.
Rôle du catalyseur.
-
Le catalyseur augmente la valeur de la vitesse de
la réaction d’ammonolyse.
|
|
|