|
QCM N° 14 a |
Synthèse d'espèces chimiques |
|
|
Synthèse d’une espèce chimique
Pour
chaque question, indiquer la (ou les) bonne(s)
réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
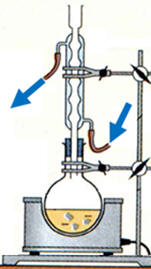
La représentation correcte d’un montage à reflux est : |
|
|
|
C |
|
2 |
Lors de l’étape de chauffage à reflux le réfrigérant est nécessaire pour : |
Éviter la perte de matière. |
Recueillir les produits formés. |
Des raisons de
sécurité. |
AC |
|
3 |
Dans un réfrigérant à eau : |
L’eau circule de haut en bas. |
L’eau circule de bas en haut. |
Le sens de circulation est indifférent. |
B |
|
4 |
À la fin de la synthèse, on refroidit le milieu réactionnel pour : |
Des raisons de
sécurité. |
Condenser les vapeurs éventuellement toxiques. |
Faire précipiter le produit s’il est solide. |
ABC |
|
5 |
Pour isoler un produit solide du reste du milieu réactionnel, on peut effectuer : |
Une extraction liquide/liquide. |
Une filtration. |
Une hydrodistillation. |
B |
|
6 |
Dans une ampoule à décanter l’espèce chimique synthétisée est : |
Toujours présente dans la phase de dessous. |
Toujours présente dans la phase de dessus. |
Présente dans la phase où elle est le plus soluble. |
C |
|
7 |
Pour identifier le produit obtenu lors d’une synthèse, on peut effectuer : |
Une chromatographie sur couche mince. |
Une extraction. |
Une mesure de la température de fusion. |
A |
|
8 |
Le chromatogramme ci-dessous permet d’affirmer que : |
Le réactif R est encore présent dans le produit synthétisé. |
Des impuretés sont présentes dans le produit synthétisé |
Le produit synthétisé contient bien l’espèce
A. |
BC |
►
Le chauffage à reflux :
-
Ce montage permet de maintenir le
milieu réactionnel à une température constante, en l'occurrence
pratiquement la température d'ébullition du solvant.
-
Les vapeurs sont condensées dans
le réfrigérant et retournent à l'état liquide dans le ballon.
-
On évite ainsi la perte de
matière.
-
Les réactifs et les produits
restent dans le milieu réactionnel.
- La présence du vallet est obligatoire.
- Elle permet d’enlever le chauffe-ballon sans
toucher au reste du montage (ballon et réfrigérant).
-
Ainsi, on peut rapidement
refroidir le mélange réactionnel si un problème survient et (ou)
lorsque la réaction est terminée.
-
Dans le réfrigérant, l’eau
circule du bas vers le haut.
►
À la fin de la synthèse, on
refroidit le milieu réactionnel pour :
-
Des raisons de
sécurité (pour éviter les brûlures)
-
Condenser les vapeurs
éventuellement toxiques.
-
Faire précipiter le produit s’il
est solide.
►
Méthodes d’extraction :
►
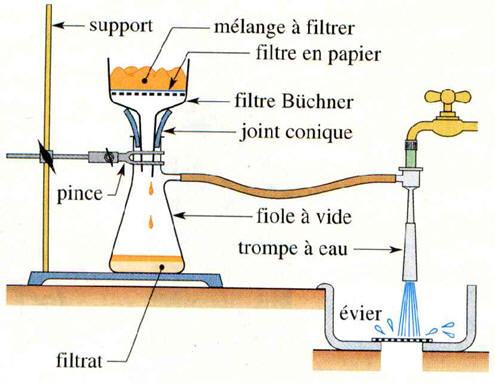
Filtration solide/liquide :
-
Filtration simple :

-
Filtration sous vide :
►
Filtration solide/liquide :
-
Elle permet de séparer un solide
d’un liquide dans lequel il est insoluble.
►
Filtration solide/liquide :
-
Lors d’une extraction
liquide/liquide :
-
L’espèce chimique à extraire est
plus soluble dans le solvant extracteur que dans le solvant de
départ.
-
Et le solvant extracteur et le
solvant de départ sont non miscibles.
►
L’extraction liquide/liquide.
-
Lors d’une extraction
liquide/liquide :
-
L’espèce chimique à extraire est
plus soluble dans le solvant extracteur que dans le solvant de
départ.
-
Et le solvant extracteur et le
solvant de départ sont non miscibles.
-
Pour extraire une espèce dissoute
dans un solvant S1, on utilise un autre
solvant S2, non miscible avec
S1,
dans lequel l’espèce chimique est nettement plus soluble.
-
L’extraction par un solvant
consiste à dissoudre l’espèce chimique recherchée dans un
solvant non miscible avec l’eau et à séparer les deux phases
obtenues.
-
L’extraction par un solvant se
réalise dans une ampoule à décanter.
-
Le choix du solvant dépend de
l’espèce chimique recherchée.
-
Ampoule à décanter :
-
Expérience :
extraction du
diiode présent dans une solution.

-
Lorsque deux liquides ne sont pas
miscibles, le liquide qui surnage est celui dont la densité est
la plus faible.
►
Identification de l’espèce
chimique synthétisée :
-
Il est nécessaire de vérifier la
présence de l’espèce attendue ainsi que son degré de pureté.
-
La caractérisation de l’espèce
chimique peut se faire grâce à ses propriétés physiques :
-
Aspect,
-
Solubilité,
-
Température d’ébullition,
température de fusion (si l’espèce obtenue est à l’état solide),
-
Densité,
-
Indice de réfraction…
-
On peut effectuer une analyse
comparative :
-
On peut réaliser une
chromatographie sur couche mince (C.C.M) :
-
De l’espèce
synthétique,
-
De l’espèce de
référence,
-
D’un extrait naturel
contenant la même espèce chimique.
-
Il faut ensuite
comparer la position des différentes taches du chromatogramme
obtenu.
- Remarque : Une espèce chimique d’origine naturelle est identique à l’espèce chimique obtenue par synthèse.
- Rien ne permet de les différencier.
►
Étude du chromatogramme :

-
Le produit synthétisé n’est pas
pur.
-
On est en présence d’un mélange
de deux espèces chimiques car on observe deux taches.
-
La première tache, du produit
synthétisé, se situe au même niveau que celle du dépôt de
l’espèce chimique A.
-
Le produit synthétisé contient
bien l’espèce A.
-
Le produit synthétisé ne contient
pas le réactif R.
-
Il n’y a pas de tache au même
niveau que celle du dépôt du réactif R.
|
|