|
TP Chimie. N° 04 |
Synthèse d'un ester à l'odeur fruitée. Correction |
|
|
|
|
Programme 2010 : Physique et Chimie Programme 2020 : Physique et Chimie |
Objectif : synthétiser une espèce chimique existant dans la nature.
|
Matériel : |
élèves : 1 tube à essais (f 20 mm) - un réfrigérant à air - support tubes en fer - 1 entonnoir - 1 ampoule à décanter (100 mL) - verre à pied - bécher - languette de papier filtre. |
|
Prof : alcool isoamylique - acide acétique - acide sulfurique concentré - pierre ponce - solution de chlorure de sodium glacée (40 g / L) - hydrogénocarbonate de sodium à 5 % - 1 montage chauffage à reflux - 1 ampoule à décanter (250 mL) - un valet - 1 cristallisoir - chauffe-tubes - verre à pied
- bécher. |
I- Préparation de l'ester.
1)- Préparation au laboratoire (prof).Chauffage à reflux.
![]() Introduire dans le ballon :
Introduire dans le ballon :
- 15 mL d'alcool isoamylique (3-méthylbutan-1-ol),
- 20 mL d'acide acétique (acide éthanoïque),
- 1 mL d’acide sulfurique concentré,
- Quelques grains de pierre ponce ou quelques billes de verre.
- Adapter le réfrigérant et porter le mélange à l'ébullition douce pendant 20 min.
2)- Préparation rapide (élève).
![]() Introduire dans un tube à essais environ 5 mL du mélange
(alcool isoamylique, acide acétique et acide sulfurique) préparé par le
professeur,
Introduire dans un tube à essais environ 5 mL du mélange
(alcool isoamylique, acide acétique et acide sulfurique) préparé par le
professeur,
- Surmonter le tube d’un réfrigérant à air,
- Placer le tube dans le chauffe-tubes (bureau du professeur),
- Laisser chauffer 15 min.
3)- Observations.
![]() Faire un schéma légendé et détaillé du montage réalisé par le
professeur. Quel est le rôle de la pierre ponce ? Quel est le rôle du réfrigérant ?
Faire un schéma légendé et détaillé du montage réalisé par le
professeur. Quel est le rôle de la pierre ponce ? Quel est le rôle du réfrigérant ?
|
Chauffage
à Reflux
|
1-
réfrigérant. 2-
Ballon. 3-
Chauffe-ballon. 4-
Sortie de l’eau. 5-
Arrivée de l’eau. 6-
Mélange réactionnel. 7-
Vallet. |
- La pierre ponce sert à réguler l'ébullition. Lors de l'ébullition, les bulles de gaz sont plus petites.
- Ce montage permet de maintenir le milieu réactionnel à une température constante, la température θ = 93 °C pour une pression p = 973 hPa.
- Le réfrigérant permet de condenser les vapeurs qui retournent à l'état liquide dans le ballon.
-
Les réactifs et les produits restent dans le milieu réactionnel.
![]() Faire un schéma détaillé de l’expérience réalisée par l’élève.
Quel est le rôle du réfrigérant à air ? Le mélange est-il homogène avant
l’expérience ? L’est-il toujours après ?
Faire un schéma détaillé de l’expérience réalisée par l’élève.
Quel est le rôle du réfrigérant à air ? Le mélange est-il homogène avant
l’expérience ? L’est-il toujours après ?
|
|
- Le réfrigérant
à air permet de condenser les vapeurs
- Le mélange n'est pas homogène avant la transformation chimique. - L'alcool isoamylique et l'acide acétique sont des liquides non miscibles. - L'alcool isoamylique est moins dense que l'acide acétique se situe au-dessus de l'acide acétique. - En fin de réaction chimique, on observe toujours deux phases, une phase organique située au -dessus et une phase aqueuse. |
|
1)- Mode opératoire après le chauffage à reflux.
![]() Laisser refroidir à température ambiante puis refroidir avec
un cristallisoir contenant de l’eau glacée,
Laisser refroidir à température ambiante puis refroidir avec
un cristallisoir contenant de l’eau glacée,
- Verser le mélange obtenu dans l’ampoule à décanter (avec un entonnoir) en laissant la pierre ponce dans le ballon,
- Ajouter environ 10 mL d’eau salée glacée dans l’ampoule à décanter, boucher, agiter puis éliminer la phase inférieure,
- Ajouter 30 mL d’eau salée glacée puis 15 mL d’hydrogénocarbonate de sodium, agiter, dégazer, laisser décanter,
- Si le temps le permet : Verser deux cuillères de sulfate de magnésium anhydre pour sécher.
- Récupérer l’ester.
2)- Mode opératoire après chauffage à reflux avec réfrigérant à air.
![]() Laisser refroidir à température ambiante puis refroidir à
l’eau du robinet.
Laisser refroidir à température ambiante puis refroidir à
l’eau du robinet.
- Verser le mélange obtenu dans l’ampoule à décanter (avec un entonnoir).
- Ajouter environ le volume d’un tube à essais d’eau salée glacée.
- Boucher, agiter et laisser décanter.
- Évacuer la phase inférieure dans un verre à pied.
- Recueillir la phase supérieure dans un bécher.
- Tremper une bande de papier filtre dans la phase organique. Respirer et noter l’odeur de l’ester.
3)- Compte-rendu.
![]() Faire des schémas légendés des diverses manipulations réalisées.
Faire des schémas légendés des diverses manipulations réalisées.
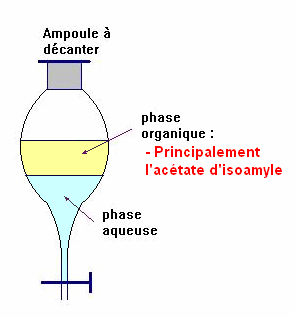
![]() Pourquoi y a-t-il deux phases dans l’ampoule à décanter ?
Pourquoi y a-t-il deux phases dans l’ampoule à décanter ?
- L'acétate d'isoamyle se trouve principalement dans la phase organique car il est peu soluble dans l'eau.
![]() Compte tenu des renseignements du tableau, préciser la position
et la composition de chaque phase.
Compte tenu des renseignements du tableau, préciser la position
et la composition de chaque phase.
- La phase organique contient principalement l'acétate d'isoamyle qui est moins dense que l'eau, elle se trouve au-dessus de la phase aqueuse.
- La phase aqueuse contient principalement de l'eau, mais aussi un peu d'acide acétique
![]() Quel est le rôle de l’eau salée ?
Quel est le rôle de l’eau salée ?
- L'acétate d'isoamyle est moins soluble dans l'eau salée que dans l'eau. Cette opération à pour but de mieux séparer l'ester de la phase aqueuse.
![]() Quel est le rôle de l’hydrogénocarbonate de sodium ?
Quel est le rôle de l’hydrogénocarbonate de sodium ?
- Dans la phase organique, on trouve aussi un peu d’acide éthanoïque qui est en excès.
-
Il faut l’éliminer de la phase organique.
- L'hydrogénocarbonate de sodium est une solution basique, elle neutralise le milieu réactionnel et élimine l'acide éthanoïque restant en le solubilisant dans l'eau sous forme d'ions éthanoate.
-
De façon générale,
les ions se retrouvent dans la phase aqueuse car l’eau est un solvant
polaire.
Tableau
de données
|
|
densité |
θ ébullition °C |
Solubilité
dans l'eau |
|
Acide éthanoïque |
1,05 |
118,2 |
Grande |
|
Alcool
isoamylique |
0,81 |
128 |
Faible |
|
Éthanoate de
3-méthylbutyle |
0,87 |
142 |
Très faible |
Remarque : la solubilité de composés organiques est plus faible dans l’eau salée que dans l’eau.
La solubilité des composés organiques diminue avec la température.