|
QCM N° 18 a |
Les matériaux et les molécules du sport Cours 01 Cours 02 |
|
|
|
►
Formule brute d’une molécule :
-
La formule brute d’une molécule
est l’écriture la plus compacte décrivant la nature et le nombre
d’atomes de cette molécule.
-
À chaque molécule est attribuée
un nom et une formule brute.
-
Dans la formule brute d’une
molécule, les symboles des éléments présents dans la molécule
sont écrits côte à côte avec, en indice, en bas à droite, le
nombre d’atomes de chaque élément.
-
L’indice 1 n’est jamais spécifié.
-
La nature et le nombre des atomes
présents dans une molécule sont donnés par sa formule brute.
-
Exemple : formule brute de la
molécule d’eau : H2O et formule brute
de la molécule de saccharose :
C12H 22O11
►
Formule développée :
-
Les atomes sont représentés par
leur écriture symbolique.
-
Une liaison simple est symbolisée
par un tiret entre les atomes.
-
Une liaison multiple est
symbolisée par plusieurs tirets.
-
Dans la formule développée d’une
molécule, toutes les liaisons sont représentées.
-
Exemple la molécule d’eau :
H
— O
— H
►
Formule semi-développée.
-
Les atomes sont représentés par
leur écriture symbolique.
-
Une liaison simple est symbolisée
par un tiret entre les atomes.
-
Une liaison multiple est
symbolisée par plusieurs tirets.
-
Dans la formule semi-développée
d’une molécule, on ne représente pas les liaisons engagées par
les atomes d’hydrogène.
-
Exemple : éthane
CH3
— CH3
►
Les isotopes.
-
Des atomes sont isotopes si leurs
noyaux possèdent le même nombre de protons mais des nombres
différents de neutrons.
►
Isomères :
-
On appelle isomères, des espèces
chimiques qui ont la même formule brute, mais des enchaînements
d’atomes différents.
-
Exemple :
-
Formule brute :
C3
H8
O

►
Groupes caractéristiques :
►
Modélisation 3 D :

-
Formule semi-développée :

-
Acide 2-aminobutanoïque (acide
α-aminé)
-
Il possède un groupe carboxyle et
un groupe amine.
►
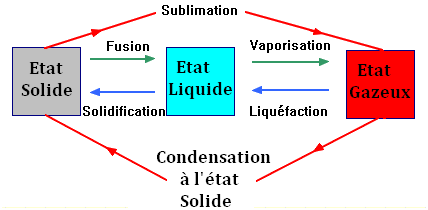
Changements d’état physique :
►
Chromatogramme :
-
La
chromatographie permet la séparation des constituants d’un
mélange.
-
La
chromatographie est aussi une technique d’analyse. Elle permet
d’identifier les espèces chimiques présentes dans un mélange.
-
Des espèces
chimiques identiques migrent à des hauteurs identiques sur une
même plaque de chromatographie.
-
Lorsqu’une espèce chimique est
pure, elle donne une seule tache.
-
Lorsqu’on est en présence de
plusieurs taches à des hauteurs différentes, on est en présence
d’un mélange d’espèces chimiques.
-
Le chromatogramme ci-dessous
permet de conclure que :
-
Les espèces chimiques
A et
B sont pures et qu’elles sont différentes.
-
Pour chaque dépôt, on obtient une
seule tache à des hauteurs différentes.

►
Préparation du chromatogramme :
-
Pour réaliser un chromatogramme,
on utilise :
-
Un solvant ou un mélange de
solvants appelé éluant ou phase mobile.
-
Un support solide fixe appelé
phase fixe (bande de papier Whatman)
-
On trace sur la phase fixe une
ligne de dépôts au crayon de papier (à environ 1 cm du bord
inférieur.
-
Il faut laisser suffisamment
d’espaces entre les différents dépôts
-
Ce trait ne doit pas tremper dans
l’éluant contenu dans la cuve.
-
Tremper verticalement la phase
fixe dans l’éluant, en faisant
bien attention à ce que la ligne de dépôt soit au-dessus
du niveau de l’éluant.
-
Fermer la cuve pour que l’air à
l’intérieur de la cuve soit saturé en vapeurs des solvants qui
constituent l’éluant.
-
Le schéma correct est le schéma
C :
-
Schéma
A : l’éluant se
situe au-dessus de la ligne de dépôts.
-
Schéma
B : il manque le
couvercle au-dessus du chromatogramme.

|
|