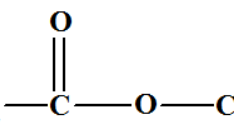|
Document : Les Alcools. |
|
|
|
|
Schéma de Lewis |
|
|
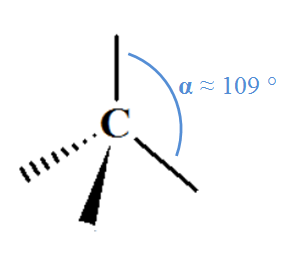
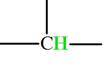
- L'atome de carbone est tétravalent.
- Sa structure géométrique dépend du nombre d'atomes voisins ou de
groupes voisins qu'il possède. - Il peut établir 4 simples liaisons avec 4 atomes voisins :
carbone tétragonal. - Il peut établir 2 simples liaisons et une double liaison. - Il
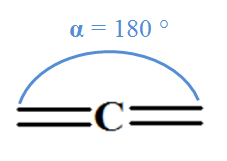
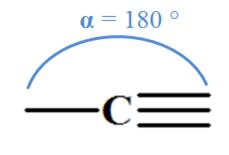
possède alors 3 voisins : Carbone trigonal. - Il peut établir 2 doubles liaisons ou une simple liaison et une triple liaison. - Il possède alors deux voisins. Le
carbone
est digonal. |
|
carbone
tétragonal |
Carbone trigonal |
Carbone digonal |
|
Schéma de Lewis |
|
|
- La valence de l'atome d'oxygène est deux.
- Il peut établir soit deux simples liaisons comme dans la molécule d'eau, soit une double liaison comme dans la molécule de dioxyde de
carbone. |
|
|
|
|
Molécule d’eau |
Molécule de dioxyde de
carbone |
|
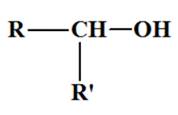
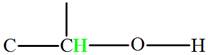
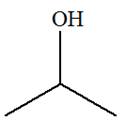
- On appelle alcool tout composé organique possédant un groupe
hydroxyle – OH lié à un atome de carbone tétragonal. - L’atome de carbone lié au groupe hydroxyle est appelé : Atome de
carbone fonctionnel. - Formule générale d’un alcool :
R – OH. - R désigne un groupe alkyle du type :
– Cn
H2n+1
- On distingue : |
|
Les alcools primaires |
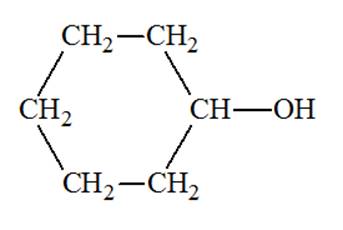
Les alcools secondaires |
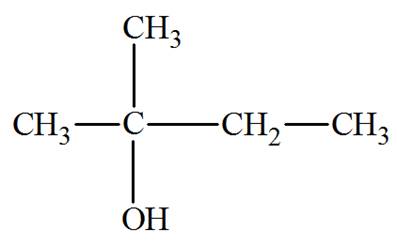
Les alcools tertiaires |
|
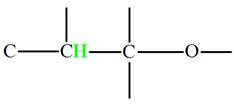
L’atome de carbone fonctionnel n’est lié qu’à des atomes d’hydrogène ou à un seul atome de carbone |
L’atome de carbone fonctionnel est lié à deux atomes de carbone |
L’atome de carbone fonctionnel est lié à trois atomes de carbone |
►
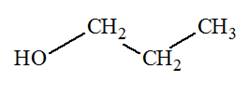
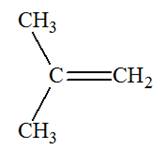
Exemples :
|
Éthanol
|
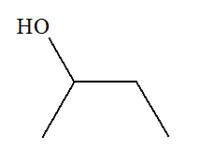
propan-2-ol |
2-méthylpropan-2-ol |
|
CH3
– CH2OH |
|
|
|
- La nomenclature des alcools découle de celle des alcanes.
- On cherche la chaîne carbonée la plus longue contenant l’atome de
carbone qui porte le groupe hydroxyle –
OH. - On met en place la numérotation qui donne à cet atome de carbone
l’indice le plus petit. - On nomme l’alcool grâce au nom de l’alcane correspondant à cette chaîne avec élision du e final que l’on fait suivre du
suffixe
ol affecté de l’indice de position qui lui correspond. -
Exemples : |
|
Nom |
formule semi-développée |
classe |
|
Propan-1-ol |
|
Alcool primaire |
|
Propan-2-ol |
|
Alcool secondaire |
|
2-méthylpropan-2-ol |
|
Alcool tertiaire |
3)- Propriétés
physiques des alcools.
►
Complément :
|
Tous les alcools ont une grande
importance industrielle.
Les
alcools dont la chaîne carbonée comporte moins de 10 atomes
de carbone sont des
liquides incolores à la température ordinaire. La température d'ébullition des
alcools est nettement plus importante que celle des alcanes correspondants. Cette particularité est liée à la
présence du groupe hydroxyle. La plupart des alcools sont
miscibles à l'eau en toutes proportions. Toutefois cette miscibilité décroît
avec la longueur de la chaîne carbonée. La molécule d'un alcool possède deux
parties : Une partie hydrophobe : la chaîne
carbonée Une partie hydrophile : le groupe
hydroxyle. La miscibilité est liée à
l'importance relative de ces deux parties. Les deux alcools les plus importants
sont : L'éthanol (alcool
éthylique) que l'on retrouve dans les boissons alcoolisées. Des petites quantités d'éthanol
provoquent un état euphorique. Des doses plus importantes dépriment
gravement le système nerveux :
à
consommer avec modération ! Le méthanol ou alcool de bois
que l'on peut retrouver dans les alcools frelatés. Il provoque la cécité et la mort. On utilise les alcools comme solvant
en pharmacie, en cosmétologie… |
|
- Écrire la formule brute commune à tous les alcools ayant 5 atomes
de carbone et une chaîne saturée non cyclique. - C5H11OH - Écrire leur formule semi-développée, les nommer et préciser leur
classe. |
|
Pentan-1-ol Alcool primaire |
|
|
3-méthylbutan-1-ol Alcool primaire |
|
|
2-méthylbutan-1-ol Alcool primaire |
|
|
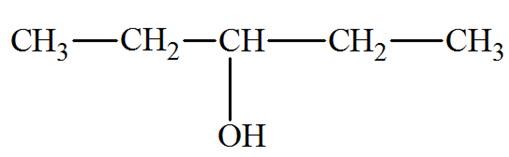
Pentan-2-ol Alcool secondaire |
|
|
Pentan-3-ol Alcool secondaire |
|
|
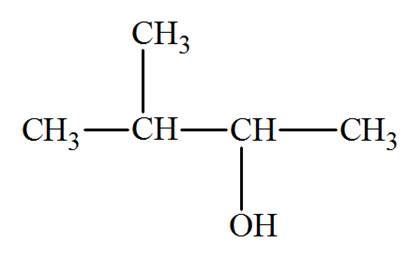
3-méthylbutan-2-ol Alcool secondaire |
|
|
3-méthylbutan-2-ol Alcool tertiaire |
|
|
2,2-diméthylpropan-1-ol Alcool primaire |
|
b)-
Application 2 : Reconnaître la classe d’un alcool.
Énoncé :
|
Déterminer la classe des alcools dont
la formule
semi-développée est donnée ci-dessous : 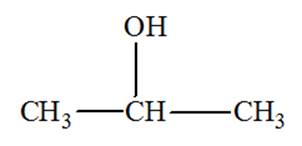 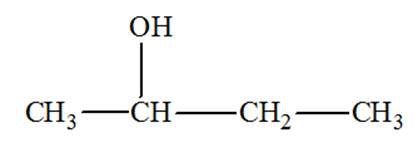 d)-
d)-
 e)-
e)-
 f)-
f)-
 |
Correction :
|
-
Propan–1– ol : Alcool primaire  -
Propan–2–ol : Alcool secondaire -
Butan–2–ol : Alcool secondaire  -
Cyclohexanol : Alcool secondaire -
 -
Phénylméthanol : Alcool primaire  -
2–méthylbutan–2–ol : Alcool tertiaire |
c)-
De la structure aux propriétés, cas des alcanes et des alcools.
Exercices.
-
Applications.
1)- Bandes d’absorption caractéristiques.
|
- À chacune des liaisons rencontrées en chimie organique correspond
un domaine de nombre d’ondes
σ bien précis.
- Pour chacune des liaisons rencontrées en chimie organique, les nombres d’ondes correspondant au maximum d’absorption sont donnés dans
le tableau ci-dessous. - Tableau simplifiée : |
|
Liaison |
σ (cm–1) |
Intensité |
|
– O
– Hlibre |
3580 à 3650 |
Forte |
|
– O
– Hlié |
3200 à 3400 |
Forte |
|
|
1415 à 1470 |
Forte |
|
|
1050 à 1450 |
Forte |
|
- Les notations : - L’intensité traduit l’importance de l’absorption.
– O
– Hlibre sans liaison
hydrogène et
– O
– Hlié
avec liaison
hydrogène. Ctri correspond à un carbone trigonal engagé
dans une double liaison. Ctét correspond à un carbone tétragonal engagé
dans quatre liaisons simples. |
2)- Cas de la
liaison O – H ; liaison hydrogène.
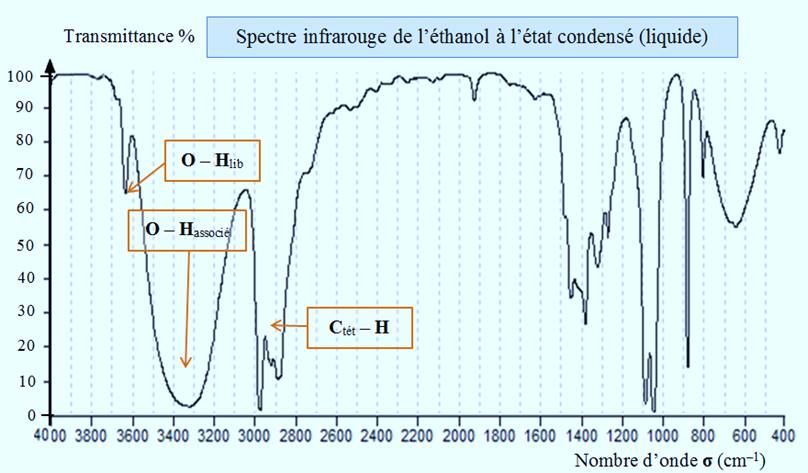
- Spectre de l’éthanol à l’état gazeux :
-
Spectre de l’éthanol à l’état liquide :
|
- Ci-dessus, on peut observer les spectres infrarouges de l’éthanol
à l’état gazeux et à l’état liquide. ►À l’état gazeux : - La liaison
O – H donne une bande moyenne et fine vers 3620
cm–1. - Il n’existe pas de liaison hydrogène entre les molécules
d’éthanol, la liaison O – H est dite libre, que l’on note
O –
Hlib. ►À l’état liquide : - La liaison
O – H se manifeste par une bande d’absorption
forte et large de 3200 cm–1à 3400 cm–1. - Les liaisons hydrogène établies entre les molécules d’éthanol affaiblissent les liaisons covalentes O – H et conduisent à un
abaissement du nombre d’onde
σO – H. - De plus, la bande s’élargit, la liaison
O – H est dans ce
cas dite associée, on la note O – Hassocié. - Ce résultat est général.
et l’élargissement
de la bande d’absorption. |
-
Reconnaître des bandes d’absorption
-
Spectres infrarouges et oxydation
1)- Les valeurs
de déplacement chimique δ sont comprises entre 0 et 14 ppm.
►
Tableau de déplacement chimique
δ (ppm) de quelques
protons :
|
Groupe méthyle
CH3
– |
|
|
Proton |
δ (ppm) |
|
CH3
– C |
0,9 |
|
CH3
– C – O |
1,4 |
|
CH3
– OH |
3,4 |
|
Groupe méthylène –
CH2
– |
|
|
Proton |
δ (ppm) |
|
C – CH2
– C |
1,3 |
|
C – CH2
– C – O |
1,9 |
|
C – CH2
– O – H |
3,6 |
|
Groupe méthyne
|
|
|
Proton |
δ (ppm) |
|
|
1,5 |
|
|
2,0 |
|
|
3,9 |
|
Autres groupes |
|
|
R – OH |
0,5 – 5,5 |
|
|
4,5 – 7,1 |
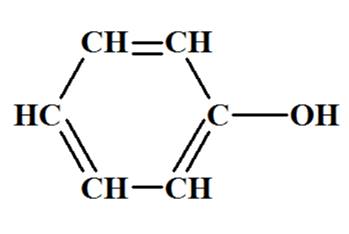
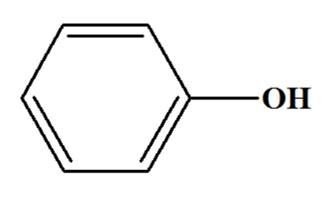
V- Un cas particulier : La
fonction Phénol.
|
Un phénol n’est pas un alcool car le carbone fonctionnel est trigonal. Mais, vis à vis de la formation des esters, on considère qu’un
phénol se comporte comme un alcool.
|
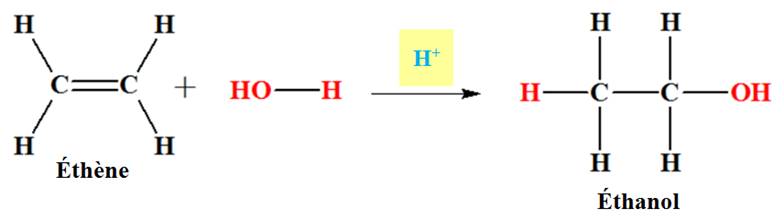
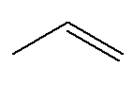
VI- Obtention d'un alcool à
partir d'un alcène.
|
- En présence d’un acide (acide sulfurique le plus souvent), agissant comme catalyseur, l'eau peut s'additionner sur l’éthène pour
conduire à un alcool, l’éthanol. -
Équation de la réaction : |
|
- En présence d’un acide (acide sulfurique le plus souvent), agissant comme catalyseur, l'eau peut s'additionner sur les alcènes pour
conduire à un alcool. -
Équation de la réaction : |
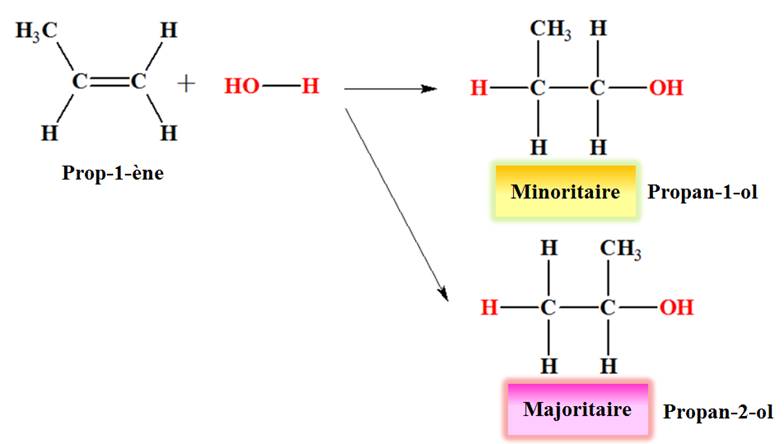
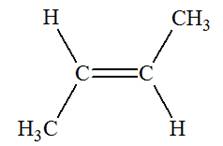
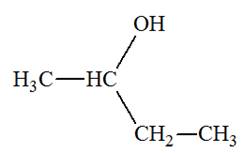
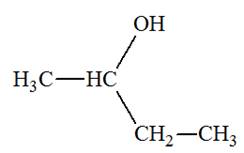
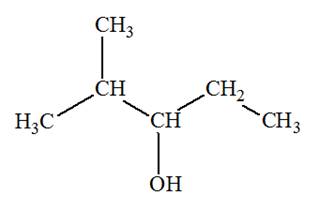
3)- Hydratation
du prop-1-ène.
|
- En présence d’un acide (acide sulfurique le plus souvent), agissant comme catalyseur, l'eau peut s'additionner sur le propa-1-ène pour conduire à deux alcools, le porpan-1-ol (minoritaire) et le
propan-1-ol (majoritaire). |
- Équation de la réaction :
VII-
Déshydratation d’alcools :
|
- La déshydratation d’un alcool est une réaction d’élimination
d’une molécule d’eau. |
- Énoncé :
- Correction :
|
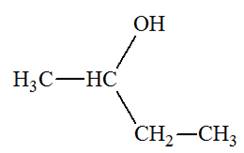
1)-
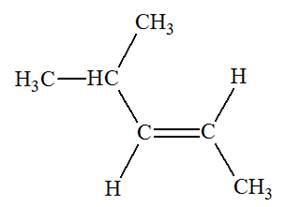
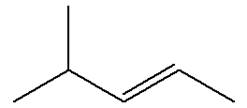
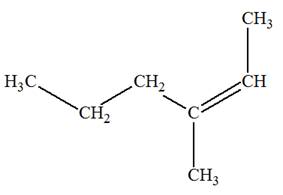
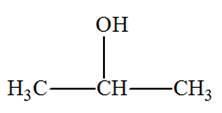
Formules semi-développée et topologique des alcènes:
2)-
Formules semi-développée et topologique du (des) alcool(s) :
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
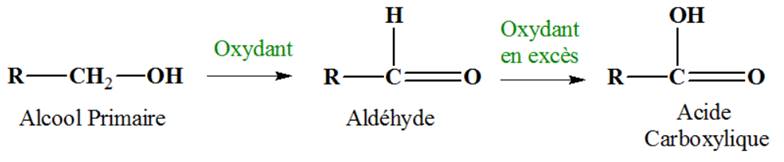
VIII- Oxydation ménagée des
alcools.
|
- Une oxydation ménagée est une oxydation qui s’effectue sans rupture de la chaine carbonée. - La chaine carbonée est conservée. |
►Exemple : lors de la combustion complète de l’éthanol, il
se forme du dioxyde de carbone et de l’eau.
- Écrire l’équation bilan de la réaction :
|
CH3CH2OH
+ 3 O2 →
2 CO2 + 3 H2O |
- Ici, il s’agit d’une oxydation brutale. La chaine carbonée est
détruite.
2)- Tests des
aldéhydes et les cétones.
a)-
Test commun : Test à la 2,4 D.N.P.H
|
- La
D.N.P.H est l’abréviation de 2,4‑dinitrophénylhydrazine.
- La solution s’obtient en dissolvant 4g de D.N.P.H (composé solide jaune) dans 20 mL d’acide sulfurique concentré, 30 mL d’eau distillée et
100 mL d’éthanol. ►Expérience :
- 1 à 2 mL de solution de
D.N.P.H - Et ajouter quelques gouttes d’un composé carbonylé (éthanal pour
l’aldéhyde et propanone pour l’acétone), puis agiter. ►Interprétation : - Résultat du test : - Les aldéhydes et les cétones donnent un précipité jaune-orangé
avec la 2,4 D.N.P.H. - Ce test est négatif pour les acides carboxyliques. |

b)-
Test à la Liqueur de Fehling.
|
- On mélange une solution de sulfate de cuivre II et une solution
de tartrate double de sodium et de potassium (sels de Seignette).
- La solution obtenue est appelée Liqueur de Fehling.
- C’est une solution basique qui contient des ions
Cu2+ complexés
par les ions tartrate
T2–. - Le complexe obtenu est noté [Cu T2]2–. ►Expérience :
- 2 mL de solution de Liqueur de Fehling. - Ajouter 1mL d’un aldéhyde (éthanal). - Chauffer doucement si nécessaire et agiter (Attention aux
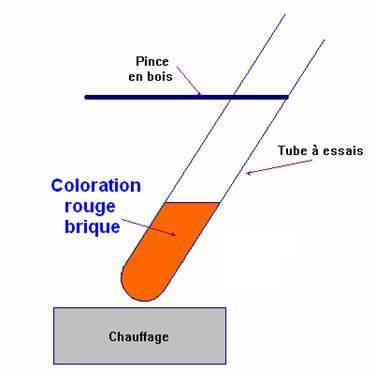
projections). ►Interprétation : - Résultat du test : - Ce test est caractéristique des aldéhydes. - Dans un tube à essai, on verse environ 2mL de liqueur de Fehling (solution de couleur bleue). - On ajoute environ 1mL de la solution
d'éthanal (solution incolore) (aldéhyde). - On chauffe légèrement à la flamme du bec Bunsen en maintenant le
tube avec une pince en bois. - On observe la formation d'un précipité rouge brique dans le tube
contenant l'éthanal. |
|
|

3)- Oxydation
ménagée des alcools primaires.
|
- Première étape : - Dans un tube à essai N° 1 contenant du propan-1-ol, on ajoute une solution acidifiée de permanganate de potassium. - La
coloration violette due aux ions permanganate disparaît progressivement. - On laisse reposer le mélange réactionnel. Il apparaît deux phases. - Une phase organique située au-dessus et une phase aqueuse.
- On prélève un peu de la phase organique que l’on verse dans deux
tubes à essai A et
B. - Dans le tube à essais
A, on réalise le test à la
2,4-D.N.P.H et dans le tube B, le test à la Liqueur de Fehling. - Les deux tests sont positifs. - Questions : - Comment interpréter l’évolution de la coloration dans le mélange
réactionnel ? - Quelle est la nature de l’espèce chimique formée ? - Donner sa
formule semi-développée. - Écrire les demi-équations électroniques (on donne le couple
MnO4- /
Mn2+) - En déduire l’équation chimique correspondante. |
|
- Réponses :
- Lors de la réaction, les ions permanganate (teinte
violette) sont réduits en ions manganèse II (incolore). - Comme les deux tests sont positifs, il s’agit d’un aldéhyde. Comme l’oxydation est ménagée, la chaine carbonée est conservée. On obtient du propanal
- CH3─CH2─CHO
ou
|
|
- Deuxième étape :
- On verse un excès de solution acidifiée de permanganate de potassium dans le tube à essai N° 1 contenant du propan-1-ol. - On observe toujours la disparition de la coloration violette. - Si l’excès
est trop important, la coloration violette persiste. - Si on prélève un peu de solution organique et que l’on réalise
les tests précédents, ils sont tous les deux négatifs. - Comment interpréter la disparition de la coloration lorsque l’on
ajoute un excès de solution de permanganate de potassium ? |
|
-
Réponses :
- Lors de la réaction, les ions permanganate (teinte
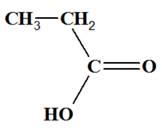
violette) sont réduits en ions manganèse II (incolore). - Comme les deux tests sont négatifs, il ne s’agit ni d’un aldéhyde, ni d’une cétone. Comme l’oxydation est ménagée, la chaine carbonée est conservée. On obtient un
acide carboxylique : l’acide propanoïque - CH3─ CH2─ COOH
ou
|
|
- L’oxydation ménagée d’un alcool primaire donne la formation d’un aldéhyde, puis d’un acide carboxylique si l’oxydant est introduit en
excès. |
4)- Oxydation
ménagée des alcools secondaires.
|
- Dans un tube à essai N°
1 contenant du propan-2-ol, on
ajoute une solution acidifiée de permanganate de potassium. - La coloration violette due aux ions permanganate disparaît
progressivement. - On laisse reposer le mélange réactionnel. Il apparaît deux phases. - Une phase organique située au-dessus et une phase aqueuse.
- On prélève un peu de la phase organique que l’on verse dans deux
tubes à essai A et
B. - Dans le tube à essais
A, on réalise le test à la
2,4-D.N.P.H et dans le tube B, le test à la Liqueur de Fehling. - Le test à la 2,4-D.N.P.H est positif et celui à la Liqueur de
Fehling est négatif. - Questions : - Comment interpréter l’évolution de la coloration dans le mélange
réactionnel ? - Quelle est la nature de l’espèce chimique formée ? - Donner sa
formule semi-développée. - Écrire les demi-équations électroniques (on donne le couple
MnO4- /
Mn2+) - En déduire l’équation chimique correspondante. |
|
- Réponses :
- Lors de la réaction, les ions permanganate (teinte
violette) sont réduits en ions manganèse II (incolore). - Comme le test à la
D.N.P.H est positif, on est en
présence d’un composé carbonylé - Comme le test la Liqueur de Fehling est négatif, il
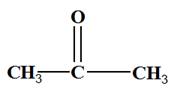
ne s’agit pas d’un aldéhyde. - On est en présence d’une cétone - Comme l’oxydation est ménagée, la chaine carbonée est conservée. - On obtient de la propanone -
|
- L’oxydation d’un alcool secondaire conduit à la formation d’une
cétone.
5)- Oxydation des
alcools tertiaires.
|
- Un alcool tertiaire ne subit pas d’oxydation ménagée. |
IX-
Un polyalcool particulier : le glycérol.
|
- Le glycérol possède trois groupes hydroxyle
– OH. - Ces groupes hydroxyle sont portés par des carbone tétragonaux. - Le glycérol est un triol, il fait partie de
la famille des alcools. - Le
glycérol
est un trialcool
: le propan-1, 2, 3 – triol. |
a)-
Formation d’un corps gras et composition d’un corps gras.
|
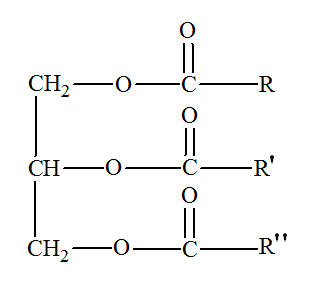
►Les corps gras : - Un corps gras est un triester d'acide gras et du glycérol. - Les
corps gras sont encore appelés triglycérides. - Les triglycérides ou corps gras sont des
triesters des acides gras et du glycérol. - Les triglycérides sont dits simples si
R = R' = R''.
Sinon les triglycérides sont mixtes. - Les triglycérides possèdent trois groupes ester : - Représentation du groupe ester : |
|
|
|
- Représentation des différents constituants.
|
Glycérol |
Corps gras |
Acides gras |
►
Exemples d’acide gras :
|
-
Un acide gras
est un acide carboxylique
à chaîne linéaire, saturée ou non, possédant en général un nombre pair
d'atomes de carbone, entre 4 et 22 - S’il comporte au moins une double liaison, l’acide gras est dit
insaturé. - Il est dit saturé dans le cas contraire : - Exemple :
|
|
Acide gras |
Formule semi-développée |
Formule
simplifiée |
|
Acide α-linolénique |
CH3
– CH2
– (CH = CH – CH2)3
– (CH2)6 – COOH |
C17H29
–
COOH |
|
Acide linoléique |
CH3
–
(CH2)4
–
(CH = CH
–
CH2)2
–
(CH2)6
–
COOH |
C17H31
–
COOH |
|
Acide oléique |
CH3
–
(CH2)7
–
CH
= CH
–
(CH2)7
–
COOH |
C17H33
–
COOH |
|
Acide stéarique |
CH3
–
(CH2)16
–
COOH |
C17H35
–
COOH |
-
Acide gras saturé : Acide palmitique :
CH3
– (CH2)14
– COOH
-
Acide gras insaturé :
|
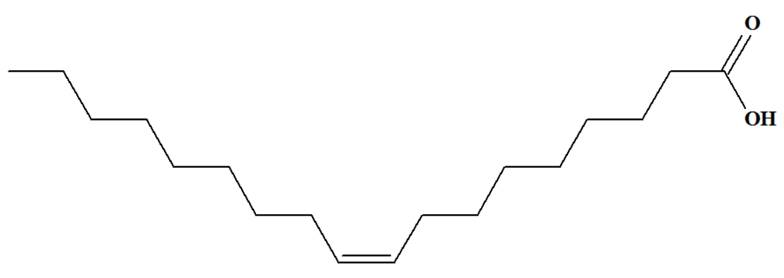
Acide oléique : Quelques
représentations de la molécule. CH3 –
(CH2)7–CH = CH –
(CH2)7 – COOH
Acide (Z)
octadéca-9-énoïque |
►
Synthèse d’un corps gras :
|
- C’est une réaction d’estérification : elle résulte de l’action
d’un acide gras sur le glycérol, qui est un trialcool. - Lorsque le glycérol (trialcool : le propan-1, 2, 3 -triol) réagit avec des acides gras (acides carboxyliques), il se forme des triesters,
aussi appelés triglycérides ou lipides. - Exemple : Réaction entre l’acide oléique et le glycérol |
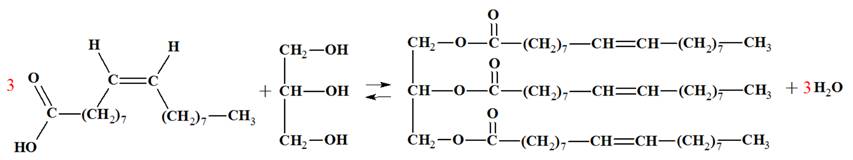 |
|||
| Acide oléique |
Glycérol | Oléine | eau |
|
- Le glycérol intervient dans la réaction de saponification. - Le glycérol est un sous- produit de la réaction de
saponification. - Le mot saponification vient du latin sapo qui signifie « savon ». - C’est l’une des plus vieilles réactions chimiques connues. - Elle permet la fabrication des savons à partir d’esters
naturels présents dans les corps gras d’origine animale ou végétale. - Les corps gras font partie de composés organiques, les lipides présents dans les tissus animaux et végétaux. - Ce sont des lipides simples caractérisés par leur insolubilité dans l’eau et leur toucher onctueux. - L’Histoire des corps gras se confond avec celle de l’Humanité. - On retrouve des lampes à huile et des chandelles chez les Égyptiens (3000 ans A.V J.C). - Ils utilisaient les huiles comme lubrifiant : huile de palme, huile d’olive. - Homère mentionne l’usage de l’huile d’olive pour
faciliter le tissage des fibres. - La fabrication du savon était connue du temps des Phéniciens plusieurs siècles avant notre ère. -
Pline (le vieux) décrit
les savons et spécifie même qu’il y en a des durs et des mous. - Ce n’est que vers 1815 que Michel Eugène CHEVREUL (1786-1889) prouve la nature chimique exacte des corps gras. - Il décrit ses travaux dans l’ouvrage paru en 1823 :
Recherche chimique sur les corps gras
d’origine animale. ►Réaction de saponification : - Équation bilan de la réaction de saponification d’un corps gras |
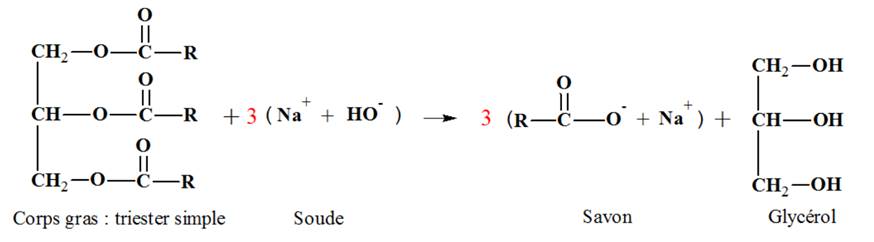
|
-
De la
structure aux propriétés des alcanes et des alcools. -
Les
grandes catégories de réactions chimiques. |
|
|
|
|



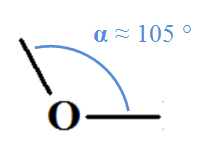










































 ou
ou
 ou
ou