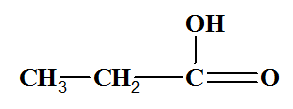|
Chim. N° 09 |
Synthèses organiques. Cours. |
|
|
Mots clés : Tests des aldéhydes, tests des cétones, tests des composés carbonylés, DNPH, Liqueur de Fehling, oxydation ménagée des alcools, alcool primaire, alcool secondaire, alcool tertiaire, synthèse de la propanone, acétone, propan-2-one, synthèse de l'acide benzoïque, acide benzoïque, distillation fractionnée, montage à reflux, tableau d'avancement, réactif limitant, avancement maximal, caractère réducteur des aldéhydes, le glucose, réactif de Tollens, nitrate d'argent ammoniacal, miroir d'argent, réactif de SCHIFF, QCM, oxydation d'un alcool, équation d'oxydoréduction, rendement, oxydation du cyclohexanol, identification de composés oxygénés, la menthone, ... |
|
|
|
QCM 01 Questy pour s'auto-évaluer. QCM 02 Questy pour s'auto-évaluer.
|
|
Exercices : énoncé avec correction a)- Exercice 6 page 328. Caractériser des aldéhydes et des cétones.b)- Exercice 8 page 328. Prévoir le produit d’oxydation d’un alcool.c)- Exercice 10 page 328. Écrire des équations d’oxydoréduction.d)- Exercice 12 page 329. Déterminer un rendement.e)- Exercice 14 page 329. Oxydation du cyclohexanol.f)- Exercice 16 page 329. Identification de composés oxygénés.g)- Exercice 19 page 330. Un arôme : la menthone. TP Chimie N° 13 Oxydation ménagée des alcools. |
I- Tests des aldéhydes et les cétones.
1)- Test commun : Test à la 2,4 D.N.P.H
a)- Préparation de la solution de D.N.P.H.
- La D.N.P.H est l’abréviation de 2,4‑dinitrophénylhydrazine.
- La solution s’obtient en dissolvant 4g de D.N.P.H (composé solide jaune) dans 20 mL d’acide sulfurique concentré, 30 mL d’eau distillée et 100 mL d’éthanol.
b)- Expérience :
![]() Dans un tube à essais introduire :
Dans un tube à essais introduire :
- 1 à 2 mL de solution de D.N.P.H
- Et ajouter quelques gouttes d’un composé carbonylé (éthanal pour l’aldéhyde et propanone pour l’acétone), puis agiter.
c)- Interprétation :
► Résultat du test :
- Les aldéhydes et les cétones donnent un précipité jaune-orangé avec la 2,4 D.N.P.H.
- Ce test est négatif pour les acides carboxyliques.

2)- Test
à
a)- Préparation de la solution :
- On mélange une solution de sulfate de cuivre II et une solution de tartrate double de sodium et de potassium (sels de Seignette).
- La solution obtenue est appelée Liqueur de Fehling.
- C’est une solution basique qui contient des ions Cu2+ complexés par les ions tartrate T2–.
- Le complexe obtenu est noté [Cu T2]2–.
b)- Expérience :
![]() Dans un tube à essais introduire :
Dans un tube à essais introduire :
- 2 mL de solution de Liqueur de Fehling.
- Ajouter 1mL d’un aldéhyde (éthanal).
- Chauffer doucement si nécessaire et agiter (Attention aux projections).
c)- Interprétation :
► Résultat du test :
- Ce test est caractéristique des aldéhydes.
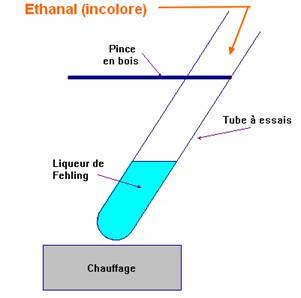
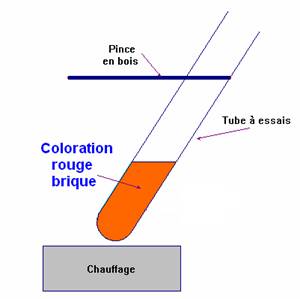
- Dans un tube à essai, on verse environ 2 mL de liqueur de Fehling (solution de couleur bleue).
- On ajoute environ 1 mL de la solution d'éthanal (solution incolore) (aldéhyde).
- On chauffe légèrement à la flamme du bec Bunsen en maintenant le tube avec une pince en bois.
- On observe la formation d'un précipité rouge brique dans le tube contenant l'éthanal.
|
|

II- Oxydation ménagée des alcools.
- Une oxydation ménagée est une oxydation qui s’effectue sans rupture de la chaine carbonée.
- La chaine carbonée est conservée.
- Exemple : lors de la combustion complète de l’éthanol, il se forme du dioxyde de carbone et de l’eau.
- Écrire l’équation bilan de la réaction :
|
CH3CH2OH + 3 O2 → 2 CO2 + 3 H2O |
- Ici, il s’agit d’une oxydation brutale. La chaine carbonée est détruite.
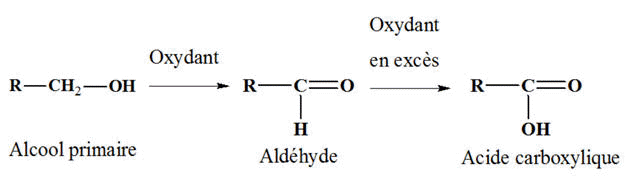
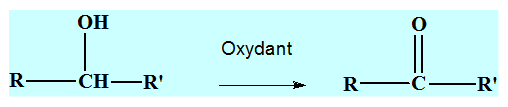
2)- Oxydation ménagée des alcools primaires.
- Première étape :
- Dans un tube à essai N° 1 contenant du propan-1-ol, on ajoute une solution acidifiée de permanganate de potassium.
- La coloration violette due aux ions permanganate disparaît progressivement.
- On laisse reposer le mélange réactionnel. Il apparaît deux phases. Une phase organique située au-dessus et une phase aqueuse.
- On prélève un peu de la phase organique que l’on verse dans deux tubes à essai A et B.
-
Dans le tube à essai A, on réalise le test à la
2,4-D.N.P.H et dans le tube B, le test à
- Les deux tests sont positifs.
- Questions :
- Comment interpréter l’évolution de la coloration dans le mélange réactionnel ?
- Quelle est la nature de l’espèce chimique formée ? Donner sa formule semi-développée.
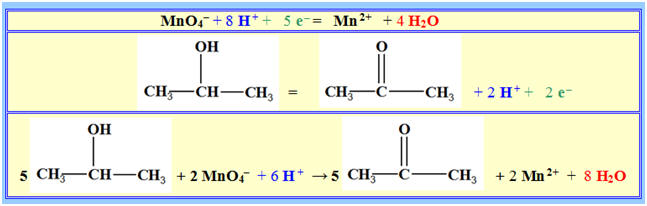
- Écrire les demi-équations électroniques (on donne le couple MnO4- / Mn2+)
- En déduire l’équation chimique correspondante.
|
- Réponses : - Lors de la réaction, les ions permanganate (teinte violette) sont réduits en ions manganèse II (incolore). - Comme les deux tests sont positifs, il s’agit d’un aldéhyde. - Comme l’oxydation est ménagée, la chaine carbonée est conservée. On obtient du propanal -
CH3─CH2─CHO ou
|
- Deuxième étape :
- On verse un excès de solution acidifiée de permanganate de potassium dans le tube à essai N° 1 contenant du propan-1-ol.
- On observe toujours la disparition de la coloration violette.
- Si l’excès est trop important, la coloration violette persiste.
- Si on prélève un peu de solution organique et que l’on réalise les tests précédents, ils sont tous les deux négatifs.
- Comment interpréter la disparition de la coloration lorsque l’on ajoute un excès de solution de permanganate de potassium ?
|
- Réponses : - Lors de la réaction, les ions permanganate (teinte violette) sont réduits en ions manganèse II (incolore). - Comme les deux tests sont négatifs, il ne s’agit ni d’un aldéhyde, ni d’une cétone. - Comme l’oxydation est ménagée, la chaine carbonée est conservée. - On obtient un acide carboxylique : l’acide propanoïque -
CH3─ CH2─ COOH
ou
|
- L’oxydation ménagée d’un alcool primaire donne la formation d’un aldéhyde, puis d’un acide carboxylique si l’oxydant est introduit en excès.
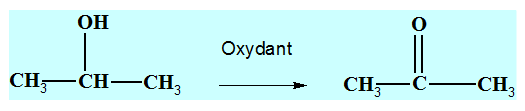
3)- Oxydation ménagée des alcools secondaires.
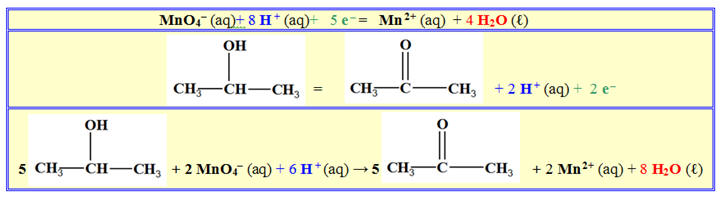
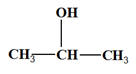
- Dans un tube à essai N° 1 contenant du propan-2-ol, on ajoute une solution acidifiée de permanganate de potassium.
- La coloration violette due aux ions permanganate disparaît progressivement.
- On laisse reposer le mélange réactionnel. Il apparaît deux phases. Une phase organique située au-dessus et une phase aqueuse.
- On prélève un peu de la phase organique que l’on verse dans deux tubes à essai A et B.
-
Dans le tube à essai A, on réalise le test à la
2,4-D.N.P.H et dans le tube B, le test à
-
Le test à la 2,4-D.N.P.H est positif et celui à
- Questions :
- Comment interpréter l’évolution de la coloration dans le mélange réactionnel ?
- Quelle est la nature de l’espèce chimique formée ? Donner sa formule semi-développée.
- Écrire les demi-équations électroniques (on donne le couple MnO4- / Mn2+)
- En déduire l’équation chimique correspondante.
|
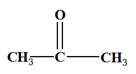
- Réponses : - Lors de la réaction, les ions permanganate (teinte violette) sont réduits en ions manganèse II (incolore). - Comme le test à la D.N.P.H est positif, on est en présence d’un composé carbonylé -
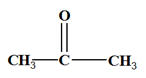
Comme le test - On est en présence d’une cétone - Comme l’oxydation est ménagée, la chaine carbonée est conservée. - On obtient de la propanone -
|
- L’oxydation d’un alcool secondaire conduit à la formation d’une cétone.
4)- Oxydation des alcools tertiaires.
- Un alcool tertiaire ne subit pas d’oxydation ménagée.
III- Synthèse d’une cétone : la propan–2–one. (Séance de travaux pratiques)
- L’acétone, ou propan – 2– one (M (Acétone) = 58,0 g / mol), est un solvant très utilisé dans l’industrie et dans la vie de tous les jours.
- Au laboratoire, on la prépare à partir du propan–2–ol (M (Alcool) = 60,0 g / mol).
- On oxyde le propan–2–ol par l’ion permanganate MnO4– (aq) en milieu acide.
- Le propan–2–ol est un alcool secondaire qui par oxydation donne la propan–2–one.
|
|
M g /
mol |
densité |
θéb
°C |
Pictogrammes |
|
Propan–2–ol |
60,0 |
0,785 |
82,4 |
|
|
Propan–2–one |
58,0 |
1,05 |
56 |
|
|
Permanganate de potassium |
|
|
|
|
|
Acide sulfurique |
|
|
|
|
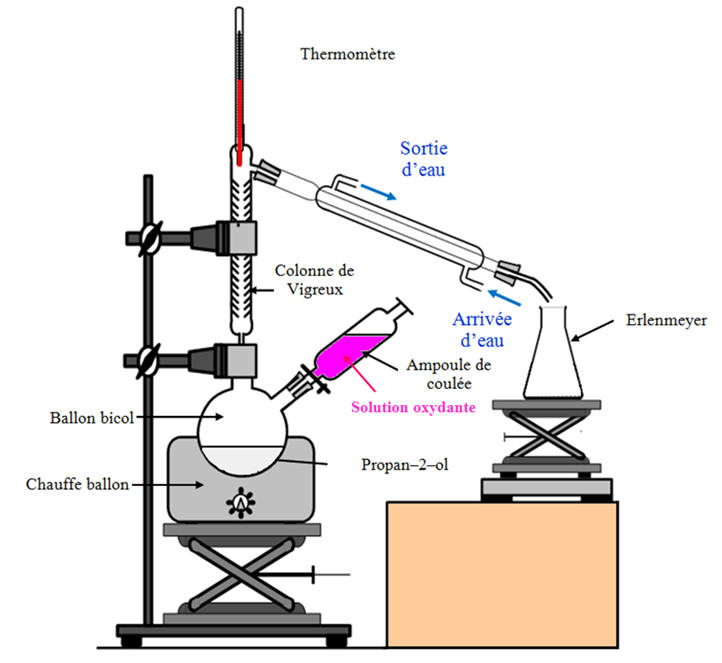
a)- Montage et protocole :
- Distillation fractionnée.
![]() Pour synthétiser la propan–2–one, on suit le
protocole expérimental suivant :
Pour synthétiser la propan–2–one, on suit le
protocole expérimental suivant :
![]() On réalise le montage à distiller ci-dessus.
On réalise le montage à distiller ci-dessus.
![]() Dans le ballon Bicol, on introduit un volume
V = 10,0
mL de propan–2–ol (densité d = 0,785) et on ajoute
quelques grains de pierre ponce pour réguler l’ébullition.
Dans le ballon Bicol, on introduit un volume
V = 10,0
mL de propan–2–ol (densité d = 0,785) et on ajoute
quelques grains de pierre ponce pour réguler l’ébullition.
![]() Dans l’ampoule de coulée, on introduit 140 mL
d’une solution aqueuse à 0,40 mol / L de permanganate de
potassium et à 2,0 mol / L d’acide sulfurique.
Dans l’ampoule de coulée, on introduit 140 mL
d’une solution aqueuse à 0,40 mol / L de permanganate de
potassium et à 2,0 mol / L d’acide sulfurique.
![]() On porte le mélange à l’ébullition douce.
On porte le mélange à l’ébullition douce.
![]() On introduit goutte à goutte la solution oxydante
tout en maintenant l’ébullition.
On introduit goutte à goutte la solution oxydante
tout en maintenant l’ébullition.
![]() Lorsque l’addition de la solution oxydante est
terminée, on prolonge l’ébullition douce pendant une dizaine de
minutes.
Lorsque l’addition de la solution oxydante est
terminée, on prolonge l’ébullition douce pendant une dizaine de
minutes.
![]() Puis on augmente le chauffage.
Puis on augmente le chauffage.
![]() Les vapeurs montent dans la colonne de Vigreux et
atteignent le haut de la colonne.
Les vapeurs montent dans la colonne de Vigreux et
atteignent le haut de la colonne.
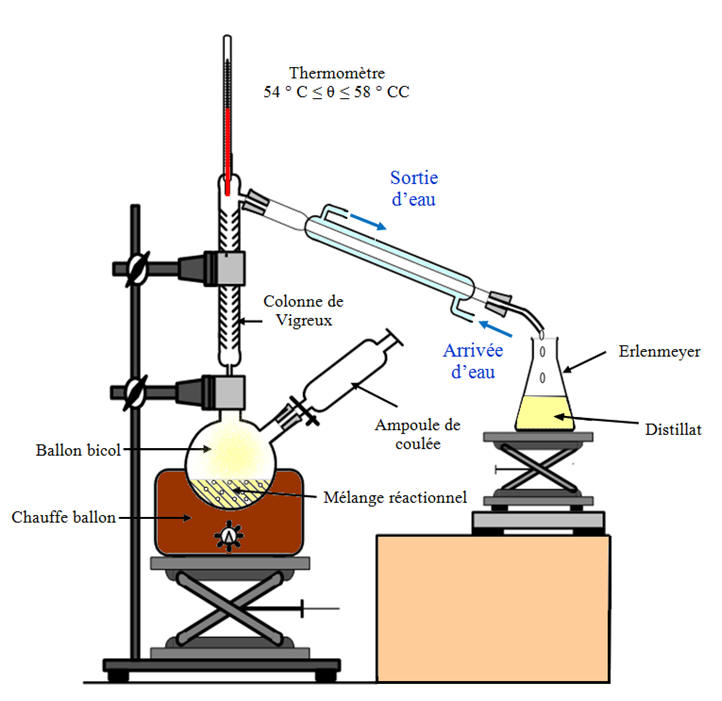
![]() On recueille le distillat, dans un erlenmeyer
préalablement pesé, tant que le thermomètre affiche une
température comprise entre 54 ° C et 58 ° C.
On recueille le distillat, dans un erlenmeyer
préalablement pesé, tant que le thermomètre affiche une
température comprise entre 54 ° C et 58 ° C.
![]() On arrête le chauffage dès que la température
s’élève, mais on conserve la circulation de l’eau dans le
réfrigérant.
On arrête le chauffage dès que la température
s’élève, mais on conserve la circulation de l’eau dans le
réfrigérant.
![]() On pèse à nouveau l’erlenmeyer pour en déduire la
masse m de distillat.
On pèse à nouveau l’erlenmeyer pour en déduire la
masse m de distillat.
![]() On réalise un test caractéristique pour vérifier
que le produit obtenu est bien la propan–2–one.
On réalise un test caractéristique pour vérifier
que le produit obtenu est bien la propan–2–one.
b)- Rendement de la synthèse :
- Le rendement d’une synthèse, noté ρ, est égal au quotient de la quantité de produit obtenu nexp, par la quantité maximale de produit attendu nmax.
-
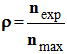
c)- Exploitation.
► La distillation fractionnée :
- Le mélange réactionnel contient : la solution oxydante qui est une solution aqueuse acidifiée de permanganate de potassium, le propan–2–ol et la propan–2–one lorsque la réaction a démarré.
- Température d’ébullition de l’eau : θeb = 100 ° C sous la pression atmosphérique.
- Température d’ébullition du propan–2–ol : θeb = 82 ° C sous la pression atmosphérique.
- Température d’ébullition de la propan–2–one : θeb = 56 ° C sous la pression atmosphérique.
- Les trois liquides étant miscibles, pour les séparer, il faut utiliser la distillation fractionnée.
- De plus, leurs températures d’ébullition sont suffisamment différentes pour que l’on puisse les séparer par distillation.
- Au cours de la distillation fractionnée, les réactifs et les produits se vaporisent et montent dans la colonne à distiller.
- Au cours de l'ascension, le mélange s'enrichi en corps le plus volatil (ici la propan–2–one).
- En tête de colonne, on obtient le corps le plus volatil pratiquement pur.
- Le distillat est ensuite condensé grâce au réfrigérant.
- La masse de distillat obtenue est mexp = 7,0 g.
► Demi-équations électroniques et Équation de la réaction :
► Tableau d’avancement de la réaction, réactif limitant et avancement maximal xmax :
![]() Quantités de matière initiales :
Quantités de matière initiales :
- Les ions hydrogène H+ (aq) sont en large excès.
- Quantité de matière initiale d’alcool :
-
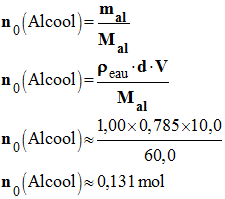
- n0 (Alcool) ≈ 0,131 mol
- Quantité de matière initiale d’ions permanganate :
- n0 (MnO4–) = C · V
- n0 (MnO4–) ≈ 140,0 x 10– 3 x 0,40
- n0 (MnO4–) ≈ 0,056 mol
- Tableau d’avancement :
|
Équa. |
5
|
+ 2 MnO4– (aq) |
+
6
H+ |
→ |
5
|
+ 2 Mn2+ (aq) |
+
8 H2O
(ℓ) |
|
|
mol |
mol |
mol |
|
mol |
mol |
mol |
|
État i |
n0 (Alcool) ≈ 0,131 |
n0 (MnO4–) ≈ 0,056 |
Excès |
|
0 |
0 |
– |
|
État x |
n0 (Alcool) – 5x |
n0 (MnO4–) – 2x |
|
|
5 x |
2 x |
– |
|
État max |
n0 (Alcool) – 5xmax |
n0 (MnO4–) – 2 xmax |
|
|
5 xmax |
2 xmax |
– |
![]() Réactif limitant et avancement maximal :
Réactif limitant et avancement maximal :
- Hypothèse 1 : l’alcool est le réactif limitant
- Alors : n0 (Alcool) – 5xmax1 = 0
- xmax1 = n0 (Alcool) / 5
- xmax1 ≈ 2,62 × 10– 2 mol
- xmax1 ≈ 26,2 mmol
- Hypothèse 2 : le réactif limitant est l’ion permanganate :
- n0 (MnO4–) – 2 xmax2 = 0
- xmax2 = n0 (MnO4–) / 2
- xmax2 ≈ 0,028 mol
- xmax2 ≈ 28 mmol
- Valeur de l’avancement maximal xmax :
- Il est égal à la plus petite des deux valeurs :
- xmax = xmax1 ≈ 26,2 mmol < xmax2 ≈ 28 mmol
- Le réactif limitant est l’alcool.
- Maintenant, on peut compléter le tableau d’avancement.
|
Équa. |
5
|
+ 2 MnO4– (aq) |
+
6
H+ |
→ |
5
|
+ 2 Mn2+ (aq) |
+
8 H2O
(ℓ) |
|
|
mmol |
mmol |
mmol |
|
mmol |
mmol |
mmol |
|
État i |
n0 (Alcool) ≈ 131 |
n0 (MnO4–) ≈ 56 |
Excès |
|
0 |
0 |
– |
|
État x |
n0 (Alcool) – 5x |
n0 (MnO4–) – 2x |
|
|
5 x |
2 x |
– |
|
État max xmax ≈ 26,2 |
0 |
3,6 |
|
|
131 |
51,4 |
– |
![]() Quantité de matière de propanone obtenue : c’est
la quantité maximale de propanone attendue.
Quantité de matière de propanone obtenue : c’est
la quantité maximale de propanone attendue.
- n (Propanone) ≈ 0,131 mol = 131 mmol
- Masse de propanone attendue :
-
m
(Propanone) = n (Propanone) .
M (Propanone)
- m (Propanone) ≈ 0,131x 58,0
- mmax = m (Propanone) ≈7,60 g
![]() Rendement de la réaction :
Rendement de la réaction :
- On a obtenu une masse mexp = 7,0 g.
-
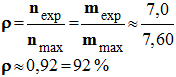
► Caractérisation :
- On peut réaliser le test à la D.N.P.H.
- On peut déterminer la valeur de sa densité.
IV- Synthèse d’un acide carboxylique : L’acide benzoïque. (Séance de travaux pratiques)
- L’acide benzoïque C6H5–COOH est utilisé comme conservateur (E 210) dans l’industrie agroalimentaire.
- Au laboratoire, on peut préparer l’acide benzoïque à partir de l’alcool benzylique C6H5 –CH2OH.
- On oxyde l’alcool benzylique, alcool primaire, par l’ion permanganate MnO4– (aq) en milieu basique.
- On utilise le chauffage à reflux pour accélérer la réaction.
- L’acide benzoïque est obtenu sous forme d’ions benzoate C6H5–COO– (aq) en solution aqueuse.
- Après séparation de la phase liquide, on ajoute de l’acide chlorhydrique.
- L’acide benzoïque précipite et on le récupère par filtration.
|
|
M g
/ mol |
densité |
θéb
°C |
Solubilité dans l’eau à 20 ° C |
Pictogrammes |
|
Alcool
benzylique |
108 |
1,042 |
205 |
40 g / L |
|
|
Acide benzoïque |
122 |
1,32 |
249 |
2,9 g / L |
|
|
Permanganate de potassium |
|
|
|
|
|
|
Acide chlorhydrique |
|
|
|
|
|
a)- Montage et protocole.
- Chauffage à reflux
![]() Pour synthétiser l’acide benzoïque, on suit le
protocole expérimental suivant :
Pour synthétiser l’acide benzoïque, on suit le
protocole expérimental suivant :
![]() Dans le ballon Bicol, on introduit un volume
V = 2,0
mL de d’alcool benzylique (densité
d = 1,042),
Dans le ballon Bicol, on introduit un volume
V = 2,0
mL de d’alcool benzylique (densité
d = 1,042),
![]() Puis 20 mL
d’une solution de soude (Na+ (aq) +
HO–
(aq)) et on ajoute quelques grains de pierre ponce pour réguler
l’ébullition.
Puis 20 mL
d’une solution de soude (Na+ (aq) +
HO–
(aq)) et on ajoute quelques grains de pierre ponce pour réguler
l’ébullition.
![]() Dans l’ampoule de coulée, on introduit 120 mL
d’une solution aqueuse à 0,25 mol / L de permanganate de
potassium (K+
(aq) +
MnO4–
(aq)).
Dans l’ampoule de coulée, on introduit 120 mL
d’une solution aqueuse à 0,25 mol / L de permanganate de
potassium (K+
(aq) +
MnO4–
(aq)).
![]() On porte le mélange à l’ébullition douce.
On porte le mélange à l’ébullition douce.
![]() On introduit goutte à goutte la solution oxydante
tout en maintenant l’ébullition.
On introduit goutte à goutte la solution oxydante
tout en maintenant l’ébullition.
![]() Lorsque l’addition de la solution oxydante est
terminée, on prolonge l’ébullition douce pendant une dizaine de
minutes.
Lorsque l’addition de la solution oxydante est
terminée, on prolonge l’ébullition douce pendant une dizaine de
minutes.
![]() Puis on arrête le chauffage, tout en maintenant la
circulation d’eau et on laisse refroidir.
Puis on arrête le chauffage, tout en maintenant la
circulation d’eau et on laisse refroidir.
![]() On réduit l’ion permanganate en excès par l’ajout
de quelques millilitres d’éthanol par l’ampoule de coulée
jusqu’à disparition de la teinte violette.
On réduit l’ion permanganate en excès par l’ajout
de quelques millilitres d’éthanol par l’ampoule de coulée
jusqu’à disparition de la teinte violette.
![]() On refroidit le ballon dans un bain d’eau froide.
On refroidit le ballon dans un bain d’eau froide.
![]() On filtre sur Büchner le mélange obtenu.
On filtre sur Büchner le mélange obtenu.
![]() On verse le filtrat dans un erlenmeyer placé dans
un cristallisoir qui contient de la glace pilée.
On verse le filtrat dans un erlenmeyer placé dans
un cristallisoir qui contient de la glace pilée.
![]() On ajoute délicatement une solution aqueuse
d’acide chlorhydrique de concentration C = 2,0 mol /L.
On ajoute délicatement une solution aqueuse
d’acide chlorhydrique de concentration C = 2,0 mol /L.
![]() Il se forme un précipité blanc d’acide benzoïque.
Il se forme un précipité blanc d’acide benzoïque.
![]() Une fois le mélange bien refroidi, on filtre sur
Büchner.
Une fois le mélange bien refroidi, on filtre sur
Büchner.
![]() On sèche bien le solide obtenu que l’on place dans
un verre de montre.
On sèche bien le solide obtenu que l’on place dans
un verre de montre.
![]() On pèse le solide une fois sec :
mexp
= 1,9 g
On pèse le solide une fois sec :
mexp
= 1,9 g
b)- Exploitation.
► Le chauffage à reflux :
- Il permet d’accélérer la réaction sans perte de matière.
► Demi-équations électroniques et Équation de la réaction :
|
4
( MnO4–
(aq) +
2 H2O
(ℓ)
+ 3 e
–
=
MnO2
(s)
+ 4
HO–
(aq)
) |
|
3
( C6H5 –CH2OH
(ℓ) +
5
HO–
(aq) =
C6H5–COO–
(aq)
+
4 e
–
+
4
H2O
(ℓ)
) |
|
3
C6H5 –CH2OH
(ℓ) +
4 MnO4–
(aq) →
3
C6H5–COO–
(aq) + 4
MnO2 (s) +
HO–
(aq) + 4 H2O
(ℓ) |
► Équation de la réaction entre l’ion benzoate et l’ion hydrogène :
|
C6H5–COO–
(aq) + 5
H+
(aq) →
C6H5–COOH
(s) |
► Tableau d’avancement, réactif limitant et avancement maximal.
![]() Quantités de matière initiales :
Quantités de matière initiales :
- Quantité de matière initiale d’alcool benzylique :
-
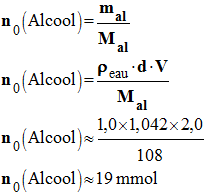
- n0 (Alcool) ≈ 19 mmol
- Quantité de matière initiale d’ions permanganate :
- n0 (MnO4–) = C · V
- n0 (MnO4–) ≈ 120,0 × 10– 3 × 0,25
- n0 (MnO4–) ≈ 30 mmol
- Tableau d’avancement :
|
Équa. |
3 C6H5 –CH2O (ℓ) |
+ 4 MnO4– (aq) |
→ |
3 C6H5–COO (aq) |
+ 4 MnO2 (s) |
+ HO– (aq) |
+ 4 H2O
(ℓ) |
|
|
mmol |
mmol |
|
|
mmol |
mmol |
mmol |
|
État i |
n0 (Alcool) ≈ 19 |
n0 (MnO4–) ≈ 30 |
|
0 |
0 |
– |
– |
|
État x |
n0 (Alcool) – 3x |
n0 (MnO4–) – 4x |
|
3 x |
4 x |
– |
– |
|
État max |
n0 (Alcool) – 3xmax |
n0 (MnO4–) – 4 xmax |
|
3 xmax |
4 xmax |
– |
– |
![]() Réactif limitant et avancement maximal :
Réactif limitant et avancement maximal :
- Hypothèse 1 : l’alcool est le réactif limitant
- Alors : n0 (Alcool) – 3 xmax1 = 0
- xmax1 = n0 (Alcool) / 3
- xmax1 ≈ 6,3 mmol
- Hypothèse 2 : le réactif limitant est l’ion permanganate :
- n0 (MnO4–) – 4 xmax2 = 0
- xmax2 = n0 (MnO4–) / 4
- xmax2 ≈ 7,5 mmol
- Valeur de l’avancement maximal xmax :
- Il est égal à la plus petite des deux valeurs :
- xmax = xmax1 ≈ 6,3 mmol < xmax2 ≈ 7,5 mmol
- Le réactif limitant est l’alcool.
- Maintenant, on peut compléter le tableau d’avancement.
|
Équa. |
3 C6H5 –CH2OH (ℓ) |
+ 4 MnO4– (aq) |
→ |
3 C6H5–COO– (aq) |
+ 4 MnO2 (s) |
+ HO– (aq) |
+
4 H2O
(ℓ) |
|
|
mmol |
mmol |
|
|
mmol |
mmol |
mmol |
|
État i |
n0 (Alcool) ≈ 19 |
n0 (MnO4–) ≈ 30 |
|
0 |
0 |
– |
– |
|
État x |
n0 (Alcool) – 3x |
n0 (MnO4–) – 4x |
|
3 x |
4 x |
– |
– |
|
État max |
0 |
4,8 |
|
19 |
25 |
– |
– |
![]() Quantité de matière d’ions benzoate obtenue :
c’est la quantité maximale d’ions benzoate attendue.
Quantité de matière d’ions benzoate obtenue :
c’est la quantité maximale d’ions benzoate attendue.
- nmax (Benzaoate) ≈ 19 mmol
![]() Quantité de matière d’acide benzoïque obtenue :
c’est la quantité maximale d’acide benzoïque attendue.
Quantité de matière d’acide benzoïque obtenue :
c’est la quantité maximale d’acide benzoïque attendue.
- Lors de la réaction :
|
C6H5–COO–
(aq) + 5
H+
(aq) →
C6H5–COOH
(s) |
- Les ions hydrogène H+ (aq) sont introduits en excès :
- En conséquence : nmax (Benzaoate) = nmax (Acide benzoïque) ≈ 19 mmol
- Masse d’acide benzoïque attendue :
- mmax (Acide benzoïque) = nmax (Acide benzoïque) . M (Acide benzoïque)
-
mmax (Acide benzoïque) ≈ 19
x 10–3
x 122
-
mmax (Acide benzoïque) ≈ 2,3 g
![]() Rendement de la réaction :
Rendement de la réaction :
- On a obtenu une masse mexp = 1,9 g.
-
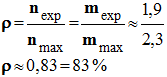
- Le rendement obtenu est de 83%.
- Il est inférieur à 100%. Plusieurs causes peuvent expliquer ce résultat :
- L'avancement maximal n'était peut-être pas atteint.
- De l'acide benzoïque reste dissout dans l'eau et ne cristallise pas.
- Le rinçage du précipité à l'eau distillée peut dissoudre une petite quantité d'acide benzoïque cristallisé.
- Pour purifier l’acide benzoïque obtenu, on peut utiliser une méthode assez simple : la recristallisation.
1)- Caractère réducteur des aldéhydes. Réduction du réactif de Tollens.
a)- Préparation de la solution.
- On verse goutte à goutte une solution d’ammoniac dans une solution de nitrate d’argent.
- Il apparaît un précipité brun d’oxyde d’argent Ag2O.
- Ce précipité se dissout dans un excès d’ammoniac.
- On obtient l’ion complexe diammineargent Ag(NH3)2+.
- Afin d’éviter tous les risques d’explosion, dus à AgN3, on ne conserve pas, à sec, le tube ayant contenu la solution.
- La solution obtenu est appelée Réactif de Tollens ou nitrate d’argent ammoniacal.
- La solution est basique.
b)-
Expérience :
![]() Dans un tube à essais introduire :
Dans un tube à essais introduire :
- 3 mL de solution de nitrate d’argent ammoniacal.
- Ajouter 1mL d’un aldéhyde (éthanal ou glucose).
- Chauffer doucement au Bain Marie.
c)- Interprétation.
- Faire les schémas du protocole expérimental en indiquant les observations et le nom et la couleur des réactifs et des produits.
- Images extraites de la vidéo.






- Écrire les demi-équations électroniques.
- Écrire l’équation-bilan de la réaction.
|
2
{
Ag(NH3)2+
(aq) +
e
–
=
Ag
(s) + 2 NH3 (aq)
} |
|
CH2OH–(CHOH)4–CHO
+ 3 HO–
= CH2–OH–(CHOH)4–COO–
+
2
H2O
+ 2 e
–
|
|
CH2OH–(CHOH)4–CHO
+ 2 Ag(NH3)2+
(aq) +
3 HO–
→ 2
Ag
(s) + CH2–OH–(CHOH)4–COO–
+ 2 H2O
+ 4 NH3 (aq) |
2)- Test au réactif de SCHIFF.
a)- Expérience :
![]() Dans un tube à essais introduire :
Dans un tube à essais introduire :
- 2 mL de réactif de SCHIFF (fuchsine décolorée par SO2) et bien refermer le flacon après usage.
- Ajouter quelques gouttes d’un composé carbonylé glacé (éthanal pour l’aldéhyde et propanone pour l’acétone), puis agiter.
b)- Interprétation.
- Faire les schémas du protocole expérimental en indiquant les observations et le nom et la couleur des réactifs et des produits.
- Le réactif de SCHIFF avec un peu d’éthanal donne une solution de coloration violette (le test est très sensible).
- Le test au réactif de SCHIFF est négatif avec la propanone.
- Attention, il faut travailler avec des solutions glacées car comme l’éthanal est très volatil et que le test est très sensible, on peut observer une coloration violette avec la propanone.
c)- Conclusion.
- Le réactif de SCHIFF permet de mettre en évidence les aldéhydes. Mais ce test n’est pas très fiable.
1)- QCM : Pour chaque question, indiquer la (ou les) bonne(s) réponse(s).
|
QCM 01 Questy pour s'auto-évaluer. QCM 02 Questy pour s'auto-évaluer.
|
2)- Exercices : Exercices : énoncé avec correction
a)- Exercice 6 page 328. Caractériser des aldéhydes et des cétones.
b)- Exercice 8 page 328. Prévoir le produit d’oxydation d’un alcool.
c)- Exercice 10 page 328. Écrire des équations d’oxydoréduction.
d)- Exercice 12 page 329. Déterminer un rendement.
e)- Exercice 14 page 329. Oxydation du cyclohexanol.
f)- Exercice 16 page 329. Identification de composés oxygénés.
g)- Exercice 19 page 330. Un arôme : la menthone.
|
|

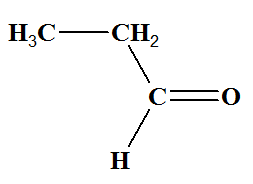 ou CH3─CH2─CH=O
ou CH3─CH2─CH=O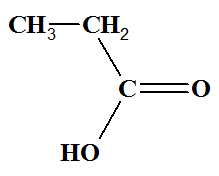 ou
ou