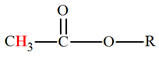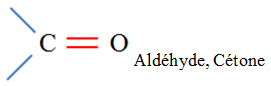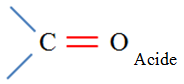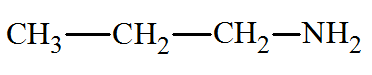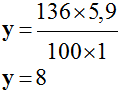|
Analyse spectrale. Exercices. |
|
|
|
I-
Exercice 8 page 104 : Utiliser un spectre pour déterminer
une couleur.
|
En réagissant avec les ions thiocyanate SCN–, les ions fer III, Fe3+ donnent un complexe coloré de formule [Fe(SCN)]2+
qui permet de détecter des traces d’ions Fe3+. Le spectre UV-visible d’une
solution diluée contenant cet ion est donné
ci-dessous. Quelle est la couleur de la
solution ?
|
|
Couleur de la solution : -
On peut déterminer la valeur de λmax.
- La solution absorbe principalement dans le violet, le bleu et un peu dans le vert
(principalement entre 380 nm et 500 nm).
-
La solution apparaît jaune-orangé.
Réalisé avec le logiciel
gratuit
CHROMA v.3.6.
|
II-
Exercice 10 page 104 : Reconnaître un groupe
caractéristique.
|
Reconnaître les groupes caractéristiques présents dans les molécules, dont les formules semi-développées sont représentées ci-dessous. Associer à chacun d’eux une fonction. |
|
a)-
Glycine :
b)-
Sérine :
|
|
c)-
Asparagine :
|
|
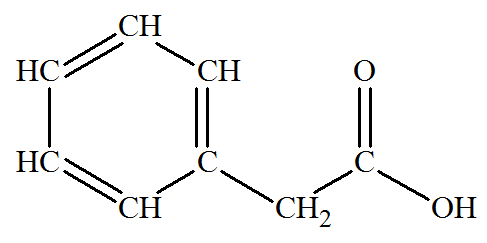
d)- Phéromone de la reine chez les abeilles : |
|
e)-
Arôme de
cannelle :
|
|
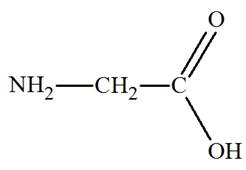
a)-
Glycine :
- On est en présence d’un acide α-aminé : acide aminoéthanoïque. b)- Sérine : - On est en présence d’un acide α-aminé possédant un groupe hydroxyle : - Acide 2-amino-3-hydroxypropanoïque. |
|
c)- Asparagine : - Acide 2,4-diamino-4-oxobutanoïque. |
|
d)- Phéromone de la reine chez les abeilles : Cliquer sur l'image pour l'agrandir - Acide (2 E)-9-oxodec-2-énoïque |
|
e)-
Arôme de cannelle :
- (2 E)-3-phénylprop-2-anal (aldéhyde cinnamique) |
III- Exercice 11 page
105 : Nommer des composés organiques.
|
1)- Repérer les groupes caractéristiques présents dans les composés, dont les formules semi-développées sont données ci-après. Associer à chacun d’eux une fonction : |
|
a)-
|
|
b)-
|
|
c)-
|
|
d)-
|
|
e)-
|
|
f)-
|
|
g)-
|
|
h)-
|
|
2)- Nommer ces composés. |
|
1)- Fonction chimique et nom |
|
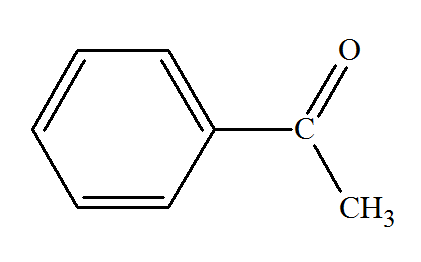
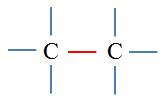
a)-
- Groupe C = C. - Nom : 2-méthylbut-2-ène. |
|
b)-
- Groupe hydroxyle : – OH : Fonction alcool - Nom : 5-méthylhexan-2-ol. |
|
c)-
- Groupe amino : – NH2 : Fonction amine - Nom : Pentan-2-amine |
|
d)-
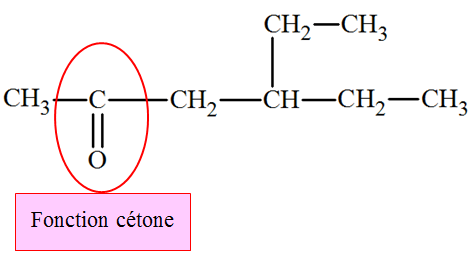
-
Groupe carbonyle
- Nom : 4-éthylhexa-2-one. |
|
e)-
-
Groupe carbonyle
- Nom : butanal. |
|
f)-
- Groupe amine – NH – ; Fonction amine - Nom : N-éthylbutan-2-amine. |
|
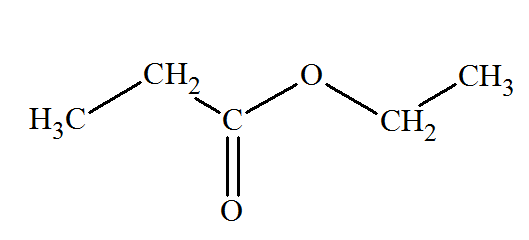
-
Groupe
ester
- Nom : 2-méthylbutanoate d’éthyle. |
|
h)-
-
Groupe
amide
- Nom : N-méthylbutanamide |
IV- Exercice 14 page
105 : écrire une formule topologique à partir d’un nom.
|
1)-
Écrire la formule topologique des composés
suivants : a)-
(E)-5méthylhex-3-ène. b)-
4-méthylpentan-2-ol. c)-
4-éthyl-2-méthylhexan-3-one. d)-
Acide 2-éthylpentonoïque. e)-
Propanoate de
1-méthyléthyle. f)-
3-méthylpentanoate de
2-méthylpropyle. g)-
N-méthyl-N-éthylpropan-2-amine. h)-
N-éthyl-3-méthylpentanamide. 2)-
Repérer les groupes caractéristiques présents, en
associant à chacun d’eux une fonction chimique. |
|
1)-
Formule topologique et fonction chimique des
composés suivants : a)-
(E)-2-méthylhex-3-ène.
-
Groupe alcène et
fonction alcène. b)-
4-méthylpentan-2-ol.
-
Groupe hydroxyle et
fonction alcool.
c)-
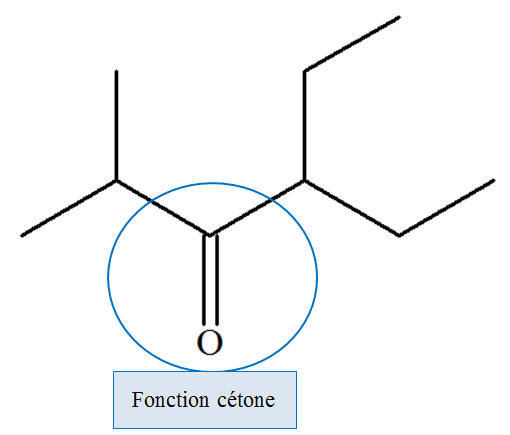
4-éthyl-2-méthylhexan-3-one.
-
Groupe carbonyle et
fonction cétone. d)-
Acide 2-éthylpentanoïque.
-
Groupe carboxyle et
fonction acide carboxylique.
e)-
Propanoate de
1-méthyléthyle.
-
Groupe ester et
fonction ester.
f)-
3-méthylpentanoate de
2-méthylpropyle.
-
Groupe ester et
fonction ester. g)-
N-méthyl-N-éthylpropan-2-amine.
-
Groupe amine et
fonction amine.
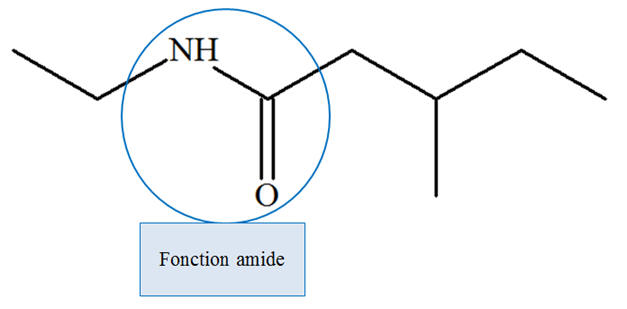
h)-
N-éthyl-3-méthylpentanamide.
-
Groupe amine et
fonction amide. |
V-
Exercice 16 page 105 : Reconnaître des bandes
d’absorption.
|
Un extrait
du spectre infrarouge de l’hexan-2-ol est donné
ci-dessous.
1)- Écrire la formule semi-développée de l’hexan-2-ol. En déduire le groupe caractéristique et la fonction
chimique de ce composé. 2)-
Identifier alors les bandes d’absorption notées (a),
(b), (c) et (d). |
|
1)- Formule semi-développée de l’hexan-2-ol. En déduire
le groupe caractéristique et la fonction chimique de
ce composé.
-
Groupe hydroxyle :
Fonction alcool : Alcool secondaire
2)-
Bandes d’absorption notées (a), (b), (c) et (d).
-
Bande d’absorption
notée (a) :
-
Bande d’absorption
notée (b) :
-
Bande d’absorption
notée (c) :
-
Bande d’absorption
notée (d) :
|
VI-
Exercice 18 page 106 : Utiliser un spectre pour
identifier une fonction (tableau).
|
On utilisera
pour cet exercice le tableau simplifié. Un extrait du spectre
infrarouge d’un composé
A est
donné ci-dessous.
1)-
Les molécules du composé A peuvent-elles, a
priori, posséder : a)-
Une liaison Ctét
– H ? b)-
Une liaison Ctri
– H ? c)-
Une liaison C – C ? d)-
Une liaison C = C ? e)-
Une liaison O – H ?
-
En déduire la
fonction du composé A. 2)-
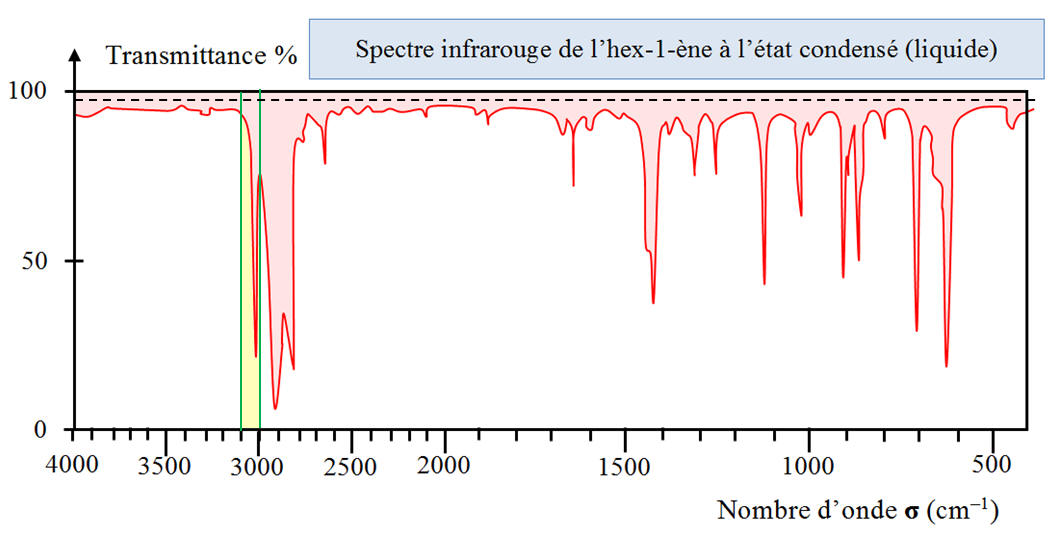
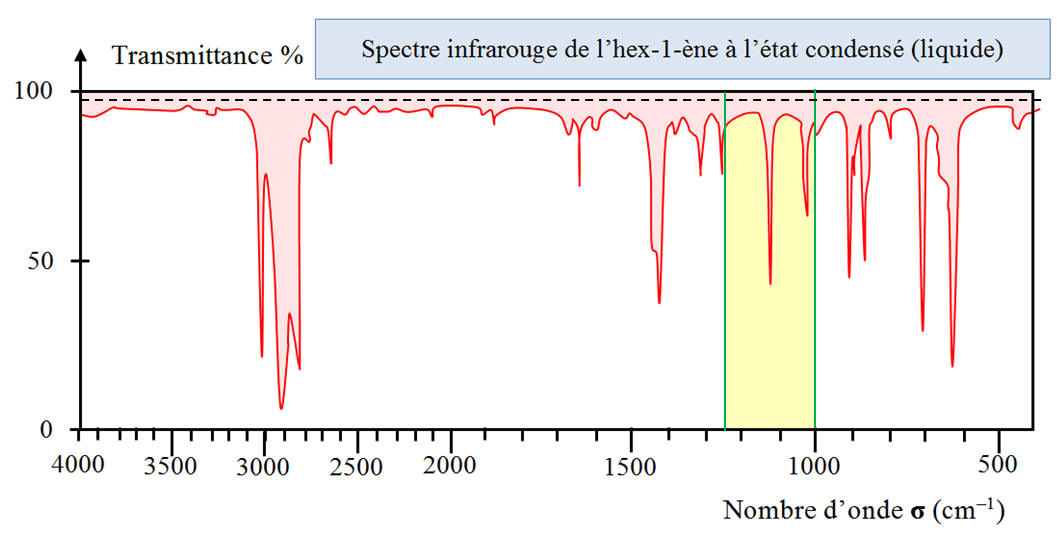
Le composé A est l’hex-1-ène. Justifier alors
les bandes d’absorption du spectre. |
|
1)-
Bandes de possède le composé A : a)-
Liaison Ctét
– H :
- On retrouve bien ces deux bandes sur le spectre.
- La molécule possède des
atomes de carbone tétragonaux liés
à des atomes
d’hydrogène. b)-
Liaison Ctri
– H :
-
On retrouve bien
cette bande sur le spectre.
-
La molécule possède
des atomes de carbone trigonaux liés à des
atomes
d’hydrogène. c)-
Liaison C – C :
-
On retrouve bien
cette bande (fine et forte) sur le spectre.
-
La molécule possède
des liaisons carbone-carbone. d)-
Liaison C = C :
-
On retrouve bien
cette bande (fine et moyenne) sur le spectre.
-
La molécule possède
une double liaison carbone-carbone. e)-
Liaison O – H :
-
On ne retrouve pas
ces bandes (forte) dans le spectre.
-
La molécule ne
possède pas de liaison O – H.
-
Fonction du composé
A.
-
Comme le composé A
possède une double liaison C = C,
il possède
la fonction alcène. 2)-
Justification des bandes d’absorption du spectre.
-
Formule
semi-développée de l’hex-1-ène.
-
Cette molécule
possède
-
Des liaisons Ctét
– H ;
-
Des liaisons Ctri
– H ;
-
Des liaisons C – C ;
-
Et une double liaison
C = C. |
VII- Exercice 21 page 106 : Attribuer des déplacements
chimiques.
|
1)-
L’éthanoate de méthyle
l’un à δ1 = 2,0 ppm, l’autre à δ2 = 3,7 ppm. Attribuer à chaque groupe méthyle
CH3
– son signal. 2)- Les protons des deux groupes méthyle CH3 – Br et CH3 – CH2 –Br résonnent, l’un à δ1 = 1,7 ppm, l’autre à δ2 = 2,7 ppm. Attribuer à chaque groupe méthyle
CH3
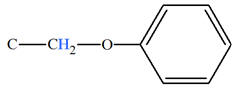
– son signal. 3)- Les protons des deux groupes méthylène – CH2 – de CH3 – O – CH2 – CH3 et C6H5 – O – CH2 – CH3 résonnent l’un à δ1 = 3,4 ppm, l’autre à δ2 = 4,3 ppm. Attribuer à
chaque groupe méthylène –
CH2
– son
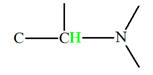
signal. 4)- Les protons des deux groupes méthyne – CH – de (CH3)2 CH – O – H et (CH3)2 CH – O – NH2 résonnent l’un à δ1 = 2,8 ppm, l’autre à δ2 = 3,9 ppm. Attribuer à chaque groupe méthyne –
CH
– son
signal. |
|
1)-
Groupe méthyle CH3
–. Tableau :
Groupe méthyle CH3
–
-
On trouve dans le
tableau :
2)-
Groupe méthyle CH3
–.
Tableau :
Groupe méthyle CH3
–
-
On trouve dans le
tableau :
3)-
Groupe méthylène – CH2
–. Tableau :
Groupe méthylène –
CH2
–
4)-
Groupe méthyne –
CH
–. Tableau :
Groupe méthyne
|
VIII- Exercice 23 page 107 : Relier la multiplicité du
signal au nombre de voisins.
|
1)- Préciser la multiplicité des signaux correspondant aux groupes méthyle CH3 – présents dans les extraits de
chaînes carbonées suivants : a)-
CH3
– CH2
– b)-
(CH3)3
C– c)-
(CH3)2
CH– 2)- Préciser la multiplicité des signaux correspondant aux groupes méthylène – CH2 – présents dans les molécules
suivantes : a)-
CH3
– CH2
– OH b)-
(CH3)2
CH
– CH2
– Br c)-
NH2
– CH2
– CH2
– NH2 d)-
HO – CH2
– CH2
– Cl 3)- Préciser la multiplicité des signaux correspondant aux groupes méthyne – CH – présents dans les molécules
ci-dessous : a)-
(CH3)2
CH
– Cl b)-
(CH3)3
CH c)-
HCCl3 d)-
(CH3)
CH
Cl2 |
|
1)- Multiplicité des signaux correspondant aux groupes méthyle CH3 – présents dans les extraits de
chaînes carbonées suivants : a)-
CH3
– CH2
– - Le groupe méthyle possède deux protons équivalents voisins.
- Le signal observé est un
triplet (2
+ 1). b)-
(CH3)3
C– - Le groupe méthyle ne possède pas de protons voisins.
- On observe un
singulet (0 + 1). c)-
(CH3)2
CH– - Le groupe méthyle possède un proton équivalent voisin.
- On observe un doublet (1
+ 1). 2)- Multiplicité des signaux correspondant aux groupes méthylène – CH2 – présents dans les molécules
suivantes : a)-
CH3
– CH2
– OH - Le groupe méthylène possède trois protons équivalents voisins.
- Le signal observé est un
quadruplet (3 +
1). b)-
(CH3)2
CH
– CH2
– Br - Le groupe méthylène possède un proton équivalent voisin.
- Le signal observé est un
doublet (1 + 1).
c)-
NH2
– CH2
– CH2
– NH2 - Le groupe méthylène ne possède pas de proton équivalent voisin.
- Le signal observé
est un singulet (0
+ 1).
- La molécule présente une symétrie.
d)-
HO – CH2
– CH2
– Cl ou HO – CH2
– CH2
– Cl - Chaque groupe méthylène possède deux protons équivalents voisins.
- Chaque signal
observé est un triplet (2
+ 1). 3)- Multiplicité des signaux correspondant aux groupes méthyne – CH – présents dans les molécules
ci-dessous : a)-
(CH3)2
CH
– Cl - Le groupe méthyne possède six protons équivalents voisins.
- Le signal observé est un
septuplet ou heptuplet (6
+ 1).
b)-
(CH3)3
CH - Le groupe méthyne possède neuf protons équivalents voisins.
- Le signal observé est un
décuplet (9
+ 1).
c)-
HCCl3 - Le groupe méthyne ne possède pas de proton équivalent voisin.
- Le signal observé
est un singulet (0
+ 1).
d)-
(CH3)
CH
Cl2 - Le groupe méthyne possède trois protons équivalents voisins.
- Le signal observé est un
quadruplet (3 +
1). |
IX-
Exercice 24 page 107 : Reconnaître des signaux par leur
multiplicité.
|
On dispose de deux spectres (I) et (II) de RMN ci-dessous. Ces spectres sont ceux de deux
composés choisis parmi les quatre composés
suivants :
a)-
(CH3)2
CH – NO2 b)-
Br – CH2 –
CH2
– CN c)-
CH3
– CH2 – O –
CH2 – CH3 d)-
CH3
– O – CH3 En exploitant
les multiplicités des signaux, attribuer chacun des spectres à son composé. |
|
a)-
Molécule de 2-nitropropane :
- Le spectre RMN de cette molécule comprend deux signaux.
- Pour des raisons de symétrie, les protons des
deux groupes
méthyle sont équivalents et donnent
lieu à un seul signal.
- Le proton du groupe (B) possède 6 protons équivalents voisins.
- Le signal
correspondant est un septuplet ou heptuplet (7 pics) - Les protons équivalents du groupe (A) possèdent un proton voisin.
- Le signal correspondant est un doublet (2
pics).
- Ceci est en accord
avec le spectre RMN (II).
- Je n’ai pas trouvé le
spectre RMN du 2-nitropropane,
mais le spectre du
chloro-2-propane est du même type.
b)-
La molécule de
3-bromopropanenitrile :
-
Cette molécule
possède deux groupes de protons équivalents : - Les protons équivalents du groupe (A) possèdent deux protons équivalents voisins.
- Le signal correspondant
est un triplet (3 pics). - De même, les protons équivalents du groupe (B) possèdent deux protons équivalents voisins.
- Le signal correspondant
est un triplet (3 pics).
-
Ceci n’est pas en
accord avec les spectres donnés. c)-
La molécule d’éther
diéthylique (éthoxyéthane) :
-
Pour des raisons de
symétrie, la molécule possède
deux groupes de
protons équivalents. - Les protons équivalents du groupe (A) possèdent deux protons équivalents voisins.
- Le signal correspondant
est un triplet (3 pics). - Les protons équivalents du groupe (B) possèdent trois protons équivalents voisins.
- Le signal correspondant
est un quadruplet (4 pics).
- Ceci est en accord
avec le spectre RMN (I).
d)-
- Pour des raisons de
symétrie, la molécule ne possède
qu’un groupe de
protons équivalents.
- Le spectre RMN ne
comprend qu’un seul signal.
- Ceci n’est pas en
accord avec les spectres donnés.
|
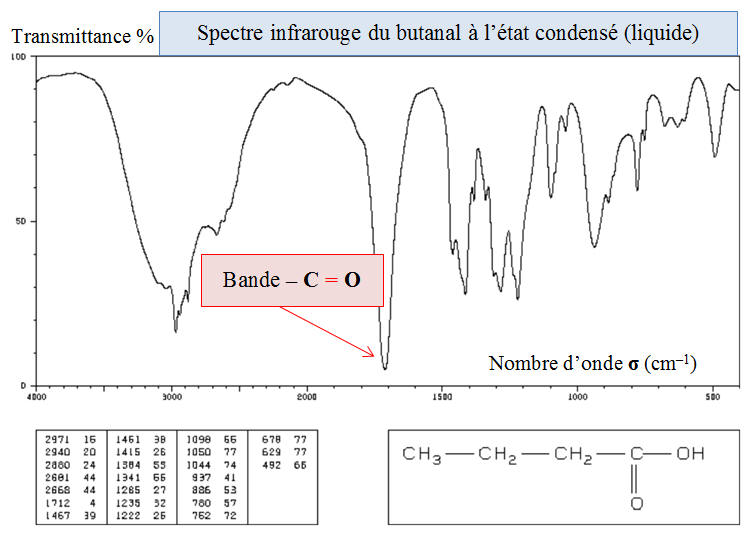
X-
Exercice 29 page 108 : Spectres infrarouge et oxydation.
|
Utilisation du
tableau simplifié : On réalise l’oxydation du buan-1-ol par une solution acidifiée de permanganate de potassium. Dans un premier temps, l’oxydant est introduit en défaut ; on admet alors
qu’il ne se forme qu’un seul produit
A, que
l’on extrait et purifie. Dans un second temps, on
utilise un excès d’oxydant ; un seul produit
B est
alors obtenu, extrait et purifié. On réalise le spectre infrarouge du butan-1-ol et des produits A et B.1)-
Écrire les formules semi-développées du butan-1-ol
et des produits A et B. 2)-
Quelles fonctions présentent ces trois espèces
chimiques ? 3)-
Indiquer les bandes caractéristiques permettant de
distinguer le butan-1-ol de ses deux produits
d’oxydation, en précisant leurs nombres d’ondes. 4)-
En déduire une méthode permettant de vérifier la
pureté des produits d’oxydation. |
|
1)-
Formules semi-développées du butan-1-ol et des
produits A et B.
2)-
Fonctions des trois espèces chimiques.
3)-
Bandes caractéristiques permettant de distinguer le
butan-1-ol des produits A et B.
-
Pour le butan-1-ol
-
La liaison C – O
(1070 cm–1 et 1450 cm–1) est
présente
dans les alcools,
les acides
carboxyliques,…
-
Pour le produit A :
Aldéhyde
-
Pour le produit B :
Acide carboxylique
-
Remarque :
-
Cette bande se
superpose avec celle des aldéhydes et des cétones. - La liaison C = O est présente dans de nombreuses molécules organiques telles que :
- les aldéhydes, cétones, acide
carboxyliques, esters, amides,…
-
La liaison C – O
(1070 cm–1 et 1450 cm–1) est
présente dans les alcools,
les acides
carboxyliques,… 4)-
Méthode permettant de vérifier la pureté des
produits d’oxydation :
- On peut réaliser le
spectre IR des produits de l’oxydation.
-
Le butanal est pur si
son spectre RMN ne présente pas
de bande
d’absorption entre 3200 cm–1 et 3650 cm–1.
-
Superposition des
trois spectres IR.
|
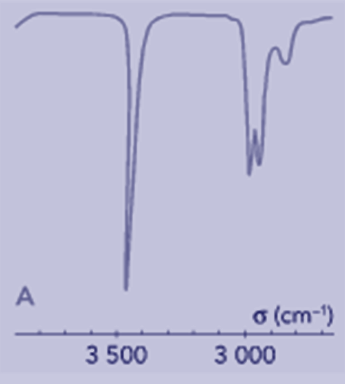
XI-
Exercice 31 page 108 : Spectre infrarouge d’acides
carboxyliques.
|
Les deux extraits de spectres infrarouges, A et B, ci-dessous sont ceux de l’acide butanoïque : A est le spectre en phase vapeur, B est le
spectre à l’état liquide. Interpréter la différence. |
|
►
En phase vapeur :
spectre A - Il n’y a pas de liaisons hydrogène entre les molécules d’acide butanoïque. - Dans ce cas on observe une bande fine et forte.
- La liaison O – H est dite libre, que
l’on note O – Hlib.
►
En phase condensée :
Phase liquide : Spectre
B
- À l’état liquide, il
existe des liaisons hydrogène entre les molécules
d’acide butanoïque.
-
La liaison O – H
se manifeste par une bande d’absorption forte et large de 3200 cm–1 à 3400 cm–1. - Les liaisons hydrogène établies entre les molécules d’acide butanoïque affaiblissent les liaisons covalentes O – H
et conduisent à un abaissement
du nombre
d’onde σO – H.
-
De plus, la bande
s’élargit, la liaison O – H est dans ce cas
dite associée,
on la note O – Hassocié. |
XII- Exercice 34 page 109 : à chacun son rythme.
|
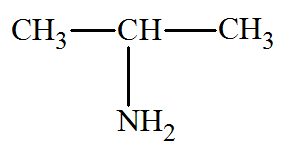
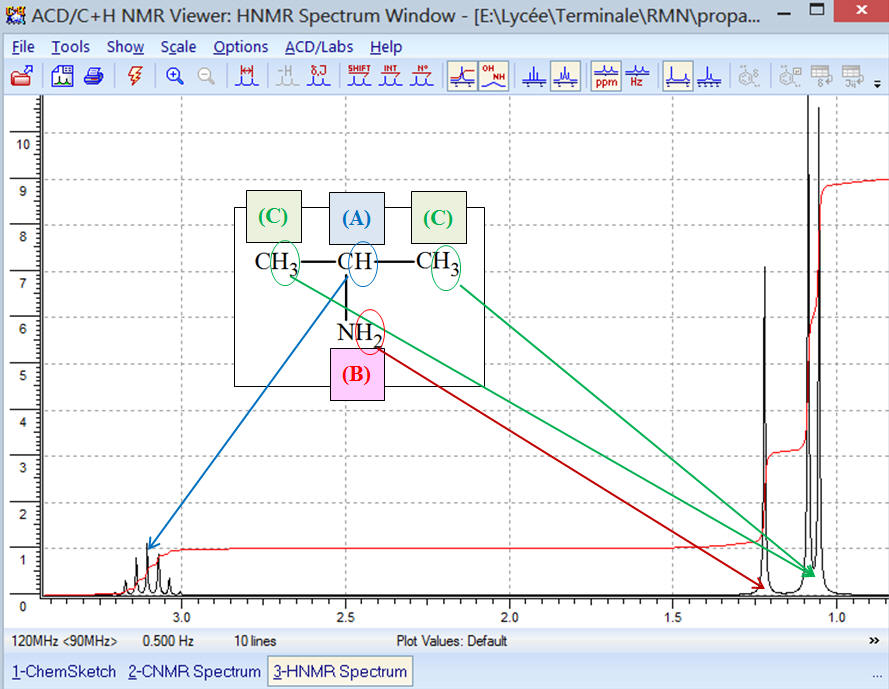
Tableau :
Déplacements
chimiques Le spectre
RMN d’un
composé A,
de formule C3H9N,
est donné ci-dessous. Certains signaux ont été zoomés
afin de les rendre plus visibles.
1)-
Écrire les formules semi-développées de tous les
isomères du composé A. 2)-
À l’aide de la courbe d’intégration, déterminer le
nombre de protons correspondant à chaque signal. 3)-
En appliquant la règle des (n+1)-uplets déterminer,
pour chaque signal, le nombre de protons voisins du
(ou des) proton(s) correspondant à ce signal. 4)-
Vérifier alors qu’une seule formule est compatible
avec ce spectre RMN. |
|
1)-
Formules semi-développées de tous les isomères du
composé A.
2)-
Nombre de protons correspondant à chaque signal.
-
Groupe (A) :
δA ≈ 3,10. Ce groupe comprend un
proton.
-
Groupe (B) :
δB ≈ 1,22. Ce groupe comprend deux
protons équivalents.
-
Groupe (C) :
δC ≈ 1,07. Ce groupe comprend six
protons équivalents. 3)-
Nombre de protons voisins du (ou des) proton(s)
correspondant à ce signal. - Signal du groupe A : Ce signal est constitué de 7 pics.
- Le groupe (A)
constitué d’un proton comprend 6 protons équivalents
voisins. - Signal du groupe (B) : - Ce signal est constitué d’un seul pic. - Le groupe (B) constitué de 2 protons équivalents ne possède pas de proton équivalent voisin
(le ou les protons peuvent
être portés par un hétéroatome : N, O,
S, …) - Signal du groupe (C) : - Ce signal est constitué de deux pics.
- Le groupe (C)
constitué de 6 protons équivalents comprend
1 proton
équivalent voisin. 4)-
Formule et spectre RMN.
-
La propan-2-amine est
la molécule qui correspond au spectre observé.
|
XIII- Exercice 39 page 111 : analyse élémentaire et
spectres.
|
Tableau déplacements chimiques : Les spectres infrarouges en phase vapeur et de RMN d’un composé A sont donnés ci-dessous. La masse molaire
M de ce
composé A
a été déterminée par spectrométrie de masse et sa
composition centésimale par analyse élémentaire. Ces mesures ont donné, pour le composé A, M = 136,0 g / mol et un pourcentage de 70,6 % de carbone, 5,90 % d’hydrogène et 23,5 % d’oxygène.
1)-
Déterminer la formule brute du composé A. 2)- Quelle hypothèse peut-on faire, sur la nature de la fonction présente dans le composé A, à partir du signal à δ = 12,2 ppm en RMN ? Le spectre
infrarouge confirme-t-il cette hypothèse ? 3)-
Exploiter toutes les données du spectre de RMN
et proposer une formule semi-développée pour le
composé A. 4)-
Commenter la forme de la bande IR à
σ = 3600 cm–1. |
-
-
-
-
Formule Brute : C8H8O2 2)-
Hypothèse sur la nature de la fonction présente dans
le composé A :
-
Signal à δ =
12,2 ppm en RMN :
-
Fonction acide ou
fonction énol ?
- L’étude du spectre IR indique qu’il s’agit d’un acide carboxylique
car il y a une bande d’absorption vers 1800 cm–1
due à la présence de la liaison – C
= 0. 3)-
Exploitation des données du spectre de RMN et
formule semi-développée pour le composé A. - Le spectre RMN comprend 3 signaux.
- Chaque signal comprend un pic.
-
La molécule possède 3
groupes de protons équivalents. - Les groupes ne possèdent pas de protons équivalents voisins
(ou ces
protons sont portés par un hétéroatome).
-
Avec la courbe
d’intégration, on peut déduire que :
-
Le groupe pour lequel
δ ≈ 12,2 ppm est constitué d’un proton
-
Le groupe
pour lequel δ ≈ 3,7 ppm est constitué de deux
protons
-
Le groupe pour lequel
δ ≈ 7,4 ppm est constitué de cinq protons.
-
Formule
semi-développée :
-
Nom : Acide
phényléthanoïque. 4)-
Commenter la forme de la bande IR à
σ = 3600 cm–1.
- En phase vapeur, il n’y a pas de liaison hydrogène entre les molécules d’acide phényléthanoïque qui sont toutes identiques
(bande fine et forte). Avec
|
XIV-
Exercice 41 page 112 : identifier une molécule.
|
Tableau déplacements chimiques :
A- Utilisation des spectres
Les spectres infrarouges et RMN d’un composé A de formule C8H10O sont donnés ci-dessous. La multiplicité des signaux
a été précisée.
1)-
Analyse du spectre infrarouge : a)- En justifiant la réponse, indiquer si l’analyse du spectre infrarouge permet d’envisager que le composé A soit un dérivé du benzène C6H6, c’est-à-dire qu’il présente un cycle aromatique. b)-
Ceci est-il confirmé par le
spectre RMN ? 2)-
Quelle pourrait être la fonction oxygénée de A ? 3)-
Exploiter toutes les données du spectre RMN
et proposer une formule semi-développée pour A. 4)-
On réalise l’oxydation de A, on obtient B. a)-
Quelle(s) modification(s)
observerait-on pour le spectre infrarouge en passant
de A à B ? b)- Comment peut-on, à l’aide du
spectre infrarouge, vérifier que B ne
contient pas A comme impuretés ?
B- Utilisation de données spectrales. Quatre isomères de même formule brute C5H10O2 sont caractérisés par les caractéristiques spectrales suivantes. Identifier et nommer ces
quatre composés. 1)-
Composé A :
2)-
Composé B :
3)-
Composé C :
4)-
Composé D :
|
|
A- Utilisation des spectres : 1)-
Analyse du spectre infrarouge : a)- Analyse du spectre
infrarouge et nature du composé
A.
- Bandes
caractéristiques :
- L’analyse du spectre infrarouge permet d’envisager que :
- Le composé A
soit un dérivé du benzène C6H6. b)-
Analyse du spectre RMN :
- Déplacements
chimiques :
- On observe un signal pour δ ≈ 7,3.
- Ce signal peut être attribué à
un groupe appartenant à
un cycle aromatique. 2)-
Fonction oxygénée de A :
- On n’observe pas de
bande :
- On observe une bande
pour δ ≈ 3300 cm–1.
- Il se peut que le
composé A, de formule brute C8H10O
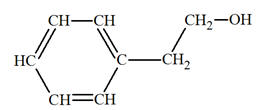
soit un alcool.
- Soit le
1-phényléthan-1-ol ou le 2-phényléthan-1-ol.
3)-
Formule semi-développée pour A à l’aide du
spectre RMN :
- Exploitation de la
courbe d’intégration :
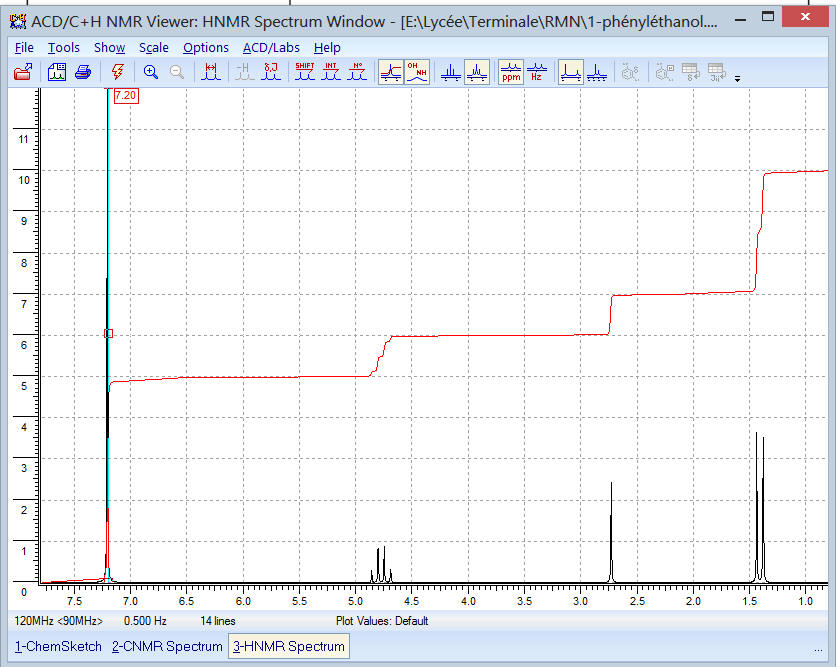
- Spectre réalisé avec
ACD/Labs :
- Le spectre RMN
comprend 4 signaux :
- Le groupe (A)
pour lequel δ ≈ 7,3 ppm, est constitué de 5
protons.
-
Le groupe (B)
pour lequel δ ≈ 4,7 ppm, est constitué d’un
proton.
-
Le groupe (C)
pour lequel δ ≈ 2,4 ppm, est constitué d’un
proton.
-
Le groupe (D)
pour lequel δ ≈ 1,4 ppm, est constitué de 3
protons. - Le signal du groupe (A) est un singulet, les 5 protons équivalents n’ont pas de protons équivalents voisins
- (Ce sont les 5
protons portés par le cycle benzénique). - Le signal du groupe (B) est un quadruplet.
- Il possède 3 protons équivalents
voisins. - Le signal du groupe (C) est un singulet.
- Il ne possède pas de protons
équivalents voisins.
-
Le groupe (D)
est un doublet. Il possède un proton équivalent
voisin.
4)-
Oxydation de A en B : a)- Modification du spectre
infrarouge en passant de A à B :
-
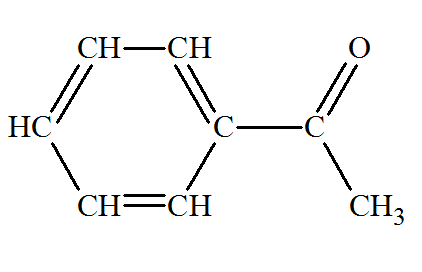
Le composé A :
1-phényléthan-1-ol : alcool secondaire
-
Par oxydation de A,
on obtient : une cétone, la 1-phényléthanone
ou
acétophénone.
- La liaison O – H se manifeste par une bande d’absorption forte
- et
large de 3200 cm–1à 3400 cm–1.
- Lors de l’oxydation du composé A, on obtient une cétone :
- Car on
est en présence d’un alcool secondaire. - La bande due à la liaison O – H disparaît et elle est remplacée par - une bande d’absorption forte et fine de 1650 cm–1à 1730 cm–1
- due à la liaison – C = O.
b)-
Vérification de la pureté de
B à l’aide du spectre IR. - Le composé B est pur, si le spectre IR de B ne présente pas
- de bande d’absorption vers σ ≈ 1700
cm–1.
B- Utilisation de données spectrales.
-
Identification et nom
des quatre composés A, B, C et
D
de formule brute C5H10O2
-
Quelques
isomères :
-
Composé A :
-
Il possède 3 groupes
de protons équivalents : - Le signal (A) comprend 6 protons équivalents et il possède
- un proton
équivalent voisin. - Le signal (B) comprend 3 protons équivalents,
- mais ne possède pas
de protons équivalents voisins.
-
On trouve dans le
tableau :
- Le signal (C) comprend 1 proton équivalent et
- il possède 6 protons
équivalents voisins.
Éthanoate de 1-méthyléthyle
-
Composé B :
-
Il possède 3 groupes
de protons équivalents : - Le signal (A) comprend 6 protons équivalents et il possède
- un proton
équivalent voisin. - Le signal (B) comprend 1 proton équivalent et il possède
- 6 protons
équivalents voisins. - Le signal (C) comprend 3 protons équivalents,
- mais ne possède pas
de protons équivalents voisins,
2-méthylpropanoate de méthyle
-
Composé (C) :
-
Il possède 3 groupes
de protons équivalents : - Le groupe (A) comprend 6 protons équivalents, mais ne possède pas
- de protons équivalents voisins. - Le groupe (B) comprend 3 protons équivalents, mais ne possède pas
- de protons équivalents voisins. - Le groupe (C) comprend 1 proton équivalent, mais ne possède pas
- de protons équivalents voisins.
-
On trouve bien dans
le tableau :
-
La liaison O – H
se manifeste par une bande d’absorption forte
et
large à 3400 cm–1.
-
La liaison – C = O
se manifeste par une bande d’absorption forte
et
large à 1740 cm–1.
3-hydroxy-3-méthylbutan-2-one
-
Composé (D) :
-
Il possède 4 groupes
de protons équivalents : - Le groupe (A) comprend 3 protons équivalents, et il possède
- 2
protons équivalents voisins. - Le groupe (B) comprend 3 protons équivalents, et il possède
- 2
protons équivalents voisins. - Le groupe (C) comprend 2 protons équivalents et il possède
- 3
protons équivalents voisins. - Le groupe (D) comprend 2 protons équivalents et il possède
- 3
protons équivalents voisins.
-
La liaison – C = O
se manifeste par une bande d’absorption forte
et
large à 1740 cm–1.
Propanoate d’éthyle |
|
|

























 ;
Fonction cétone
;
Fonction cétone
 ;
Fonction aldéhyde
;
Fonction aldéhyde

 :
Fonction ester.
:
Fonction ester.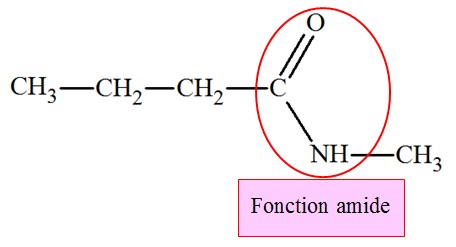
 :
Fonction amide.
:
Fonction amide.






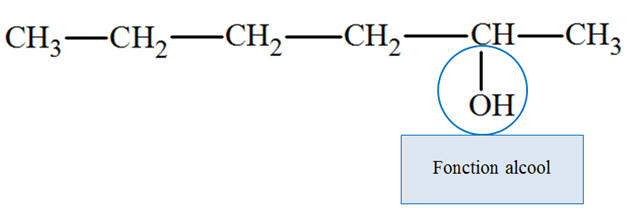
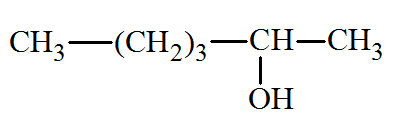


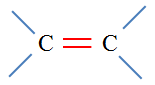



 ,
présente deux signaux correspondant,
,
présente deux signaux correspondant,