|
Chim. N° 06 |
De la structure aux propriétés des alcanes et des alcools. Cours. |
|
|
Mots clés : Structure des alcanes, propriétés des alcanes, structure des alcools, propriétés des alcools, alcanes, alcools, nomenclature des alcanes, nomenclature des alcools, Températures de changement d'état des alcanes, température de changement d'état de l'eau, températures de changement d'état des alcools, distillation fractionnée, miscibilité des alcools dans l'eau, densité des alcanes, solubilité des alcanes alcanes linéaires, alcanes ramifiés, QCM, nommer des alcanes, rechercher des isomères, isomères, reconnaître un alcool, nommer un alcool, interpréter les températures d'ébullition, comparer la solubilité des alcools, pourcentage massique et formule d'un alcool, masse volumique des alcanes, ... |
|
|
|
I-
Les alcanes et les alcools. |
|
II-
Évolution des températures de changement d’état.
1)- Températures de changement
d’état des
alcanes.
2)- Températures de
changement
d’état de l’eau. |
|
1)- Densité des alcanes linéaires
et
ramifiés :
2)- Solubilité des alcanes linéaires et
ramifiés dans différents solvants : |
|
Pour aller plus loin : Nomenclature en chimie organique Chimie organique (cours) TP chimie TS (Nomenclature) |
|
Les molécules ont été
réalisées avec le logiciel gratuit |
|
|
|
Exercices : énoncé avec correction a)- Exercice 8 page 196. Nommer des alcanes. b)- Exercice 9 page 196. Rechercher des isomères. c)- Exercice 11page 196. Reconnaître un alcool. d)- Exercice 12 page 196 Nommer des alcools. e)- Exercice 15 page 197. Classer les alcanes en fonction de leur température d’ébullition. f)- Exercice 16 page 196. Interpréter de températures d’ébullition. g)- Exercice 19 page 196. Comparer des solubilités d’alcools. h)- Exercice 26 page 198. Pourcentage massique et formule d’alcools. i)- Exercice 27 page 199. Masse volumique des alcanes. |
I- Les alcanes et les alcools.
1)- La chaîne carbonée.
- On appelle chaine carbonée l’enchaînement des atomes de carbone liés entre eux par des liaisons covalentes.
- Une chaîne carbonée peut être « linéaire », ramifié ou cyclique.
- Exemple le butane C4H10.
- On peut donner différentes représentations de cette molécule.
|
Formule brute |
C4H10 |
C4H10 |
|
|
Butane « linéaire » |
Butane ramifié |
|
Formule développée |
|
|
|
Formule semi-développée |
|
|
|
Formule topologique |
|
|
- Molécule cyclique : le cyclohexane C6H12.
|
Formule brute |
C6H12 |
|
|
Cyclohexane |
|
Formule développée |
Différentes présentations des formules développées
du
cyclohexane |
|
Formule semi-développée |
|
|
Formule topologique |
|
|
Vue 3 D |
|
2)- Les alcanes.
- Les hydrocarbures sont des composés organiques dont la molécule ne contient
que des atomes de carbone C et d’hydrogène H.
- Les alcanes sont des hydrocarbures saturés. Leurs atomes de carbones sont tétragonaux.
- Chaque atome de carbone forme avec ses atomes voisins quatre liaisons simples.
 ou
ou

- Les alcanes sont des hydrocarbures acycliques (non cyclique) de formule brute générale : CnH2n+2.
- Les cyclanes sont des hydrocarbures présentant au moins une chaîne cyclique.
- La formule brute générale d’un cyclane ne présentant qu’un seul cycle est : CnH2n.
3)- Nomenclature des alcanes.
a)- Les alcanes à chaîne linéaire.
- Les quatre premiers alcanes ont un nom consacré par l'usage :
- méthane (CH4), éthane (C2H6), propane (C3H8), butane (C4H10).
- Pour les autres alcanes à chaîne linéaire, on utilise un préfixe grec indiquant
le nombre d'atomes de carbone que l'on fait suivre du suffixe -ane.
- Le tableau ci-dessous donne les préfixes des alcanes de n = 5 à n = 18.
|
Nombre d'atomes de carbone :
n |
Formule |
Préfixe |
Nom |
|
5 |
C5H12 |
pent- |
pentane |
|
6 |
C6H14 |
hex- |
hexane |
|
7 |
C7H16 |
hept- |
heptane |
|
8 |
C8H18 |
oct- |
octane |
|
9 |
C9H20 |
non- |
nonane |
|
10 |
C10H22 |
déc- |
décane |
|
11 |
C11H24 |
undéc- |
undécane |
|
12 |
C12H26 |
dodéc- |
dodécane |
|
13 |
C13H28 |
tridéc- |
tridécane |
|
14 |
C14H30 |
tétradéc- |
tétradécane |
|
15 |
C15H32 |
pentadéc- |
pentadécane |
|
16 |
C16H34 |
hexadéc- |
hexadécane |
|
17 |
C17H36 |
heptadéc- |
heptadécane |
|
18 |
C18H38 |
octadéc- |
octadécane |
b)- Les groupements alkyles.
- Un alcane peut s'écrire : CnH2n+1 – H ou R – H.
- R – est un groupement alkyle.
- On obtient un groupement alkyle en enlevant un atome d'hydrogène à la formule d'un alcane.
- Exemples :
|
CH3 – |
Groupe méthyle |
|
CH3 – CH2 – |
Groupe éthyle |
|
CH3 – CH2 – CH2 – |
Groupe propyle |
|
|
Groupe isopropyle ou Méthyléthyle |
c)- Alcanes à chaîne carbonée ramifiée.
► On obtient le nom de l'alcane de la manière suivante :
- On cherche la chaîne carbonée la plus longue et le nom de l'alcane à chaîne linéaire
comportant
le même nombre d'atomes de carbone.
-
L'alcane considéré est nommé
comme un dérivé de cet alcane linéaire.
-
La chaîne la plus longue
s'appelle la chaîne principale.
- On identifie les groupes substituants sur cette chaîne et leur place par un indice de position.
- Cet indice s'obtient grâce à la numérotation des atomes de carbone de la chaîne principale.
- Deux sens de numérotation existent, pour trouver le bon sens de numérotation :
- On écrit tous les indices obtenus par ordre croissant.
- Le sens à retenir est celui pour lequel le premier chiffre différent est le plus petit.
- Ou bien on choisit celui pour lequel la somme des indices est la plus petite.
► Dans l'écriture du nom de l'alcane, on doit respecter deux règles :
- Les indices de position des groupes alkyles se placent devant le nom du groupe.
- Les groupes alkyles s'écrivent avant le nom de l'alcane
(Deux chiffres sont séparés par une virgule et entre un chiffre et une lettre, on place un tiret).
- On fait élision du "e" du nom de l'alkyle.
-
Les groupements alkyles sont
placés par ordre alphabétique.
-
S'il existe plusieurs groupes
identiques, en utilise les préfixes : di, tri, tétra…
- Les substituants halogènes se traitent comme les groupes alkyles.
d)- Exemple : Nommer la molécule suivante :
|
|
- Première étape : on cherche la chaîne principale que l’on numérote.

Chaîne principale
|
Nom : 4-éthyl-2,4-diméthylheptane
Nom :
4-éthyl-2,4-diméthylheptane |
4)- Formule et nomenclature des alcools.
a)- Définition.
- On appelle alcool tout composé organique possédant un groupe hydroxyle – OH
lié à un atome de carbone tétragonal.
- Formule générale d’un alcool : R – OH.
- On distingue :
|
Les alcools primaires |
Les alcools secondaires |
Les alcools tertiaires |
|
R – CH2OH |
|
|
- Exemples :
|
Éthanol |
propan-2-ol |
2-méthylpropan-2-ol |
|
|
|
|
b)- Nomenclature des alcools.
- On cherche la chaîne carbonée la plus longue contenant l’atome de carbone qui porte
le groupe hydroxyle – OH.
- On met en place la numérotation qui donne à cet atome de carbone l’indice le plus petit.
- On nomme l’alcool grâce au nom de l’alcane correspondant à cette chaîne avec
élision du "e" final que l’on fait suivre du suffixe ol affecté de l’indice de position qui lui correspond.
- Exemples :
|
Nom |
Formule
semi-développée |
Classe |
|
Propan-1-ol |
|
Alcool
primaire |
|
Propan-2-ol |
|
Alcool
secondaire
|
|
2-méthylpropan-2-ol |
|
Alcool
tertiaire |
II- Évolution des températures de changement d’état.
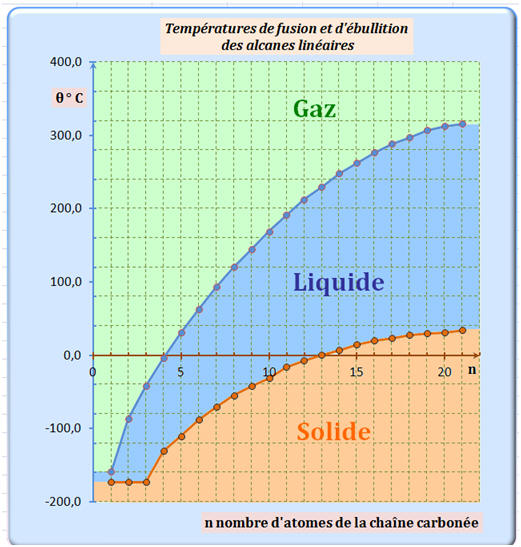
1)- Températures de changement d’état des alcanes.
a)- Cas des alcanes linéaires.
Cliquer sur l'image pour l'agrandir
- Les températures de fusion et d’ébullition des alcanes linéaires augmentent avec
le nombre n d’atomes de carbone de la chaîne carbonée.
- Dans les alcanes, il n’y a pas de liaisons hydrogène car la liaison C –H est très peu polarisée.
- Les molécules d’alcanes sont des molécules apolaires.
- Ce sont les interactions de Van Der Waals qui assurent la cohésion des alcanes à l’état solide et liquide.
- Les molécules d’alcanes étant apolaires les dipôles mis en jeu sont des dipôles instantanés.
- Le moment dipolaire instantané augmente donc avec le nombre n d’atomes de carbone de la chaîne carbonée.
- Plus le moment dipolaire est grand, plus les interactions de Van Der Waals sont grandes
et plus la rupture des liaisons intermoléculaires est difficile.
![]() L’intensité des interactions de
Van Der Waals et de ce fait
L’intensité des interactions de
Van Der Waals et de ce fait
les températures de fusion et d’ébullition des alcanes linéaires
augmentent avec la longueur de la chaîne carbonée des molécules.
b)- Cas des alcanes ramifiés.
► Application : donner le nom et les formules topologiques des isomères du pentane : C5H12
- On donne les températures d’ébullition du moins ramifié au plus ramifié : 36 ° C, 25 ° C et 9 ° C.
- Associer la température d’ébullition à chaque molécule.
- Quelle conclusion peut-on tirer ?
|
Nom |
Formule
topologique |
Température
d’ébullition
θéb |
|
Pentane
linéaire |
|
36 |
|
2-méthylbutane |
|
25 |
|
2,2-diméthylpropane |
ou |
9 |
![]() Pour des alcanes isomères, la
température d’ébullition
θéb
est d’autant plus basse que l’isomère est ramifié.
Pour des alcanes isomères, la
température d’ébullition
θéb
est d’autant plus basse que l’isomère est ramifié.
- Ce résultat est général.
- Au plus la molécule est ramifiée, au moins elle est longue et au plus elle est compacte.
- La distance qui sépare deux molécules est plus grande et de plus les moments dipolaires instantanés sont plus faibles
- (Le moment dipolaire instantané augmente avec la longueur de la chaîne).
- Les interactions de Van Der Waals sont moins importantes pour les molécules ramifiées que pour les isomères linéaires.
- Les alcanes isomères sont d’autant plus volatils qu’ils sont ramifiés.
► Tableau de valeurs :
|
Alcanes
linéaires |
Alcanes
ramifiés |
||||
|
Nom |
θfus
°C |
θéb
°C |
Nom |
θfus °C |
θéb
°C |
|
Méthane |
- 184 |
- 164 |
Méthylpropane
(C4H10) |
- 145 |
- 10 |
|
Éthane |
- 172 |
- 88,5 |
Méthylbutane
(C5H12) |
- 159 |
28 |
|
Propane |
- 190 |
- 44.5 |
Diméthylpropane
(C5H12) |
- 17 |
10 |
|
Butane |
- 135 |
0,6 |
2-méthylpentane
(C6H14) |
- 154 |
60,3 |
|
Pentane |
- 131 |
36,2 |
3-méthylpentane
(C6H14) |
- 118 |
63,3 |
|
Hexane |
- 94 |
69 |
2,2-diméthylbutane
(C6H14) |
- 98 |
49,7 |
|
Heptane |
- 90 |
98,5 |
2,3-diméthylbutane
(C6H14) |
- 129 |
58 |
|
Octane |
- 56.5 |
126 |
2-méthylhexane
(C7H16) |
- 154 |
61 |
2)- Températures de changement d’état de l’eau.
- Température de fusion de l’eau : θfus = 0,0 ° C (Passage de la glace à l’eau à l’état liquide)
- Température d’ébullition de l’eau sous la pression atmosphérique : θéb = 100 ° C
(Passage de l’eau à l’état liquide à la vapeur d’eau).
- On précise la valeur de la pression car la température de fusion dépend de la pression.
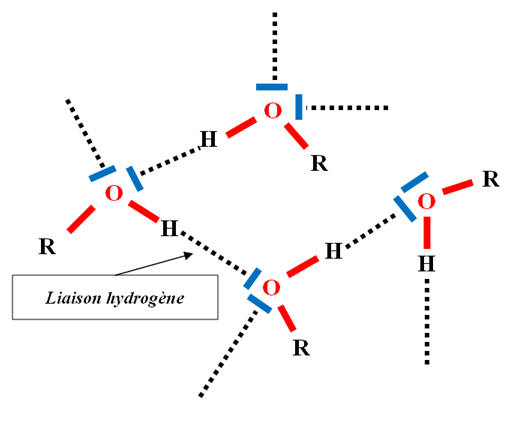
- On a vu que la molécule d’eau H2O est une molécule coudée qui possède
deux liaisons O – H polarisées car l’oxygène est plus électronégatif que l’hydrogène.
- Il y a la possibilité de formation de liaisons hydrogène entre les molécules d’eau.
- La cohésion de l’eau à l’état solide et à l’état liquide est assurée par :
- Des interactions de Van Der Waals
- Et par des liaisons hydrogène.
► Comparaison entre la molécule d’eau et la molécule de sulfure de dihydrogène :
- Pour le sulfure de dihydrogène, θfus = – 86 ° C et θéb = – 61 ° C sous la pression atmosphérique.
- La molécule de sulfure de dihydrogène H2S est aussi une molécule coudée.
|
Nom |
Molécule
d’eau |
Molécule de
sulfure
de
dihydrogène |
|
Formule
brute |
H2O |
H2S |
|
Schéma de Lewis |
|
|
|
Vue 3D |
|
|
|
Température
de fusion
θfus |
0,0 ° C |
100 ° C |
|
Température
d’ébullition
θéb |
– 86 ° C |
–61 ° C |
- Lorsque l’on regarde la classification périodique, le soufre est situé sous l’oxygène.
- Il est de ce fait moins électronégatif que l’oxygène.
- Si l’on compare les électronégativités du soufre, de l’oxygène, du carbone et de l’hydrogène :
- S (2,58), O (3,44), C (2,55) et H (2,2) :
- On remarque que la liaison S – H est peu polarisée comme la liaison C –H.
- Alors que la liaison O – H est très polarisée.
- On peut considérer que la molécule de sulfure de dihydrogène est :
- Apolaire
- Et qu’elle ne forme pas de liaisons hydrogène.
► En résumé :
- La cohésion du sulfure de dihydrogène à l’état solide et à l’état liquide n’est assurée que par :
- Des interactions de Van Der Waals
![]() Conclusion :
Conclusion :
- Dans l’eau, les liaisons hydrogène entre les molécules d’eau augmente la cohésion des états solide et liquide.
- Ce qui n’est pas le cas dans le sulfure de dihydrogène.
- Ceci explique que les températures de changement d’état soient plus élevées pour l’eau
que pour le sulfure de dihydrogène.
- Ceci est vrai pour toutes les molécules qui forment des liaisons hydrogène.
3)- Températures de changement d’état des alcools.
► Étude du graphe : Comparaison des températures d’ébullition des alcanes linéaires avec les alcools correspondant.
- La température d'ébullition d’un alcool croît avec le nombre n d’atomes de carbone de la chaîne carbonée.
- Cette augmentation est liée au fait que le moment dipolaire croît avec la longueur de la molécule.
► Pourquoi la température d’ébullition d’un alcool est-elle supérieure à celle de l’alcane correspondant ?
- Les alcools possèdent le groupe hydroxyle – OH.
- La liaison O – H est une liaison polarisée.
- La présence de cette liaison entraine l’existence de liaison hydrogène
entre les molécules d’alcool, liaison hydrogène qui n’existe pas entre
les molécules d’alcanes.
- Les alcools ont donc des températures d’ébullition supérieures à celle des alcanes de même chaîne carbonée.
4)- La distillation fractionnée.
► Montage :
|
(1)‑Chauffe-ballon. (2)‑Mélange.
(3)‑Colonne de Vigreux.
(4)‑Thermomètre.
(5)‑Arrivée et Sortie de l’eau.
(6)‑Condenseur.
(7)‑Éprouvette. (8)‑Distillat. 9)- Support élévateur (Vallet) |
- Le mélange à distiller est placé dans un ballon surmonté d’une colonne à distiller : colonne de Vigreux.
- On chauffe le ballon jusqu’à ébullition du mélange.
- Les vapeurs des différentes espèces chimiques montent dans la colonne à distiller.
- La colonne à distiller permet de séparer les différentes espèces chimiques.
- En tête de colonne à distiller, on trouve l’espèce chimique la plus volatile.
- Les autres se condensent et retombent dans le ballon.
- L’espèce chimique la plus volatile est condensée grâce au réfrigérant.
- On recueille le distillat.
- La distillation fractionnée permet de séparer et de recueillir les constituants d’un mélange
d’espèces chimiques ayant des températures d’ébullition différentes.
- L’espèce chimique extraite en premier est l’espèce la plus volatile,
celle dont la température d’ébullition est la plus faible.
- La distillation fractionnée des pétroles, qui est un mélange d’hydrocarbures est la première étape du raffinage.
- La séparation et la purification s’effectuent dans une tour à distillation.
Tour de distillation pour le pétrole, Montréal, Québec
III- Miscibilité des alcools dans l’eau.
1)- Étude préliminaire :
► Donner la formule topologique des alcools suivants : méthanol, éthanol, propan-1-ol, butan-1-ol et hexan-1-ol.
|
Nom |
Formule
topologique |
Solubilité
dans l’eau
à 20 ° C |
|
méthanol |
|
Soluble en toutes proportions dans l'eau |
|
Éthanol |
|
Soluble en toutes proportions dans l'eau |
|
Propan-1-ol |
|
Soluble en toutes proportions dans l'eau |
|
Butan-1-ol |
|
77 g / L |
|
Pentan-1-ol |
|
22 g / L |
|
Hexan-1-ol |
|
5,9 g / L |
- Les alcools à chaîne courte (nombre d’atomes de carbone de la chaîne carbonée n < 4) sont solubles dans l’eau en toutes proportions.
- On obtient des mélanges homogènes.
- Lorsque la longueur de la chaîne carbonée des alcools augmente, on remarque que la miscibilité dans l’eau diminue.
► Comment expliquer ces faits ?
► Pourquoi les alcools à chaîne courte sont miscibles ?
- Les molécules d’alcool possèdent le groupe hydroxyle – OH et de ce fait une liaison O – H polarisée.
- Le groupe alkyle R –, à chaîne carbonée courte, n’empêche pas les molécules d’eau d’entourer les molécules d’alcools.
- Les molécules d’alcool sont des molécules polaires.
- Et les solutés polaires sont solubles dans les solvants polaires.
- De plus les molécules d’eau et les molécules d’alcools forment des liaisons hydrogène.
- La cohésion du mélange obtenu est due :
- Aux interactions de Van Der Waals
- Et aux liaisons hydrogène.
► Pourquoi lorsque la chaîne carbonée s’allonge, la miscibilité diminue pour devenir nulle ?
- Le groupe alkyle R –, à chaîne carbonée longue, empêche les molécules d’eau d’entourer les molécules d’alcools.
- Les interactions entre les molécules d’eau et d’alcools sont plus limitées et il y a moins de liaisons hydrogène susceptibles de se former.
- La miscibilité diminue donc au fur et à mesure que la chaîne carbonée de l’alcool s’allonge.
- Elle devient partielle pour s’annuler lorsque la chaîne carbonée est trop longue.
2)- En résumé :
- Un alcool possède :
- Un groupe hydroxyle – OH, on parle de groupe hydrophile
(il peut s’entourer de molécules d’eau et former des liaisons hydrogène)
- Un groupe alkyle R –, chaîne carbonée, qui est le groupe hydrophobe.
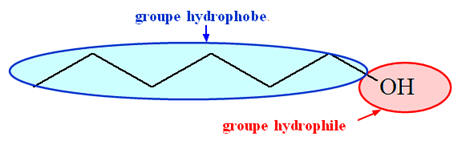
- La miscibilité est liée à l'importance relative de ces deux parties.
- Les deux alcools les plus importants sont :
- L'éthanol (alcool éthylique) que l'on retrouve dans les boissons alcoolisées.
- Des petites quantités d'éthanol provoquent un état euphorique.
- Des doses plus importantes dépriment gravement le système nerveux : à consommer avec modération.
- Le méthanol ou alcool de bois que l'on peut retrouver dans les alcools frelatés.
- Il provoque la cécité et la mort.
- On utilise les alcools comme solvant en pharmacie, en cosmétologie…
IV- Applications.
1)- Densité des alcanes linéaires et ramifiés :
|
Alcanes
linéaires |
Alcanes
ramifiés |
||
|
Nom |
Densité |
Nom |
Densité |
|
Méthane |
0,72 (gaz) |
Méthylpropane
(C4H10) |
2,67 (gaz) |
|
Éthane |
1,36 (gaz) |
Méthylbutane
(C5H12) |
0,62
(liquide) |
|
Propane |
2,01 (gaz) |
Diméthylpropane
(C5H12) |
0,61
(liquide) |
|
Butane |
2,70 (gaz) |
2-méthylpentane
(C6H14) |
0,65
(liquide) |
|
Pentane |
0,63
(liquide) |
3-méthylpentane
(C6H14) |
0,66
(liquide) |
|
Hexane |
0,66
(liquide |
2,2-diméthylbutane
(C6H14) |
0,65
(liquide) |
|
Heptane |
0,68
(liquide |
2,3-diméthylbutane
(C6H14) |
0,66
(liquide) |
|
Octane |
0,70
(liquide |
2-méthylhexane
(C7H16) |
0,66
(liquide) |
2)- Solubilité des alcanes linéaires et ramifiés dans différents solvants :
|
Alcanes
linéaires |
Alcanes ramifiés |
||
|
Nom |
Solubilité |
Nom |
Solubilité |
|
Méthane |
Eau : 5,0 mL / L Éthanol : Éther : très soluble |
Méthylpropane
(C4H10) |
Eau : peu soluble Éthanol :
Ether :
|
|
Éthane |
Eau : 4,7 mL/L Éthanol : |
Méthylbutane
(C5H12) |
Eau : très peu soluble Éthanol : soluble Éther : soluble |
|
Propane |
Eau : peu sol Éthanol : très soluble Éther : très soluble |
Diméthylpropane
(C5H12) |
Eau : insoluble Éthanol : soluble Éther : soluble |
|
Butane |
Eau : 15 mL / L Éthanol : Éther : |
2-méthylpentane
(C6H14) |
Eau : peu soluble Éthanol : soluble Éther : soluble |
|
Pentane |
Eau : insoluble Éthanol : soluble Éther : soluble |
3-méthylpentane
(C6H14) |
Eau : peu soluble Éthanol : soluble Éther : soluble |
|
Hexane |
Eau : peu soluble Éthanol : très soluble Éther : très soluble |
2,2-diméthylbutane
(C6H14) |
Eau : peu soluble Éthanol : soluble Éther : très soluble |
|
Heptane |
Eau : insoluble Éthanol : très soluble Éther : Très soluble |
2,3-diméthylbutane
(C6H14) |
Eau : peu soluble Éthanol : soluble Éther : soluble |
|
Octane |
Éthanol : soluble
Ether : soluble |
2-méthylhexane
(C7H16) |
Eau : insoluble Éthanol : soluble Éther : soluble |
3)- QCM : Pour chaque question, indiquer la (ou les) bonne(s) réponse(s).
|
|
4)- Exercices : Exercices : énoncé avec correction
a)- Exercice 8 page 196. Nommer des alcanes.
b)- Exercice 9 page 196. Rechercher des isomères.
c)- Exercice 11page 196. Reconnaître un alcool.
d)- Exercice 12 page 196 Nommer des alcools.
e)- Exercice 15 page 197. Classer les alcanes en fonction de leur température d’ébullition.
f)- Exercice 16 page 196. Interpréter de températures d’ébullition.
g)- Exercice 19 page 196. Comparer des solubilités d’alcools.
h)- Exercice 26 page 198. Pourcentage massique et formule d’alcools.
i)- Exercice 27 page 199. Masse volumique des alcanes.
|
|