|
Chap. N° 11 |
Transformations en chimie organique : Aspect macroscopique. Cours. |
|
|
|
|
Exercices : énoncé avec correction. a)-
Exercice 6 page 292 : étudier le vapocraquage. b)- Exercice 7 page 292 : étudier une modification de structure. c)- Exercice 10 page 292 : Utiliser le nom d’une espèce chimique. d)- Exercice 13 page 293 : Distinguer une modification de chaîne d’une
modification de groupe caractéristique. e)- Exercice 17 page 293 : Rechercher la catégorie d’une réaction. f)- Exercice 20 page 294 : Parfums. g)- Exercice 20 page 295 : Déshydratation d’alcools. h)-
Exercice 28 page 296 : Déshydratation. i)- Exercice 29 page 296 : Identification d’un alcène. j)- Exercice 31 page 296 : Préparation de l’aniline. |
I-
Modification de la structure d’une molécule.
1)- Modification de la chaîne
carbonée.
a)-
Raccourcissement de la chaîne carbonée :
► Le craquage catalytique :
|
Le craquage catalytique : - Le craquage catalytique consiste à casser, en présence d’un catalyseur, les molécules d’hydrocarbures à longue chaîne carbonée en molécules plus petites dont certaines possèdent une
double liaison. |
- Exemple : le craquage de l’hexane en propane et propène :
|
|
500 ° C Platine |
|
|
|
CH3
– CH2 – CH2 –
CH2 – CH2 – CH3 |
→ |
CH3
– CH2 – CH3 |
+ CH3
– CH = CH2 |
|
|
1013 hPa |
|
|
► Le vapocraquage :
|
Le vapocraquage : - Le vapocraquage est un craquage d’alcanes en présence de
vapeur d’eau afin d’obtenir des alcènes. |
- Exemple : vapocraquage du butane en éthène et
dihydrogène.
|
|
800 ° C |
|
|
|
CH3
–CH2 – CH2 –
CH3 |
→ |
2 CH2
= CH2 |
+
H2 |
|
|
1013 hPa |
|
|
|
|
Vapeur d’eau |
|
|
b)-
Modification de la structure de la chaîne carbonée : le
reformage.
► Le reformage :
|
Le reformage : - Il consiste à la modification de la structure de la chaîne carbonée sans toucher à sa taille. - Cette modification est
réalisée à pression et températures élevées en présence de
catalyseurs. -
Cette modification permet de modifier l’indice d’octane (IO)
de la molécule. |
![]() L’indice
d’octane :
L’indice
d’octane :
- L’indice d’octane d’une essence mesure sa résistance à l’auto-inflammation dans un moteur thermique.
- Plus la molécule
est ramifiée et plus il faut la comprimer pour provoquer
l’auto-inflammation.
- Ainsi, pour une essence, plus l’indice d’octane est élevée, plus on peut la comprimer sans provoquer l’auto-inflammation du mélange réactionnel.
- L’inflammation est
alors provoquée par l’étincelle de la bougie.
- Il est lié à la ramification d’une molécule.
- Pour les molécules d’alcanes de même formule brute, plus
la molécule est ramifiée et plus l’indice d’octane est élevé.
► Isomérisation :
|
L'isomérisation : -
L’isomérisation permet de transformer les alcanes
linéaires en leurs isomères ramifiés. |
- Exemple : obtention du 2,2,4- triméthylpentane à partir
de l’octane.
|
|
Platine |
|
|
CH3
– CH2 – CH2 –
CH2 – CH2 – CH2
– CH2 – CH3 |
→ |
|
|
|
→ |
|
|
Formule brute :
C8H18 |
|
Formule brute :
C8H18 |
- L’indice d’octane (IO) de l’octane linéaire vaut
IO = 0.
- Pour la molécule de 2,2,4- triméthylpentane :
L'indice d'octane : IO
= 100.
► La cyclisation :
|
La cyclisation : - La cyclisation permet d’obtenir des cyclanes, souvent
ramifiés et du dihydrogène. |
- Exemple :
Préparation du méthylcyclopentane à partir de
l’hexane :
|
CH3
– CH2 – CH2 –
CH2 – CH2 – CH3 |
Platine → |
|
+ H2 |
|
Hexane |
|
méthylcyclopentane |
|
► La déshydrogénation :
|
La déshydrogénation : -
La déshydrogénation permet d’obtenir des dérivés
benzéniques et du dihydrogène. |
- Exemple :
Préparation du benzène à partir de hexane.
|
CH3
– CH2 – CH2 –
CH2 – CH2 – CH3 |
Cr2O3 → 550 ° C |
|
+ 4 H2 |
|
Hexane |
|
benzène |
|
c)-
Allongement de la chaîne carbonée.
► L’alkylation :
|
L'alkylation : - L’alkylation permet de rallonger la chaîne carbonée d’un
alcane en le faisant réagir avec un alcène. - Cette réaction, inverse du craquage, est utilisée pour
produire des composés à haut indice d’octane. |
- Exemple :
Préparation du 2,2,4-triméthylpentane à partir
du 2-méthylpropane et 2-méthylprop-1-ène.
|
|
|
|
|
|
|
|
|
|
+ |
|
AlCl3 → |
|
|
|
|
+ |
|
→ |
|
► La
polyaddition :
|
La polyaddition : - La polyaddition de molécules d’éthène (ou éthylène) conduit à un polymère, le polyéthylène. |
|
|
|
|
|
|
|
|
|
|
|
|
|
… |
+ |
H2C
= CH2 |
+ |
H2C
= CH2 |
+ |
H2C
= CH2 |
+ |
… |
→ |
…CH2
– CH2
–
CH2
– CH2
– CH2
– CH2… |
|
|
|
éthène |
|
|
|
|
|
|
|
Polyéthylène |
► La polymérisation :
|
La polymérisation : - La polymérisation par polyaddition permet de rallonger la chaîne carbonée d’un composé organique comportant une double
liaison C = C par réaction d’addition, les unes à la
suite des autres, d’un nombre de ces molécules, appelées
monomères. - Le produit de cette addition est une macromolécule. |
2)- Modification de groupe
caractéristique.
- Tableau des principaux groupes caractéristiques :
|
Fonction chimique |
Groupe caractéristique |
Terminaison |
Préfixe |
|
Alcène |
|
…ène |
|
|
Alcool |
hydroxyle |
…ol |
hydroxy… |
|
Aldéhyde |
carbonyle |
…al |
formyl… |
|
Cétone |
carbonyle |
…one |
oxo… |
|
Acide carboxylique |
carboxyle |
Acide …oïque |
|
|
Ester |
ester |
…ate de …yle |
|
|
Amine |
amine |
…amine |
amino |
|
Amide |
amide |
…amide |
|
- Remarque :
- Le changement de structure peut être également dû à la
modification d’un groupe caractéristique.
- Exemple :
Oxydation ménagée d’un alcool primaire
|
|
Oxydation ménagée |
|
Oxydation ménagée |
|
|
CH3
–CH2 – CH2 –
OH |
→ |
CH3
–CH2 – CHO |
→ |
CH3
–CH2 – COOH |
|
Propan-1-ol |
Oxydant en défaut |
propanal |
Oxydant en excès |
Acide
propanoïque |
|
|
|
|
|
|
- Les propriétés chimiques d’une molécule organique sont
dues à la présence de groupes caractéristiques.
- Des réactions chimiques permettent de passer d’une
fonction chimique à une autre en modifiant les groupes
caractéristiques.
- Dans le nom d’un composé organique, la présence d’un (de)
groupe(s) caractéristique(s) est indiquée par sa terminaison (et
par certains préfixes).
II-
Les grandes catégories de réactions chimiques.
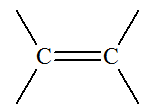
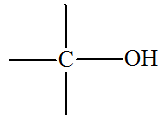
1)- Les réactions de substitution.
|
Réaction de subsitution :
|
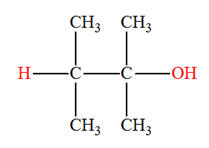
- Exemple : synthèse du 2-méthylpropan-2-ol
|
|
|
|
|
|
|
|
|
+ |
H –
OH (ℓ) |
→ |
|
+ H+
(aq) + Cl–
(aq) |
|
2-chloro-2-méthylpropane |
|
|
|
2-méthylpropan-2-ol |
|
- L’atome de chlore
– Cl du dérivé
chloré a été remplacé par le groupe hydroxyle
– OH
-
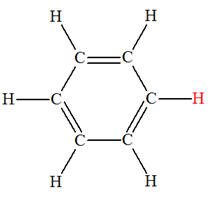
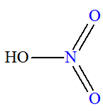
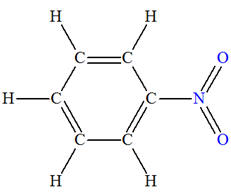
Exemple : Synthèse du nitrobenzène
|
|
|
|
|
|
|
|
|
+ |
|
→ |
|
+ |
|
benzène |
|
Acide
nitrique |
|
nitrobenzène |
|
- Un atome d’hydrogène – H
est remplacé par un groupe –NO2.
2)- Réactions d’addition :
|
Réaction d'addition :
|
- Exemple : Addition de dibrome sur un alcène le
2-méthylbut-2-ène.
|
|
|
|
|
|
|
|
+ |
|
→ |
|
|
2-méthylbut-2-ène |
|
Dibrome |
|
2,3-dibromo-2-méthylbutane |
-
Le dibrome s’additionne sur la double liaison C = C.
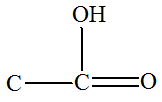
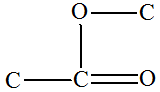
3)- Les réactions d’éliminations.
|
Réaction d'élimination :
|
- Exemple : déshydratation d’un alcool.
|
|
H+ → |
|
+ |
|
|
2,3-diméthylbutan-2-ol |
Acide
sulfurique |
2,3-diméthylbut-2-ène |
|
|
2)- Exercices :
a)-
Exercice 6 page 292 : étudier le vapocraquage.
b)-
Exercice 7 page 292 : étudier une modification de
structure.
c)-
Exercice 10 page 292 : Utiliser le nom d’une espèce
chimique.
e)-
Exercice 17 page 293 : Rechercher la catégorie d’une
réaction.
f)-
Exercice 20 page 294 : Parfums.
g)-
Exercice 20 page 295 : Déshydratation d’alcools.
h)-
Exercice 28 page 296 : Déshydratation.
i)-
Exercice 29 page 296 : Identification d’un alcène.
|
|





















 (ℓ)
(ℓ)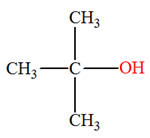 (aq)
(aq)