|
Chim. N° 06 |
De la structure aux propriétés des alcanes et des alcools. Exercices. |
|
|
Mots clés : Structure des alcanes, propriétés des alcanes, structure des alcools, propriétés des alcools, alcanes, alcools, nomenclature des alcanes, nomenclature des alcools, Températures de changement d'état des alcanes, température de changement d'état de l'eau, températures de changement d'état des alcools, distillation fractionnée, miscibilité des alcools dans l'eau, densité des alcanes, solubilité des alcanes alcanes linéaires, alcanes ramifiés, QCM, nommer des alcanes, rechercher des isomères, isomères, reconnaître un alcool, nommer un alcool, interpréter les températures d'ébullition, comparer la solubilité des alcools, pourcentage massique et formule d'un alcool, masse volumique des alcanes, ... |
|
|
I- Exercice 8 page 196. Nommer des alcanes.
|
1)- Donner les noms et les formules semi-développées des six premiers alcanes linéaires. 2)- Nommer les alcanes correspondant aux formules suivantes. a)-
b)-
c)-
d)-
|
|
1)- Noms et formules semi-développées des six premiers alcanes linéaires :
2)- Nom des alcanes correspondant aux formules suivantes : a)-
- 2,3-diméthylbutane b)-
- 3,3- diméthylpentane c)-
- 2,2- diméthylpentane d)-
- 2,4 - diméthylhexane |
II- Exercice 9 page 196. Rechercher des isomères.
|
1)- Écrire les formules semi-développées des alcanes suivants : a)- 2,2 – diméthylpropane ; b)- 3 – éthylpentane ; c)- 2,4 – diméthylpentane ; d)- Méthylbutane. 2)- Ces composés forment deux couples d’isomères. Identifier ces couples. 3)- Nommer les alcanes linéaires isomères de chacun de ces couples. |
|
1)- Formules semi-développées des alcanes suivants : a)- 2,2 – diméthylpropane : -
b)- 3 – éthylpentane : -
c)- 2,4 – diméthylpentane : -
d)- Méthylbutane : -
2)- Les couples isomères : - On appelle isomères, des espèces chimiques qui ont la même formule brute, mais des enchaînements d’atomes différents. - Couple 1 : Le 2,2 – diméthylpropane et le méthylbutane sont des molécules isomères de même formule brute C5H12. - Couple 2 : Le 2,4 – diméthylpentane et le 3 – éthylpentane sont des molécules isomères de même formule brute C7H16. 3)- Nom des alcanes linéaires isomères de chacun de ces couples : - Couple 1 : Formule brute C5H12 : alcane linéaire correspondant : le pentane. - Couple 2 : Formule brute C7H16 : alcane linéaire correspondant : l’heptane. |
III- Exercice 11page 196. Reconnaître un alcool.
|
Reconnaître les alcools parmi les composés suivants : a)- Éthanol : CH3 – CH2 –OH. b)-
Phénol :
c)-
Prop-2-èn-1-ol : H2C
=
CH – CH2 –OH. d)-
Prop-1-èn-1-ol :
e)-
Cyclopentanol :
f)-
Phénylméthanol :
|
|
- On appelle alcool tout composé organique possédant un groupe hydroxyle – OH lié à un atome de carbone tétragonal. - Formule générale d’un alcool : R – OH. - R est un groupement alkyle. a)- Éthanol : CH3 – CH2 –OH. - Alcool (alcool que l’on trouve dans les boissons alcoolisées) b)-
Phénol :
- Le phénol n’est pas un alcool. - Le groupe hydroxyle n’est pas lié à un carbone tétragonal (le carbone est trigonal : trois voisins) c)-
Prop-2-èn-1-ol : H2C =
CH – CH2 –OH. - C’est un alcool. d)-
Prop-1-èn-1-ol : - Ce n’est pas un alcool. - Le groupe hydroxyle n’est pas lié à un carbone tétragonal. - C’est un énol. e)-
Cyclopentanol :
- C’est un alcool. f)-
Phénylméthanol :
- C’est un alcool. |
IV- Exercice 12 page 196 Nommer des alcools.
|
1)- Nommer les alcools correspondant aux formules suivantes : a)-
CH3
– OH. b)-
CH3
– CH2
– CH2 – CH2
– OH. c)-
d)-
e)-
2)- Écrire la formule topologique de ces cinq alcools. |
|
1)- Nom des différents alcools : a)-
CH3 – OH : méthanol. b)-
CH3 – CH2
– CH2 – CH2 –
OH : butan-1-ol. c)-
- 2.3- diméthylbutane-1-ol. d)-
- 3,3-diméthylbutan-1-ol. e)-
- 3,4-diméthylpentan-2-ol 2)- Formules topologiques : a)-
Méthanol :
b)-
Butan-1-ol : c)-
2.3- diméthylbutan-1-ol :
d)-
3,3-diméthylbutan-1-ol :
e)-
3,4-diméthylpentan-2-ol :
|
V- Exercice 15 page 197. Classer les alcanes en fonction de leur température d’ébullition.
|
On considère les alcanes ayant les formules semi-développées suivantes : a)-
b)-
1)- Classer ces trois alcanes par température d’ébullition croissante. Justifier l’ordre proposé. 2)- Quel est l’alcane le plus volatil ? 3)- Quel est l’alcane le moins volatil ? |
|
Les alcanes ayant les formules semi-développées suivantes : a)-
- 2-méthylpentane b)-
- 2,2-diméthylbutane - Hexane - Remarques : - Ces alcanes ont la même formule brute : C6H14. - Ce sont des molécules isomères.
- Ce résultat est général. - Au plus la molécule est ramifiée, au moins elle est longue et au plus elle est compacte. - La distance qui sépare deux molécules est plus grande et de plus les moments dipolaires instantanés sont plus faibles - (le moment dipolaire instantané augmente avec la longueur de la chaîne). - Les interactions de Van Der Waals sont moins importantes pour les molécules ramifiées que pour les isomères linéaires. - Les alcanes isomères sont d’autant plus volatils qu’ils sont ramifiés. 1)- Classement des trois alcanes par température d’ébullition croissante. - Le 2,2-diméthylbutane (b)-) (49,7 ° C), le 2-méthylpentane (a)-) (60,3 ° C) et l’hexane (c)-) (69 ° C) - Pour des alcanes isomères, la température d’ébullition θéb est d’autant plus basse que l’isomère est ramifié. 2)- Alcane le plus volatil : - C’est l’isomère le plus ramifié, celui qui a la température d’ébullition la plus basse : - Le 2,2-diméthylbutane (b)- (49,7 ° C) 3)- Alcane le moins volatil : - C’est l’alcane isomère linéaire, celui qui a la température d’ébullition la plus haute : - L’hexane (c)-) (69 ° C) |
VI- Exercice 16 page 196. Interpréter des températures d’ébullition.
|
Le butan-1-ol, le 2-méthylpropan-1-ol et le 2-méthylpropan-2-ol sont trois alcools de températures d’ébullition respectives : 118 ° C, 108 ° C, et 83 ° C sous la pression atmosphérique. 1)- Écrire la formule semi-développée, puis la formule brute de chacun de ces alcools. Que peut-on en déduire ? 2)- Rappeler la nature des interactions qui assurent la cohésion des alcools à l’état liquide. 3)- Justifier l’ordre des températures d’ébullition de ces alcools. |
|
1)- Formule semi-développée, puis la formule brute de chacun de ces alcools. - Butan-1-ol : -
- 2-méthylpropan-1-ol : -
- 2-méthylpropan-2-ol : -
-
Ces molécules ont la même formule brute :
C4H10O. - Ce sont des molécules isomères. 2)- Nature des interactions qui assurent la cohésion des alcools à l’état liquide. - Les alcools possèdent le groupe hydroxyle – OH. - La liaison O – H est une liaison polarisée. - La présence de cette liaison entraine l’existence de liaisons hydrogène entre les molécules d’alcool, liaisons hydrogène qui n’existent pas entre les molécules d’alcanes. - Les alcools ont donc des températures d’ébullition supérieures à celles des alcanes de même chaîne carbonée. - En conséquence, à l’état liquide, les molécules d’alcools sont liées par des interactions de Van der Waals et par des liaisons hydrogène. 3)- Justification de l’ordre des températures d’ébullition de ces alcools.
- Au plus la molécule est ramifiée, au moins elle est longue et au plus elle est compacte. - Les interactions de Van Der Waals sont moins importantes pour les molécules ramifiées que pour les isomères linéaires. - Les alcools isomères sont d’autant plus volatils qu’ils sont ramifiés. |
VII- Exercice 19 page 196. Comparer des solubilités d’alcools.
|
On étudie la solubilité avec l’eau de trois alcools : -
Le méthanol : CH3 – OH -
Le butan-1-ol : CH3 – CH2
– CH2 – CH2
– OH -
L’heptan-1-ol : CH3 – CH2
– CH2 – CH2
– CH2 – CH2
– CH2 – OH Avec l’eau, l’un des alcools (noté A) est non miscible, un autre (noté B) est totalement miscible et le troisième (noté
C) est partiellement miscible. 1)- Rappeler, en s’aidant de schémas, la nature des interactions susceptibles de s’établir entre les molécules d’eau et les molécules d’alcools. 2)- Attribuer à chaque lettre A, B et C, l’alcool qui lui correspond en justifiant la réponse. |
|
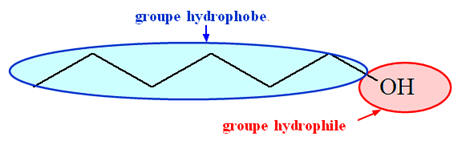
1)- Interactions susceptibles de s’établir entre les molécules d’eau et les molécules d’alcools : - Les molécules d’alcool possèdent le groupe hydroxyle – OH et de ce fait une liaison O – H polarisée. - Le groupe alkyle R –, à chaîne carbonée courte, n’empêche pas les molécules d’eau d’entourer les molécules d’alcools. - Les molécules d’alcool sont des molécules polaires. - Et les solutés polaires sont solubles dans les solvants polaires. - De plus les molécules d’eau et les molécules d’alcools forment des liaisons hydrogène. - La cohésion du mélange obtenu est due : - Aux interactions de Van Der Waals - Et aux liaisons hydrogène. - Le groupe alkyle R –, à chaîne carbonée longue, empêche les molécules d’eau d’entourer les molécules d’alcools. - Les interactions entre les molécules d’eau et d’alcools sont plus limitées - Il y a moins de liaisons hydrogène susceptibles de se former. - La miscibilité diminue donc au fur et à mesure que la chaîne carbonée de l’alcool s’allonge. - Elle devient partielle pour s’annuler lorsque la chaîne carbonée est trop longue. - Un alcool possède : - Un groupe hydroxyle – OH, on parle de groupe hydrophile - (il peut s’entourer de molécules d’eau et former des liaisons hydrogène) - Un groupe alkyle R –, chaîne carbonée, qui est le groupe hydrophobe.
- La miscibilité est liée à l'importance relative de ces deux parties. - Liaison hydrogène entre les molécules d’eau et les molécules d’alcools : 2)- Attribution à chaque lettre A, B et C, l’alcool qui lui correspond : - Les alcools à chaîne courte (nombre d’atomes de carbone de la chaîne carbonée n < 4) sont solubles dans l’eau en toutes proportions. - On obtient des mélanges homogènes. - Lorsque la longueur de la chaîne carbonée des alcools augmente, on remarque que la miscibilité dans l’eau diminue.
- L’alcool noté B est le méthanol, il est soluble à l’eau en toutes proportions. - L’alcool noté C est partiellement miscible à l’eau, c’est le butan-1-ol. - La chaîne carbonée comprend 4 atomes de carbone. - L’alcool noté A est l’heptan-1-ol est non miscible à l’eau. - Sa chaîne carbonée est trop longue. |
VIII- Exercice 26 page 198. Pourcentage massique et formule d’alcools.
|
On appelle pourcentage massique P d’un élément dans une molécule, le quotient de la masse de cet élément dans une mole de molécules par la masse molaire de la molécule. On considère un alcool A qui a la même chaîne carbonée qu’un alcane comportant n atomes de carbone. 1)- Exprimer la formule brute de l’alcool en fonction de n. 2)- En déduire l’expression de la masse molaire de A en fonction de n. 3)- Le pourcentage massique de l’élément oxygène dans la molécule A est P (O) = 26,7 %. a)- En déduire la valeur de n et la formule brute de A. b)- Écrire les formules semi-développées possibles de A. c)- Identifier A sachant que le groupe hydroxyle est en bout de chaîne. |
|
1)- Formule brute de l’alcool en fonction de n : - CnH2n+1 – OH ou CnH2n+2 O 2)- Expression de la masse molaire de A en fonction de n : - M (A) = 12 n + 2 n + 2 + 16 - M (A) = 14 n + 18 3)- La molécule d’alcool A : a)-
Valeur de n et la formule brute de
A : - Tableau de proportionnalité :
- Valeur de n : - Le nombre n est un entier naturel. -
- Formule brute de A : - C3H8 O b)-
Formules semi-développées possibles de A :
c)- Identification de A : - Comme le groupe hydroxyle est en bout de chaîne, l’alcool A est le propan-1-ol qui est un alcool primaire. |
IX- Exercice 27 page 199. Masse volumique des alcanes.
|
Le tableau ci-dessous donne la masse volumique de deux séries d’alcanes isomères à 25 ° C sous la pression atmosphérique.
1)- Écrire les formules semi-développées de ces six alcanes. 2)- Rappeler la nature des interactions qui assurent la cohésion des alcanes à l’état liquide et les deux principaux paramètres qui caractérisent l’intensité de ces interactions. 3)- Masses volumiques : a)- Proposer alors une interprétation au fait que la masse volumique de l’hexane est supérieure à celle du pentane. b)- Justifier l’évolution des masses volumiques pour chaque série d’isomères. |
|
1)- Formules semi-développées de ces six alcanes :
2)- Nature des interactions qui assurent la cohésion des alcanes à l’état liquide et les deux principaux paramètres qui caractérisent l’intensité de ces interactions. - Ce sont les interactions de Van Der Waals qui assurent la cohésion des alcanes à l’état solide et liquide. - Les molécules d’alcanes étant apolaires les dipôles mis en jeu sont des dipôles instantanés. - Ces interactions sont d’autant plus fortes que la chaîne carbonée est longue et que les molécules sont proches les unes des autres. 3)- Masses volumiques : a)- Interprétation au fait que la masse volumique de l’hexane est supérieure à celle du pentane. - La chaîne carbonée de la molécule d’hexane est plus longue que celle de la molécule de pentane. - Les interactions de Van Der Waals qui assurent la cohésion des alcanes à l’état solide et liquide sont plus fortes dans la molécule d’hexane que dans la molécule de pentane. - Les molécules d’hexane sont plus proches et prennent moins de place que les molécules de pentane. - En conséquence, la masse volumique de l’hexane à l’état liquide est plus grande que celle du pentane (ceci dans les mêmes conditions de température et de pression). b)- Évolution des masses volumiques pour chaque série d’isomères. - Au plus une molécule est ramifiée, au moins elles sont liées entre elles. - Elles occupent plus de place. - De manière générale, pour un même nombre d’atomes de carbone, la masse volumique diminue lorsque le nombre de ramification de la molécule augmente. - Ainsi, la masse volumique du 2,2-diméthylbutane (0,644 g / mL) est plus faible que celle de l’hexane (0,665 g / mL). |
|
|