|
Chim. N° 07 |
Piles et accumulateurs. Cours. |
|
|
Mots clés : Piles, accumulateurs, pile saline, pile alcaline, pile Volta,
Pile Daniell, |
|
|
|
1)- Étude de la
pile zinc-cuivre : La pile Daniell : |
|
III- Couples
oxydant-réducteur. |
|
IV- Réaction
d’oxydoréduction. |
|
Pour aller plus loin : |
|
|
|
Exercices : énoncé avec correction a)- Exercice 7 page 298. Étudier la constitution d’une pile. b)- Exercice 9 page 298. Utiliser la polarité d’une pile. c)- Exercice 10 page 298. Déterminer la polarité d’une pile. d)- Exercice 12 page 299. Reconnaître un oxydant et un réducteur. e)- Exercice 16 page 299. Établir des demi-équations redox. f)- Exercice 23 page 301. Pile SR à l’oxyde d’argent. g)- Exercice 24 page 301. Accumulateur lithium-ion. h)- Exercice 26 page 302. Gravure à l’eau forte. |
- Les piles et les accumulateurs sont des générateurs électrochimiques.
- Ils convertissent de l’énergie chimique en énergie électrique.
- Ils sont constitués :
- De deux électrodes,
- Les électrodes sont en contact d’un milieu conducteur, appelé électrolyte.
- Ils sont caractérisés par une force électromotrice E (f.é.m.) (volt V) et une résistance interne r (Ω).
- Piles salines ou piles Leclanché
- Schéma d’une pile saline :

- La solution gélifiée de chlorure d’ammonium contient des ions ammonium NH4+ , et des ions chlorure Cl –.
- La solution gélifiée de chlorure de zinc II contient des ions zinc II Zn2+ et des ions chlorure Cl –.
- Les réactifs sont :
- L’anode qui est zinc.
- Il constitue le boîtier de la pile.
- Et le dioxyde de manganèse.
- Comme le dioxyde de manganèse n’est pas conducteur, on l’utilise un mélange de dioxyde de manganèse et de carbone en poudre
- Le cylindre de graphite constitue le collecteur de courant.
- Schéma :
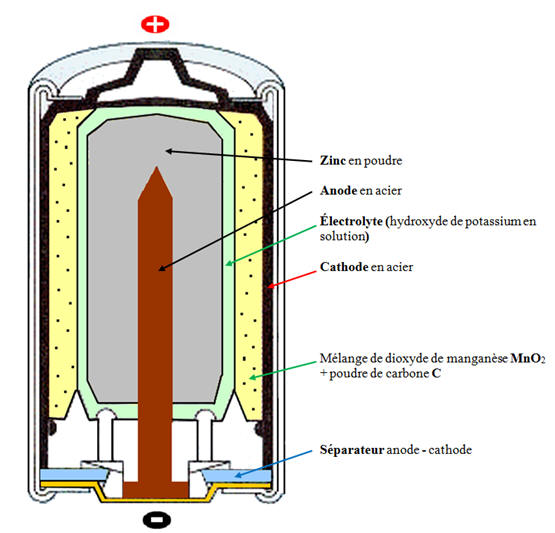
- La solution d’hydroxyde de potassium contient des ions potassium K+ et des ions hydroxyde HO –.
- Les réactifs sont :
- Le zinc en poudre pour augmenter la surface réactionnelle.
- Et le dioxyde de manganèse.
- Comme le dioxyde de manganèse n’est pas conducteur, on l’utilise un mélange de dioxyde de manganèse et de carbone en poudre
- Le cylindre en acier (anode) constitue le collecteur de courant.
- Schéma :
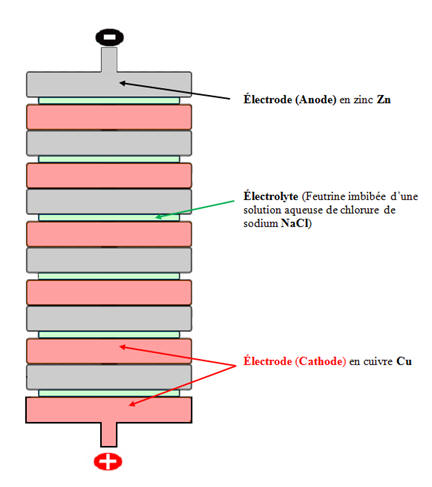
- La solution la solution aqueuse de chlorure de sodium contient des ions sodium Na+ et des ions chlorure Cl –.
- Les réactifs sont :
- L’anode qui est zinc.
- Le disque de zinc est consommé au cours de l’utilisation de la pile.
- L’eau présente dans la solution aqueuse de chlorure de sodium.
- Le disque de cuivre (cathode) constitue aussi le collecteur de courant.
- Schémas :


- Une autre présentation :
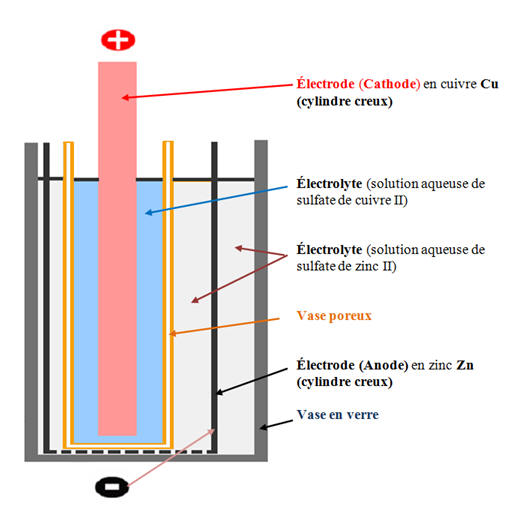
- La solution aqueuse de sulfate de cuivre II contient des ions cuivre II, Cu2+ et des ions sulfate SO42–.
- La solution aqueuse de sulfate de zinc II contient des ions zinc II, Zn2+ et des ions sulfate SO42–.
- Les réactifs sont :
- L’anode qui est l'électrode de zinc Zn (s)
- Et les ions cuivre II, Cu2+ (ils sont présents dans la solution aqueuse de sulfate de cuivre II).
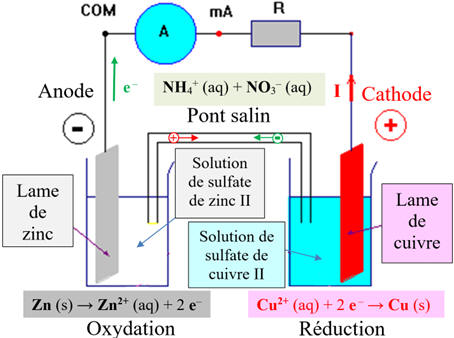
1)- Étude de la pile zinc-cuivre : La pile Daniell :
a)- Montage et mesure :
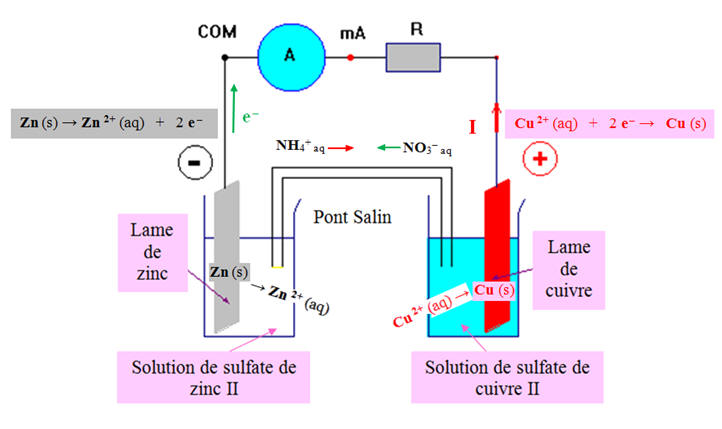
- Une électrode de zinc plongée dans une solution de sulfate de zinc II et une électrode de cuivre plongée dans une solution de sulfate de cuivre II constituent une pile.
- Schéma équivalent :
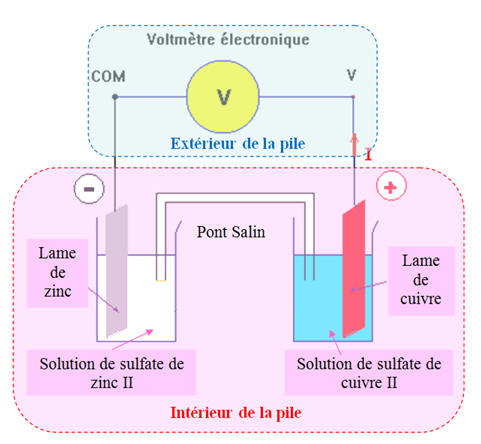
- La tension mesurée est sensiblement égale à la force électromotrice de la pile car on utilise un voltmètre électronique : E ≈ 1,06 V
- Le système constitué :
- Une électrode de zinc plongée dans une solution de sulfate de zinc II
- Une électrode de cuivre plongée dans une solution de sulfate de cuivre II
- Et du pont salin (le tube en u est rempli d’une solution aqueuse gélifiée de nitrate d’ammonium NH4+ aq + NO3– aq
- Constitue une pile.
- UCu-Zn ≈ 1,06 V
- Le signe de cette tension permet de déduire :
- La nature des pôles de la pile et le sens du courant à l’extérieur de la pile.
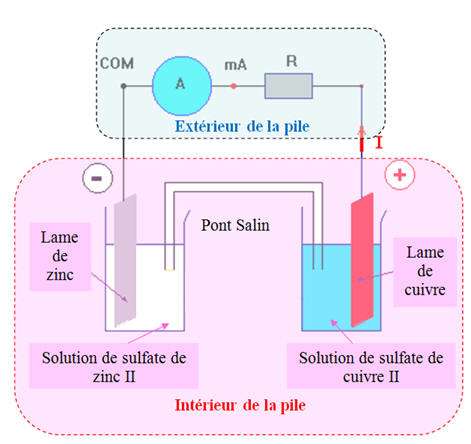
- Dans le cas présent, l’électrode de cuivre constitue la borne positive de la pile et l’électrode de zinc la borne négative.
- Le courant généré par cette pile circule de l’électrode de cuivre vers l’électrode de zinc à l’extérieur de la pile.
- Les électrons, responsables du passage de ce courant dans le circuit électrique (fils et électrodes), circulent de l’électrode de zinc vers l’électrode de cuivre à l’extérieur du circuit.
- À l’intérieur de la pile les porteurs de charges sont les ions.
- Le courant électrique à l’intérieur de la pile est dû à la double migration des ions positifs et négatifs, présents dans les différentes solutions, se déplaçant en sens inverses.
- Remarque : Les électrons n’existent pas en solution aqueuse et ils ne peuvent pas s’accumuler sur la plaque.
- Ils se déplacent vers l’électrode de cuivre grâce au circuit électrique.
- Les cations se déplacent dans le sens du courant électrique et les anions se déplacent en sens inverse de celui du courant électrique.
- Rôle du pont salin :
- La solution gélifiée de nitrate d’ammonium, présente dans le pont salin, assure la jonction électrique entre les solutions contenues dans les deux béchers.
b)- Réactions aux électrodes.
- Les électrons, responsables du passage du courant dans le circuit électrique (fils et électrodes), circulent de l’électrode de zinc vers l’électrode de cuivre à l’extérieur du circuit.
- Les électrons qui partent de l’électrode de zinc sont libérés par la réaction suivante :
Zn (s)
→
Zn2+
(aq)
+
2 e –
- Les électrons qui arrivent à la borne de cuivre sont consommés par la réaction suivante :
Cu2+
(aq)
+
2 e
– →
Cu
(s)
c)- Polarité de la pile, réactions aux électrodes et nom des électrodes.
- À la borne positive, ici l’électrode de cuivre, les électrons qui arrivent sont consommés par la réaction
Cu2+
(aq)
+
2 e
– →
Cu
(s)
- Cette électrode est appelée la Cathode.
- À la borne négative de la pile, ici l’électrode de zinc les électrons sont créés par la réaction
Zn (s)
→
Zn2+
(aq)
+
2 e –
- Cette électrode est appelée l’anode.
d)- Réaction de fonctionnement de la pile.
- Lorsque la pile débite du courant électrique, des réactions chimiques se produisent au niveau des électrodes.
- Le bilan des réactions chimiques (réactions électrochimiques) qui se produisent à chacune des électrodes de la pile donne l’équation de la réaction chimique :
- Équation de la réaction :
|
Cu2+ (aq)
+
2 e
– →
Cu
(s) |
|
Zn
(s)
→ Zn2+
(aq)
+
2 e
– |
|
Cu2+
(aq)
+
Zn
(s)
→
Cu
(s) +
Zn2+
(aq) |
- On est en présence d’un générateur électrochimique qui transforme de l’énergie chimique en énergie électrique.
- Récapitulatif :
2)- Étude de la pile cuivre-argent.
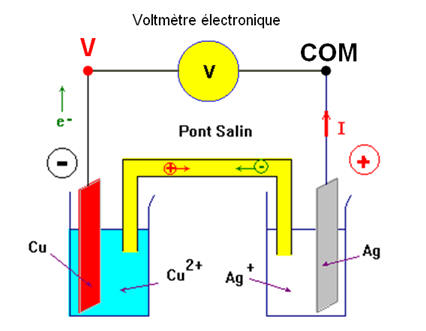
a)- Montage et mesure.
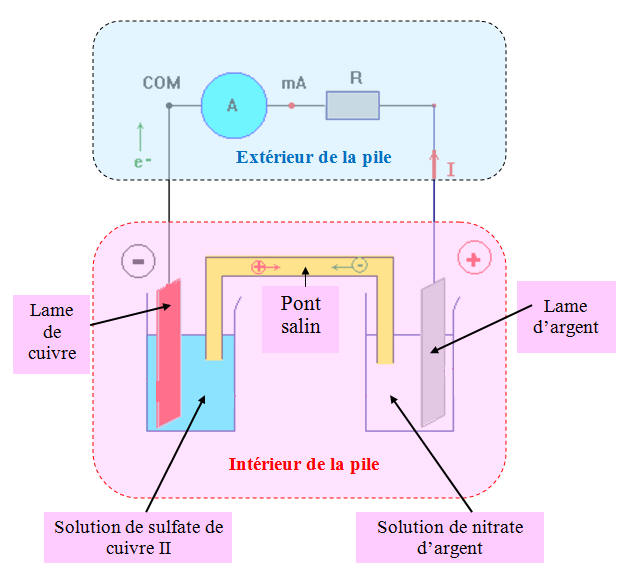
- Une électrode d’argent plongée dans une solution de nitrate d’argent et une électrode de cuivre plongée dans une solution de sulfate de cuivre II constituent une pile.
- Schéma équivalent :
- Le système constitué :
- Une électrode d’argent plongée dans une solution de nitrate d’argent
- Une électrode de cuivre plongée dans une solution de sulfate de cuivre II
- Et du pont salin (le tube en u est rempli d’une solution aqueuse gélifiée de nitrate d’ammonium NH4+ aq + NO3– aq).
- Constitue une pile.
- UCu-Ag ≈ – 0,357 V
- Le signe de cette tension permet de déduire :
- La nature des pôles de la pile et le sens du courant à l’extérieur de la pile.
- Dans le cas présent, l’électrode d’argent constitue la borne positive de la pile et l’électrode de cuivre la borne négative.
- Le courant généré par cette pile circule de l’électrode d’argent vers l’électrode de cuivre à l’extérieur de la pile.
- Les électrons, responsables du passage de ce courant dans le circuit électrique (fils et électrodes), circulent de l’électrode de cuivre vers l’électrode d’argent à l’extérieur du circuit.
- À l’intérieur de la pile les porteurs de charges sont les ions.
- Le courant électrique à l’intérieur de la pile est dû à la double migration des ions positifs et négatifs, présents dans les différentes solutions, se déplaçant en sens inverses.
- Remarque : Les électrons n’existent pas en solution aqueuse et ils ne peuvent pas s’accumuler sur la plaque.
- Ils se déplacent vers l’électrode de cuivre grâce au circuit électrique.
- Les cations se déplacent dans le sens du courant électrique et les anions se déplacent en sens inverse de celui du courant électrique.
- Rôle du pont salin :
- La solution gélifiée de nitrate d’ammonium, présente dans le pont salin, assure la jonction électrique entre les solutions contenues dans les deux béchers.
b)- Réactions aux électrodes.
- Les électrons, responsables du passage du courant dans le circuit électrique (fils et électrodes), circulent de l’électrode de cuivre vers l’électrode d’argent à l’extérieur du circuit.
- Les électrons qui partent de l’électrode de cuivre sont libérés par la réaction suivante :
Cu (s)
→
Cu2+
(aq)
+
2 e –
- Les électrons qui arrivent à l’électrode sont consommés par la réaction suivante :
Ag+
(aq)
+
e
– →
Ag
(s)
c)- Polarité de la pile, réactions aux électrodes et nom des électrodes.
- À la borne positive, ici l’électrode d’argent, les électrons qui arrivent sont consommés par la réaction
Ag+
(aq)
+
e
– →
Ag
(s)
- Cette électrode est appelée la Cathode.
- À la borne négative de la pile, ici l’électrode de cuivre les électrons sont créés par la réaction
Cu (s)
→
Cu2+
(aq)
+
2 e –
- Cette électrode est appelée l’anode.
d)- Réaction de fonctionnement de la pile.
- Lorsque la pile débite du courant électrique, des réactions chimiques se produisent au niveau des électrodes.
- Le bilan des réactions chimiques (réactions électrochimiques) qui se produisent à chacune des électrodes de la pile donne l’équation de la réaction chimique :
- Équation de la réaction :
|
2
(Ag+
(aq)
+
e
– →
Ag
(s)) |
|
Cu
(s)
→ Cu2+
(aq)
+
2
e
– |
|
2
Ag+
(aq)
+
Cu
(s)
→
2
Ag
(s)
+
Cu2+
(aq) |
- On est en présence d’un générateur électrochimique qui transforme de l’énergie chimique en énergie électrique.
![]() L’étude des piles zinc-cuivre et
cuivre-argent montre que :
L’étude des piles zinc-cuivre et
cuivre-argent montre que :
► Dans la pile zinc-cuivre :
- L’électrode de cuivre constitue la borne positive (cathode) de la pile
- Le cuivre métal Cu (s) est formé.
► Dans la pile cuivre-argent :
- L’électrode de cuivre constitue la borne négative (anode) de la pile
- Le cuivre métal Cu (s) est consommé.
![]() Ce résultat est général : les
réactions qui se produisent aux électrodes dépendent de la
polarité de la pile constituée.
Ce résultat est général : les
réactions qui se produisent aux électrodes dépendent de la
polarité de la pile constituée.
III- Couples oxydant-réducteur.
- Un oxydant est une entité chimique capable de gagner un ou plusieurs électrons.
- Oxydant : gagne
- Exemples : Ag+, Cu2+, Zn2+
- Un réducteur est une entité chimique capable de perdre un ou plusieurs électrons.
- Réducteur : perd
-
Exemples :
Cu,
Zn
2)- Couple oxydant-réducteur :
- On a vu que selon la pile réalisée, il peut se produire à l’électrode de cuivre :
-
La réaction suivante :
Cu
(s)
→ Cu2+
(aq)
+
2 e
–
- Le cuivre métal cède des électrons
-
Ou la réaction suivante :
Cu2+
(aq)
+
2 e
– →
Cu
(s)
- L’ion cuivre II capte des électrons.
- Les deux espèces Cu2+ (aq) et Cu (s) sont dites conjuguées et forment un couple oxydant / réducteur, noté Cu2+ (aq) / Cu (s).
- Les deux espèces oxydant et réducteur obtenues en passant de l’une à l’autre par gain ou perte d’un ou plusieurs électrons s’appellent des espèces conjuguées.
- Elles forment un couple oxydant / réducteur, noté Ox / Red.
- Exemples : Cu2+ / Cu, Ag+ / Ag, Zn2+ / Zn
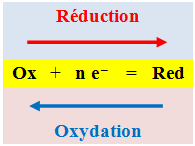
- À tout couple oxydant / réducteur, on associe la demi-équation électronique d’oxydoréduction suivante :
Ox
+
n
e
–
=
Red
-
Exemple :
Cu2+
(aq)
+
2 e
– =
Cu
(s)
- Ceci est une écriture formelle.
- Le signe égal traduit la possibilité de passer d’une forme à l’autre suivant les conditions expérimentales.
- La transformation chimique qui correspond au passage de l’oxydant Ox à son réducteur conjugué Red est une réduction.
- Une réduction est un gain d’électrons.
- La transformation chimique qui correspond au passage du réducteur Red à son oxydant conjugué Ox est une oxydation.
- Une oxydation est une perte d’électrons.
- Au cours d’une réaction d’oxydoréduction, un oxydant est réduit et un réducteur est oxydé.
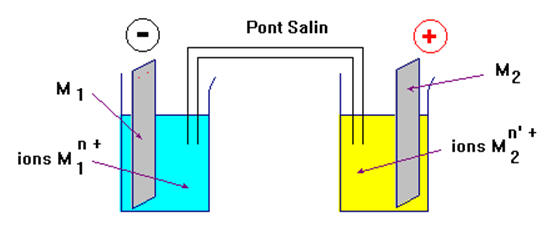
- Deux compartiments distincts contenant chacun un couple OX / RED du type M n+ (aq) / M (s) et reliés par un pont électrochimique (ou pont salin) constituent un générateur électrochimique appelé pile.
- L’ensemble constitué par une plaque de métal M plongeant dans une solution contenant des cations M n+ constitue une demi-pile.
- La plaque de métal est appelée aussi électrode.
- Les transferts d’électrons se produisent à la surface de l’électrode.
IV- Réaction d’oxydoréduction.
- Une réaction d’oxydoréduction est une réaction qui met en jeu un transfert d’électrons entre ses réactifs.
- Elle fait agir l’oxydant d’un couple avec le réducteur d’un autre couple pour donner leurs espèces conjuguées.
- Exemples :
|
2
Ag+ (aq)
+
Cu
→ 2
Ag
+
Cu2+ |
|
Cu2+
(aq)
+
Zn
(s)
→
Cu
(s)
+
Zn2+
(aq) |
- On peut écrire :
Ox
1
+
Red
2
→
Red
1
+ Ox
2
- Remarque :
► Cas de la pile zinc-cuivre :
- Équation de la réaction :
|
Cu2+ (aq)
+
2 e
– →
Cu
(s) |
Borne
+ |
|
Zn
(s)
→ Zn2+
(aq)
+
2 e
– |
Borne – |
|
Cu2+
(aq)
+ Zn
(s)
→
Cu
(s)
+
Zn 2+
(aq) |
|
- Le pôle – de la pile est le siège d'une oxydation, on l'appelle l'anode.
- Le pôle + de la pile est le siège d'une réduction, on l'appelle la cathode.
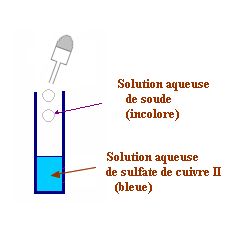
- Que se passe-t-il lorsque l’on plonge une lame de zinc Zn (s) dans un bécher contenant une solution aqueuse de sulfate de cuivre II (Cu2+ aq + SO42– aq) ?
![]() Expérience : Lame de zinc plongée
dans une solution de sulfate de cuivre
II..
Expérience : Lame de zinc plongée
dans une solution de sulfate de cuivre
II..

- Cela revient à mettre en présence les réactifs de la réaction suivante :
|
Cu2+
(aq) +
Zn
(s)
→
Cu
(s)
+
Zn2+
(aq) |
- Si on réalise l’expérience, on observe :
-
Que la lame de zinc se recouvre
d’un dépôt rougeâtre de cuivre métal Cu
(s).
- Que la solution initialement bleue se décolore lentement.
-
Lors de cette réaction, les ions
cuivre II Cu2+
(aq) sont réduits en
cuivre métal Cu
(s)
- Et le zinc métal Zn (s) est oxydé en ions zinc II Zn2+ (aq).
- L’équation de la réaction est la même que celle qui se produit dans la pile zinc-cuivre.
-
Le transfert d’électrons se fait
directement par contact entre les réactifs le cuivre
métal Cu (s) et
les ions zinc II Zn2+
(aq).
- Les électrons n’existent pas en solution aqueuse et ils ne peuvent pas s’accumuler sur les électrodes.
► Cas de la pile zinc-cuivre :
- Dans le cas de la pile zinc-cuivre, les électrons se déplacent de l’électrode de zinc vers l’électrode de cuivre, à l’extérieur de la pile, grâce au circuit électrique.
- Il s’est produit un échange d’électrons de façon indirecte par l’intermédiaire du circuit électrique.
3)- Écriture de l’équation d’une réaction d’oxydoréduction.
a)- Expérience 1 : Réaction entre le cuivre métal et une solution de nitrate d’argent.
![]() Verser 50 mL de solution de
nitrate d’argent dans un bécher.
Verser 50 mL de solution de
nitrate d’argent dans un bécher.
![]() Plonger un fil ou une lame de
cuivre dans les 50 mL de la solution.
Plonger un fil ou une lame de
cuivre dans les 50 mL de la solution.
- Attendre 5 à 10 minutes et observer.
- Verser environ 2 mL de la solution obtenue dans un tube à essais. Ajouter quelques gouttes de soude. Observer et interpréter.
- Par des schémas légendés, décrire l’état initial et l’état final du système chimique.
- Écrire l’équation bilan de la réaction.
|
- Au bout de quelques minutes (20 min environ)
-Expérience avec un serpentin de cuivre. - Au cours de la réaction, il se forme un dépôt gris argenté d’argent métal Ag (s). - La solution prend une teinte bleue. - Le test à la soude avec la solution, donne la formation d’un précipité bleu.
- Il se forme des ions cuivre II, Cu 2+ (aq) au cours de la réaction. |
- Équation bilan de la réaction :
- L’équation d’une réaction d’oxydoréduction peut être établie en combinant les deux demi-équations électroniques des couples oxydant-réducteur mis en jeu de façon à ce que les électrons n’apparaissent pas dans le bilan de la réaction.
- La réaction entre le cuivre métal Cu (s) et les ions argent Ag + (aq) fait intervenir les couples oxydant / réducteur Cu2+ (aq) / Cu (s) et Ag+ (aq) / Ag (s).
- Les demi-équations électroniques sont écrites de façon à ce que le cuivre métal Cu (s) et les ions argent Ag+ (aq) soient les réactifs :
|
Demi-équations
électroniques |
Cu (s) = Cu2+ (aq) + 2 e – |
|
2
(
Ag+
(aq)
+
e
–
=
Ag
(s)
) |
|
|
Bilan |
Cu
(s)
+
2
Ag+
(aq)
→
Cu2+
(aq)
+
2
Ag
(s) |
► Remarque : cette méthode est générale.
4)- Établir une demi-équation électronique.
a)- Exemple1 : Le couple MnO4 – / Mn2+.
-
Une solution aqueuse de
permanganate de potassium est violette.
-
La coloration de la solution est
due à la présence des ions permanganate :
MnO4
–.
- Cette solution se décolore quand l’ion permanganate se transforme en ion manganèse Mn2+ incolore.
- Exercice : Écrire la demi-équation électronique du couple MnO4 – / Mn 2+.
- Pour ce faire, on utilise une méthode systématique qui comprend plusieurs étapes :
|
|
Demi-équation électronique |
|
Première étape : On écrit le couple
oxydant / réducteur |
MnO4–
(aq) =
Mn2+
(aq)
|
|
Deuxième étape : On équilibre l’élément oxygène
avec de l’eau |
MnO4–
(aq) =
Mn2+
(aq)
+
4
H2O
(ℓ) |
|
Troisième étape : On équilibre l’élément hydrogène avec H + (on travaille
en milieu acide) |
MnO4–
(aq)
+
8
H
+
(aq) =
Mn2+
(aq)
+
4
H2O
(ℓ) |
|
Quatrième étape : On équilibre les charges avec
les électrons. |
MnO4–
(aq)
+
8
H
+
(aq) +
5
e
– =
Mn2+
(aq)
+
4
H2O
(ℓ) |
- Conclusion : l’ion permanganate est un oxydant en milieu acide.
b)- Exemple 2 : Le couple Cr2O72– (aq) / Cr3+ (aq)
-
Une solution aqueuse de
dichromate de potassium est jaune orangé.
-
La coloration de la solution est
due à la présence des ions dichromate :
Cr2O72–
(aq).
- Cette solution change de couleur quand l’ion dichromate se transforme en ion chrome III Cr3+ (aq). Elle prend une teinte verte.
- Exercice : écrire la demi-équation électronique du couple Cr2O72– (aq) / Cr 3+ ((aq).
|
|
Demi-équation électronique |
|
Première étape : On écrit le couple
oxydant / réducteur |
Cr2O72–
(aq)
=
Cr3+(aq)
|
|
Deuxième étape : On équilibre
l’élément chrome |
Cr2O72–
(aq)
= 2
Cr3+ (aq)
|
|
Troisième étape : On équilibre l’élément oxygène
avec de l’eau |
Cr2O72–
(aq)
=
2
Cr3+
(aq) +
7
H2O
(ℓ) |
|
Quatrième étape : On équilibre l’élément hydrogène avec H + (on travaille
en milieu acide) |
Cr2O72–
(aq)
+
14
H+
(aq) =
2
Cr3+
(aq) +
7
H2O
(ℓ) |
|
Cinquième étape : On équilibre les charges avec
les électrons. |
Cr2O72–
(aq)
+
14
H+
(aq)
+ 6
e
–
=
2
Cr3+ (aq) +
7
H2O
(ℓ) |
- Remarque : le couple Cr2O72– (aq) / Cr3+ (aq) est utilisé dans certains alcooltests : les éthylotests chimiques.
- L'alcootest est constitué d’un sac avec un embout dans lequel on souffle.
Alcooltest

Embout agrandi

- L’embout contient :
- Du dichromate de potassium de couleur jaune orangé,
- Du nitrate d’argent qui permet d’accélérer la réaction chimique (catalyseur)
- De l’acide sulfurique qui permet de capter les molécules d’eau présentes dans l’air expiré.
- Il se produit une réaction d’oxydoréduction entre les ions dichromate et l’éthanol présent dans l’air expiré.
- L’ion dichromate, un oxydant de couleur orange, réagit avec l’éthanol pour donner des ions chrome de couleur verte et de l’acide acétique.
- Les couples oxydant / réducteur :
-
Cr2O72–
(aq) /
Cr3+
(aq) et
CH3COOH
(ℓ) /
CH3CH2OH
(ℓ)
|
Demi-équations
électroniques |
2 (Cr2O72–
(aq)
+
14
H+
(aq)
+ 6
e–
=
2
Cr3+ (aq) +
7
H2O
(ℓ)
)
|
|
3
(CH3CH2OH
(ℓ)
+
H2O
(ℓ)
= CH3COOH
(ℓ)
+
4
H+
(aq) +
4
e–
) |
|
|
Bilan |
2 Cr2O72–
(aq) +
3 CH3CH2OH
(ℓ) +
16
H+
(aq) → 4
Cr3+ (aq) + 3
CH3COOH
(ℓ)
+ 11
H2O
(ℓ)
|
- L’alcootest est un appareil qui permet de donner une valeur approchée de la concentration d’alcool dans le sang d’une personne.
- L’éthanol, contenu dans les boissons alcoolisées, que l’on consomme, se retrouve dans le sang.
- Une certaine quantité d’éthanol traverse les vaisseaux sanguins et se retrouve dans les alvéoles.
- En conséquence, la concentration de l’éthanol dans le sang est liée à la concentration de l’éthanol dans l’air alvéolaire.
- Il y a environ autant d’éthanol dans 2000 mL d’air expiré (air alvéolaire) que dans 1 mL de sang.
- Pour contrôler la présence d’éthanol dans le sang, il faut souffler dans l’alcooltest afin de recueillir un certain volume d’air expiré.
- La présence d’éthanol provoque un changement de couleur de l’embout qui passe du jaune-orangé au vert.
- Lorsque le test est positif, une prise de sang est nécessaire pour connaître le taux exact d’alcool éthylique dans le sang.
1)- QCM : Pour chaque question, indiquer la (ou les) bonne(s) réponse(s).
|
|
2)- Exercices : Exercices : énoncé avec correction
a)- Exercice 7 page 298. Étudier la constitution d’une pile.
b)- Exercice 9 page 298. Utiliser la polarité d’une pile.
c)- Exercice 10 page 298. Déterminer la polarité d’une pile.
d)- Exercice 12 page 299. Reconnaître un oxydant et un réducteur.
e)- Exercice 16 page 299. Établir des demi-équations redox.
f)- Exercice 23 page 301. Pile SR à l’oxyde d’argent.
g)- Exercice 24 page 301. Accumulateur lithium-ion.
h)- Exercice 26 page 302. Gravure à l’eau forte.
|
|