|
Chimie N° 02 Notion de couple Oxydant / Réducteur Cours. |
|
|
|
|
II- Réaction entre un cation métallique et un métal. IV- Classification électrochimique des métaux. V- Applications : Exercices 7, 8, 9,10,13, 18 pages 54-56 Correction des exercices (énoncé et correction) |
1)- Les métaux.
- Les 3/4 des corps simples sont des métaux.
- Ils possèdent tous une bonne conductibilité électrique et thermique.
- Ils ont un éclat métallique caractéristique.
- Un cristal métallique est un assemblage compact et ordonné d'atomes identiques.
- On donne au cristal la formule de l'atome qui le constitue.
- Les métaux n'ont pas une structure moléculaire.
2)- Les ions métalliques.
![]() Exemple :
Exemple :
- Donner la représentation ou le schéma de LEWIS de l'atome de calcium.
- En déduire la formule de l'ion calcium que l'on peut obtenir (Z = 20).
- Représentation ou le schéma de LEWIS
- Formule de l'ion calcium : Ca2+
![]() Tous les atomes métalliques peuvent
perdre des électrons et donner des ions chargés positivement : les
cations métalliques.
Tous les atomes métalliques peuvent
perdre des électrons et donner des ions chargés positivement : les
cations métalliques.
- Les cations métalliques existent dans des solides ioniques :
![]() Exemples :
Exemples :
- Le chlorure de sodium NaCl, cristal formé d'un empilement compact et ordonné d'ions sodium et d'ions chlorure Na+ et Cl–.
- La formule NaCl est une formule statistique, le chlorure de sodium n'a pas une structure moléculaire.
- La molécule de NaCl n'existe pas.
- Le fluorure de calcium est un cristal ionique formé d'ions fluorure et d'ions calcium.
- Les proportions permettent de vérifier la neutralité électrique du cristal : CaF2 : un ion Ca2+ pour deux ions F–.
- Un cristal ionique peut se dissoudre dans l'eau et libérer les ions qui le constituent.
- On obtient une solution ionique.
3)- Les ions métalliques en solution.
- Les solutions ioniques sont électriquement neutres.
- Les ions sont dispersés dans la solution et entourés d'un cortège de molécules d'eau : ils sont hydratés.
|
|
eau |
|
|
|
|
CaF2 (s) |
→ |
Ca2+ (aq) |
+ |
2 F– (aq) |
- Pour alléger l'écriture, on utilise la notation Ca2+ pour représenter l'ion calcium hydraté Ca2+ (aq).
4)- Tests de reconnaissance de quelques cations métalliques (TP de chimie N° 9)
II- Réaction entre un cation métallique et un métal.
1)- Réaction entre les ions cuivre II et le fer métal
- On verse une solution bleue de sulfate de cuivre II sur de la limaille de fer.
- On observe :
- La décoloration de la solution
- Une élévation de température
- La formation d'un dépôt métallique.
- Cette réaction est spontanée, naturelle et exothermique.
- Interprétation :
- Au cours de la réaction, les ions cuivre II disparaissent et simultanément, il se forme du cuivre métal.
- On peut écrire la demi-équation bilan électronique :
|
Cu2+ (aq) |
+ |
2 e– |
=
Cu
(s) |
- D'autre part, du fer métal disparaît et il se forme des ions fer II.
- On peut écrire la demi-équation électronique :
|
Fe (s) |
= |
Fe2+ (aq) |
+
2 e– |
- La réaction observée est un transfert d'électrons entre le fer métal et les ions cuivre II.
- Les électrons n'existent pas en solution, en conséquence, le fer a pu céder ces électrons car les ions cuivre II les ont captés.
- L'équation bilan de la réaction est obtenue en superposant les deux demi-équations électroniques de telle sorte que les électrons n'apparaissent pas dans le bilan total :
|
Cu2+ (aq) |
+ |
2 e– |
=
|
Cu
(s) |
|
|
|
|
|
Fe (s) |
= |
2
e– |
+
|
Fe2+
(aq) |
|
|
|
|
|
|
|
|
|
Cu2+
(aq) |
+ |
Fe
(s) |
→ |
Cu |
+ |
Fe2+
(aq) |
2)- Réaction entre les ions argent et le cuivre métal.
- On plonge de la tournure de cuivre dans une solution de nitrate d'argent.
- La réaction est spontanée, le cuivre se recouvre d'un dépôt métallique d'argent et la solution se colore lentement en bleue.
- Écrire les demi-équations et l'équation bilan de la réaction.
|
2 ( Ag+ (aq) |
+ |
e– |
=
|
Ag
(s)
) |
|
|
|
|
|
Cu (s) |
= |
2
e– |
+
|
Cu2+
(aq) |
|
|
|
|
|
|
|
|
|
2 Ag+
(aq) |
+ |
Cu
(s) |
→ |
2
Ag
(s) |
+ |
Cu2+
(aq) |
1)- Définitions.
![]() Une oxydation est une perte d'électrons
Une oxydation est une perte d'électrons
![]() Une réduction est un gain d'électrons
Une réduction est un gain d'électrons
![]() Un réducteur est une espèce chimique qui
cède des électrons.
Un réducteur est une espèce chimique qui
cède des électrons.
![]() Un oxydant est une espèce chimique qui
gagne des électrons.
Un oxydant est une espèce chimique qui
gagne des électrons.
![]() Une réaction d'oxydoréduction est une
réaction de transfert d'électrons.
Une réaction d'oxydoréduction est une
réaction de transfert d'électrons.
![]() Au cours d'une réaction d'oxydoréduction,
un oxydant est réduit et un réducteur oxydé.
Au cours d'une réaction d'oxydoréduction,
un oxydant est réduit et un réducteur oxydé.
► Question : pour de la réaction entre le fer métal et les ions cuivre II, donner l'oxydant et le réducteur.
- L'ion cuivre II gagne 2 électrons : Cu2+ oxydant. Il est réduit.
- Le fer métal cède 2 électrons Fe réducteur. Il est oxydé.
2)- Les couples oxydant / réducteur : Ox / red.
a)- Étude du couple Cu2+ / Cu.
- Réaction entre le fer métal et les ions cuivre II.
|
|
|
|
Réduction |
|
|
|
|
Cu2+ (aq) |
+ |
2
e– |
→ |
Cu (s) |
|
|
|
Ox |
|
|
|
Red |
|
|
- Réaction entre les ions argent et le cuivre métal.
|
|
|
|
Oxydation |
|
|
|
|
Cu (s) |
|
|
→ |
Cu2+ (s) |
+ |
2
e– |
|
Red |
|
|
|
|
|
|
- En conséquence :
- L'ion cuivre II (oxydant) est la forme oxydée du cuivre métal (réducteur) ou le cuivre métal est la forme réduite de l'ion cuivre II.
- On utilise l'écriture condensée :
| Forme Oxydée |
|
|
Réduction |
Forme réduite |
|
|
|
|
|
|
→ |
|
|
|
|
Cu2+ (aq) |
+ |
2
e– |
= |
Cu (s) |
|
|
|
|
|
|
← |
|
|
|
|
Ox |
|
|
Oxydation |
Red |
|
|
- Cu2+ / Cu forment un couple Oxydant / réducteur.
b)- Généralisation.
- Deux espèces Ox et Red forment un couple oxydant / réducteur si le gain de n électrons par Ox conduit à Red. On écrit :
- Ox
+ n
e–
= Red
- Par convention, l'oxydant figure toujours à droite.
- Exemples :
|
Fe2+ |
+ |
2 e– |
=
Fe |
|
Ag+ |
+ |
e– |
=
Ag |
3)- Réaction d'oxydoréduction en solution aqueuse.
- Considérons deux couples Ox / Red dont les demi-équations électroniques sont :
- Ox1
+ n1
e–
= Red1
- Ox2
+ n2
e–
= Red2
- Quelles sont les réactions possibles entre ces couples ?
- Ox1 ne peut pas réagir sur Ox2 et Red1 ne peut pas réagir sur Red2.
- Ox1 peut réagir sur Red2 ou Ox2 peut réagir sur Red1.
- Écriture des deux équations bilans :
|
n2 (Ox1 |
+ |
n1 e– |
=
|
Red1
) |
|
|
|
|
|
n1(Red2 |
= |
n2
e– |
+
|
Ox2) |
|
|
|
|
→1 |
|
|
|
|
n2
Ox1 |
+ |
n1
Red2 |
= |
n2
Red1 |
+ |
n1
Ox2 |
|
|
|
|
2← |
|
|
|
- La réaction peut se faire soit dans le sens (1), soit dans le sens (2).
- Cela dépend de la force relative des oxydants et des réducteurs mis en présence.
- Le but de la suite de la leçon et d'arriver à prévoir le sens des réactions d'oxydoréduction.
IV- Classification électrochimique des métaux.
1)- Étude des couples Fe2+ / Fe et Cu2+ / Cu.
- Lorsque l'on plonge un morceau de fer dans une solution contenant des ions cuivre II, une réaction se produit spontanément :
|
Cu2+
(aq) |
+ |
Fe
(s) |
→ |
Cu |
+ |
Fe2+
(aq) |
- Si l'on plonge un morceau de cuivre dans une solution contenant des ions fer II, aucune réaction ne se produit :
|
Fe2+
(aq) |
+ |
Cu
(s) |
→ |
Rien
|
|
|
- Les deux couples qui interviennent sont Cu2+ / Cu et Fe2+ / Fe.
- Conséquences :
- Le fer métal réduit les ions cuivre II alors que le cuivre métal ne peut pas réduire les ions fer II
- On dit que le fer métal est un réducteur plus fort que le cuivre métal
- D'autre part, l'ion cuivre II oxyde le fer métal alors que l'ion fer II ne peut pas oxyder le cuivre métal.
- On dit que l'ion cuivre II est un oxydant plus fort que l'ion fer II.
2)- Conclusion.
- La réaction naturelle ou spontanée entre deux couples Ox / Red fait intervenir l'oxydant le plus fort et le réducteur le plus fort.
- L'oxydant le plus fort réagit avec le réducteur le plus fort pour donner l'oxydant le plus faible et le réducteur le plus faible.
- Connaissant la réaction naturelle entre ces deux couples, on peut les classer sur un axe y'Oy :
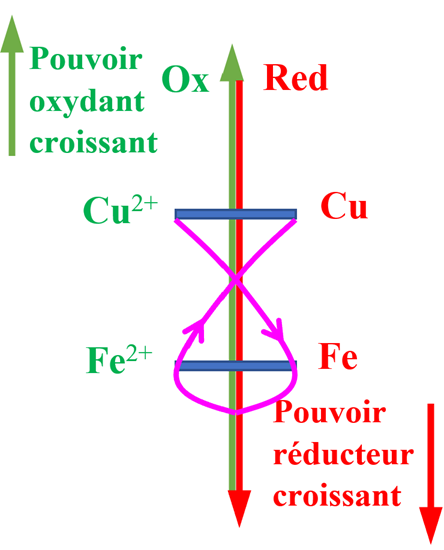
- Règle du gamma : Elle permet de trouver le sens de la réaction naturelle.
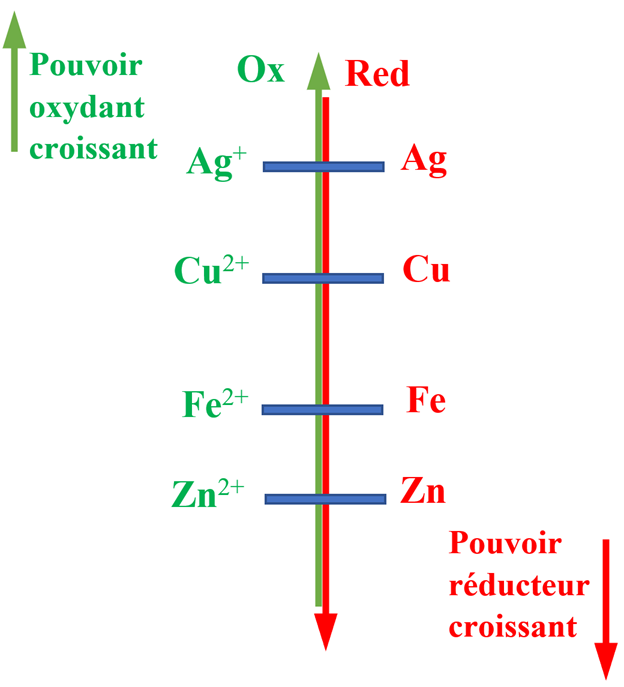
2)- Étude d'autres couples.
- Considérons les couples suivants : Cu2+ / Cu, Fe2+ / Fe, Zn2+ / Zn et Ag+ / Ag.
- On donne :
- Si l'on plonge un fil de cuivre dans une solution de nitrate de cuivre,
- Le fil de cuivre se recouvre d'un dépôt d'argent métallique,
- Un fil de fer plongé dans une solution de sulfate de cuivre II se recouvre d'un dépôt de cuivre métal,
- Les ions fer II réagissent avec le zinc métal pour donner du fer et des ions fer II.
- Construire la classification qualitative de ces couples oxydant / réducteur.
- Si on met en présence les couples Ag+ (aq) / Ag (s) et Cu2+ (aq) / Cu (s)
- D’après la règle du gamma, il se produit la réaction suivante :
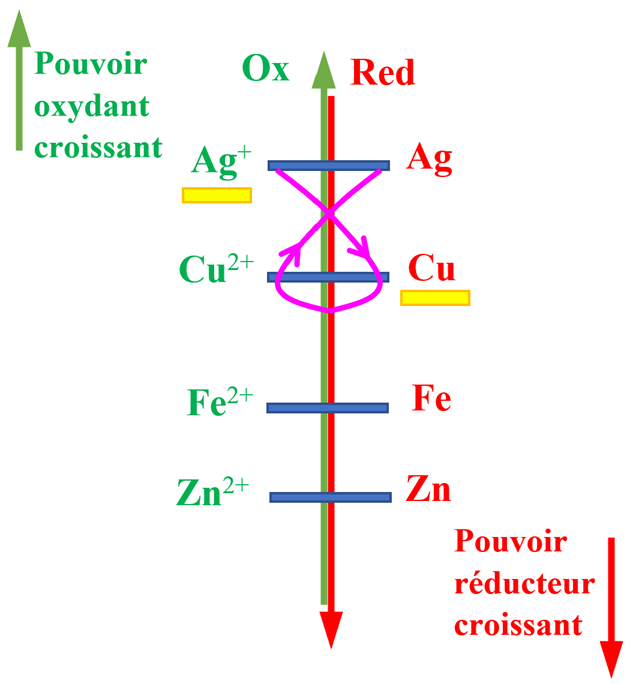
|
(Ag+ (aq) +
e–
|
2 |
|
Cu
(s)
|
1 |
|
2
Ag+ (aq)
+
Cu (s) →
2
Ag
(s)
+
Cu2+ (aq)
|
|
3)- Utilisation de la classification qualitative.
Liste des couples oxydant / réducteur
- Entre deux couples oxydant / réducteur la seule réaction, qui peut se produire, est celle de l'oxydant le plus fort sur le réducteur le plus fort :
- C'est la réaction naturelle.
- La règle du gamma permet de retrouver le sens de la réaction naturelle.
- Remarque : plus un réducteur est fort et plus son oxydant conjugué est faible et inversement.
|
|
|
|
 Ag (s)
Ag (s)
