|
QCM N° 17 |
Piles, accumulateurs et oxydoréduction |
|
|
|
|
QCM N° 17 : Piles, accumulateurs et oxydoréduction
Pour chaque question,
indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
|
Pile bouton Schéma de la pile zinc-cuivre |
|
|||
|
1 |
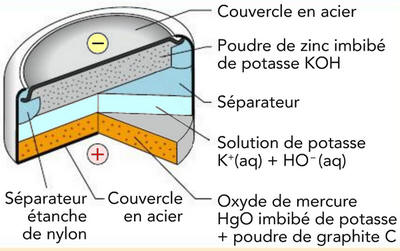
Dans la pile bouton, l’électrolyte est : |
L’acier |
La potasse K+ + HO– |
Le graphite C |
B |
|
2 |
Dans la pile bouton l’oxyde de mercure HgO (s) : |
Constitue l’électrolyte |
Est une électrode |
Est l’un des réactifs |
C |
|
3 |
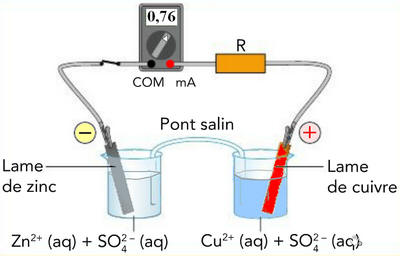
Dans la pile zinc-cuivre, le courant : |
Sort de l’électrode de cuivre |
Traverse la pile de l’électrode de zinc vers l’électrode de cuivre |
Rentre par l’électrode de cuivre |
AB |
|
4 |
Dans la pile zinc-cuivre, les électrons arrivant à l’électrode de cuivre : |
Passent en solution |
Sont captés par les ions Cu2+ (aq) |
S’accumulent sur l’électrode |
B |
|
5 |
Dans la pile zinc-cuivre, des ions zinc II Zn2+ (aq) |
Captent des électrons |
Sont formés au niveau de l’électrode de zinc |
Se déplacent dans la solution |
BC |
|
6 |
Dans la pile zinc- cuivre, le pont salin : |
Assure le passage du courant |
Contient des ions |
Est constitué par un métal |
AB |
|
7 |
La polarité d’une électrode peut dépendre : |
Seulement de l’électrode |
Des deux couples constituant la pile |
De la nature du pont salin |
B |
|
8 |
Pour le couple Ag+ (aq) / Ag (s) : |
L’oxydant est Ag (s) |
L’oxydant est Ag+ (aq) |
Le réducteur est Ag (s) |
BC |
|
9 |
Pour la demi-équation redox : Cl2 (g) + 2 e– = 2 Cl– (aq) |
Cl2 (g) est l’oxydant |
Cl– (aq) est le réducteur |
Le couple mis en jeu s’écrit : Cl2 (g)/Cl– (aq) |
ABC |
|
10 |
Une réaction d’oxydoréduction : |
A lieu lorsqu’une pile fonctionne |
Met toujours en jeu un transfert d’ions H+ (aq) |
Met en jeu un transfert d’électrons |
AC |
|
11 |
La réaction suivante :
|
Met en jeu les couples : Fe (s)/Fe2+ (aq) et Zn (s)/Zn2+ (aq) |
Est une réaction d’oxydoréduction |
Correspond à la réduction des ions Fe2+ (aq) par Zn (s) |
BC |
|
12 |
Lorsqu’une pile fait circuler un courant électrique : |
Ce courant sort de la borne |
Les électrons qui circulent sortent par la borne
|
L’oxydant du couple correspondant à la borne
est réduit |
AC |
|
13 |
On considère la demi-équation redox suivante : Fe3+ (aq) + e– = 2 Fe2+ (aq) Le réducteur est : |
Fe2+ (aq) |
e– |
Fe3+ (aq) |
A |
|
14 |
On considère la demi-équation redox suivante : a I2 (g) + b e– = c I– (aq) les nombres stœchiométriques ajustés sont : |
a = 1 b = 1 c = 1 |
a = 1 b = 2 c = 2 |
a = 1 b = 1 c = 2 |
B |
|
15 |
On considère la réaction d’oxydoréduction suivante : 2 Ag+ (aq) + Cu (s) → 2 Ag (s) Alors : |
Ag+ (aq) est l’oxydant du couple Ag+
(aq)/Cu (s) |
Cu (s) est l’oxydant du couple Cu2+
(aq)/Cu (s) |
Ag+ (aq) est l’oxydant du couple Ag+
(aq)/Ag (s) |
C |
|
16 |
Les deux demi- équations redox suivantes ont lieu lorsqu’une pile est en fonctionnement : Fe (s)
= Fe2+ (aq) + 2 e– et Cu2+ (aq) + 2 e–
=
Cu (s) L’équation de la réaction d’oxydoréduction s’écrit : |
|
|
|
A |
|
17 |
Lors du fonctionnement d’une pile, les échanges d’électrons se font : |
À l’intérieur de la solution |
Dans le circuit extérieur |
À la surface du conducteur métallique |
C |
|
18 |
Lors du fonctionnement d’une pile : |
Des électrons arrivent au pôle |
Des anions arrivent au pôle |
Des électrons arrivent au pôle
|
A |
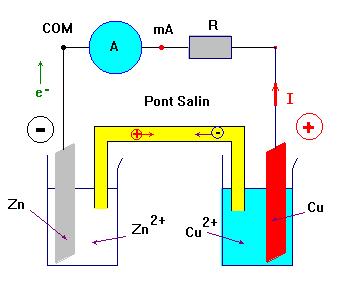
- Dans les solutions et le pont électrolytique ce sont les ions qui se déplacent et dans les fils conducteurs, ce sont les électrons.
- Les porteurs de charge dans les métaux et le graphite sont les électrons. Les porteurs de charge dans les électrolytes sont les ions.
- Le sens conventionnel du courant est lié en sens de déplacement des porteurs de charge positifs.
- Le courant traverse le conducteur ohmique et l’ampèremètre en se déplaçant de la plaque de cuivre vers la plaque de zinc.
- Les plaques métalliques, les fils de connexion, le conducteur ohmique et l’ampèremètre sont parcourus
- par des électrons qui se déplacent en sens inverse du sens du courant.
- Les solutions aqueuses ioniques sont le siège de déplacement d’ions.
- Les ions positifs ou cations (Zn 2+, Cu 2+, …) se déplacent dans le sens du courant.
- Les ion négatifs ou anions se déplacent dans le sens inverse du courant.
- Lorsque les espèces chimiques participant à la réaction d’oxydoréduction sont séparées,
- on peut réaliser un transfert spontané et indirect du réducteur vers l’oxydant,
- par l’intermédiaire d’un conducteur métallique. Les piles fonctionnent sur ce principe.
2)- Force électrochimique d’une pile.
- Pour mesurer la f.é.m. d’une pile ou d’un générateur, on utilise un voltmètre électronique.
- Un voltmètre électronique possède une grande résistance interne.
- En conséquence, lors de la mesure, la pile débite un courant d’intensité très faible.
- La tension mesurée est sensiblement égale à la force électromotrice de la pile.
- On peut écrire : U = (VCu – VZN) I = 0 ≈ ECu–Zn ≈ 1,1 V
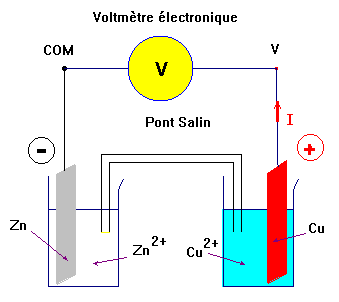
- Fonctionnement d’une pile.
- Le fonctionnement de la pile se déduit de la mesure de la f.é.m. ou du sens de déplacement du courant.
- Exemple : Lorsque l’on mesure la f.é.m. de la pile zinc – cuivre, on trouve :
-
U
= (VCu –
VZN)
I
= 0 ≈ ECu–Zn ≈ 1,1 V
- Cette f.é.m. est positive.
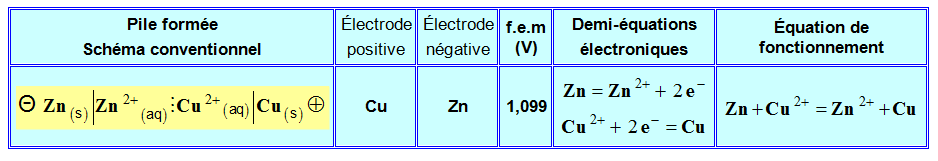
- Lors du fonctionnement de la pile Zinc – cuivre, le courant circule, à l’extérieur de la pile du pôle positif (électrode de cuivre) vers le pôle négatif (électrode de zinc).
- En conséquence, les électrons, responsables du passage du courant dans le circuit extérieur (circuit électrique), se déplacent de l’électrode de zinc vers l’électrode de cuivre.
- À l’électrode de zinc se produit une réaction qui cède des électrons, c’est une oxydation : c’est l’anode.
- Zn (s) = Zn2+ + 2 e–
- À l’électrode de cuivre se produit une réaction qui consomme des électrons, c’est une réduction : c’est la cathode
- Cu2+ (aq) + 2 e– = Cu (s)
- À l’intérieur de la pile, le courant électrique est dû à une double migration des ions positifs et négatifs se déplaçant en sens inverse.
- Les cations se déplacent dans le sens du courant et les anions dans le sens inverse.
- Lorsque la pile fonctionne :
- La demi-pile Cu2+/ Cu consomme des ions cuivre II : leur concentration diminue.
- La demi-pile Zn2+/ Zn forme des ions zinc II : leur concentration augmente.
- L’électroneutralité de chaque solution est maintenue grâce à la circulation des ions dans le pont salin.
- Les couples :

|
|