|
Étude de piles d'oxydoréduction. Enoncé. |
|
|
|
|
Programme 2012 : Physique et Chimie Programme 2020 : Physique et Chimie |
|
Matériel : 5 Béchers (par groupe) Pont salin (bandes de papier filtre) Pour chaque groupe : Lames de cuivre, de zinc, de fer, de plomb Solutions de sulfate de cuivre II, de sulfate de zinc II, de sulfate de fer II (sel de Mohr), de nitrate de plomb II, Solution de chlorure de potassium de concentration (ou nitrate d’ammonium) C ≈ 0,10 mol / L. Solution de soude de concentration CB = 1,0 mol / L Papier filtre – verre à pied – Multimètre (1) – fils de connexion (2) pinces crocodiles rouges et noires – toile émeri. Remarque : la solution de sel de Mohr est légèrement
acidifiée et
fraîchement préparée. |
I- But.
Étudier le fonctionnement de quelques piles d’oxydoréduction.
II- Fonctionnement d’une pile.
1)- Expériences.
![]() À l’aide de différentes lames métalliques, de béchers et des solutions réaliser
les demi-piles suivantes :
À l’aide de différentes lames métalliques, de béchers et des solutions réaliser
les demi-piles suivantes :
- Fe 2+ / Fe ; Zn 2+ / Zn ; Cu 2+ / Cu; Pb 2+ / Pb
- Modèle : demi-pile
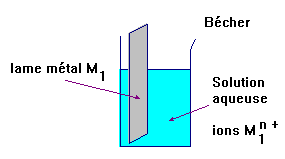
![]() Faire un schéma du dispositif indiquant
comment à partir de 2 demi-piles, on peut constituer une pile.
Faire un schéma du dispositif indiquant
comment à partir de 2 demi-piles, on peut constituer une pile.
- En donner un montage équivalent à l’aide d’un vase poreux (papier filtre imbibé de solution de chlorure de potassium ou de nitrate d’ammonium).
- Exemple :

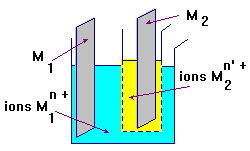
2)- Mesures.
![]() Réaliser une pile à partir de deux demi-piles, puis à l’aide d’un voltmètre
électronique mesurer la tension qui existe entre les deux lames métalliques.
Réaliser une pile à partir de deux demi-piles, puis à l’aide d’un voltmètre
électronique mesurer la tension qui existe entre les deux lames métalliques.
![]() Bien décaper les lames avant de les utiliser comme électrodes et changer le
pont salin réalisé avec le papier filtre entre chaque mesure.
Bien décaper les lames avant de les utiliser comme électrodes et changer le
pont salin réalisé avec le papier filtre entre chaque mesure.
- Reproduire cette mesure en réalisant toutes les piles possibles à partir des demi-piles.
- Repérer la façon dont on a branché le voltmètre électronique (borne V et borne COM)

![]() Comment se nomme et se note la
valeur absolue de la tension mesurée par le voltmètre électronique ?
Comment se nomme et se note la
valeur absolue de la tension mesurée par le voltmètre électronique ?
3)- Exploitation des mesures.
- À partir du branchement du voltmètre électronique et de la valeur de la tension mesurée, indiquer dans un tableau pour chaque pile :
- La force électromotrice f.é.m.
- La polarité de chaque électrode.
- Le schéma conventionnel
de la pile en utilisant le modèle suivant :
![]()
- Les demi-équations électroniques à chaque électrode.
- L’équation de fonctionnement de la pile.
- Quel type de réaction a toujours lieu à la borne positive de la pile et quel type de réaction a toujours lieu à la borne négative de la pile ?
- Comment nomme-t-on la borne positive et la borne négative d’une pile ?
|
Pile formée Schéma conventionnel |
Électrode positive |
Électrode négative |
f.é.m. (V) |
Demi-équations électroniques |
Équation de fonctionnement |
III- Étude complémentaire.
1)- Pile plomb – zinc.
![]() Réaliser un schéma sur lequel on indiquera :
Réaliser un schéma sur lequel on indiquera :
- Le sens de déplacement des porteurs de charge à l’intérieur et à l’extérieur de la pile
- Le sens du courant.
![]() Comment évoluent les concentrations
des ions dans chaque demi-pile ?
Comment évoluent les concentrations
des ions dans chaque demi-pile ?
- Comment évoluent les masses des électrodes ?
- Quel est le rôle du pont salin ?
2)- Influence de la concentration.
![]() Réaliser
la pile cuivre – zinc.
Réaliser
la pile cuivre – zinc.
- Mesurer la force électromotrice de cette pile.
- Verser lentement la solution de soude dans le bécher contenant la solution de sulfate de cuivre II.
- Après chaque ajout, mesurer la force électromotrice de la pile.
![]() Comment évolue la force électromotrice ?
Écrire la réaction de précipitation. Conclusion.
Comment évolue la force électromotrice ?
Écrire la réaction de précipitation. Conclusion.
3)- Application : La pile Daniell Zn – Cu.
On veut étudier l’influence de la concentration en ions zinc II sur la f.é.m. d’une pile Daniell.
On réalise 4 piles Daniell en utilisant 4 solutions de sulfate de zinc de concentrations :
C1 = 1,0 mol / L, puis, C2 = 0,10 mol / L, C3 = 0,010 mol / L et C4 = 0,0010 mol / L.
On mesure chaque fois la f.é.m. de la pile ainsi réalisée.
La concentration de la solution de sulfate de cuivre II ne change pas et C = 1,0 mol / L.
Les mesures effectuées sont données dans le tableau suivant.
|
[
Zn2+
] mol / L |
1,0 |
0,10 |
0,010 |
0,0010 |
|
[
Cu2+
] mol / L |
1,0 |
1,0 |
1,0 |
1,0 |
|
E
V |
1.10 |
1,13 |
1,16 |
1,18 |
|
Qr,
i |
|
|
|
|
|
log
Qr,
i |
|
|
|
|
a)- Donner l’équation de fonctionnement de la pile.
Donner l’expression du quotient de réaction.
En déduire la valeur du quotient de réaction dans l’état initial pour chaque cas étudié.
Compléter le tableau.
b)- Déterminer la valeur de E0, f.é.m. de la pile lorsque les deux cations métalliques des couples mis en jeu possèdent la même concentration.
c)- Tracer E en fonction de log Q r, i.
Que représente l’ordonnée à l’origine ?
Conclusion.
d)- Comparer le résultat
obtenu à l’équation de Nernst :
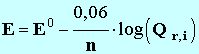 .
.
n représente le nombre d’électrons échangés au cours de la transformation.