|
QCM N° 17 a |
Piles et accumulateurs. |
|
|
|
|
QCM N° 17 a :
Piles et Accumulateurs :
Pour chaque question,
indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
Une pile : |
doit être
recyclée. |
stocke de l’énergie sous forme
chimique. |
est un
générateur. |
ABC |
|
2 |
Un
accumulateur :
|
est un
générateur. |
peut être
rechargé. |
produit des gaz à effet
de serre. |
AB |
|
3 |
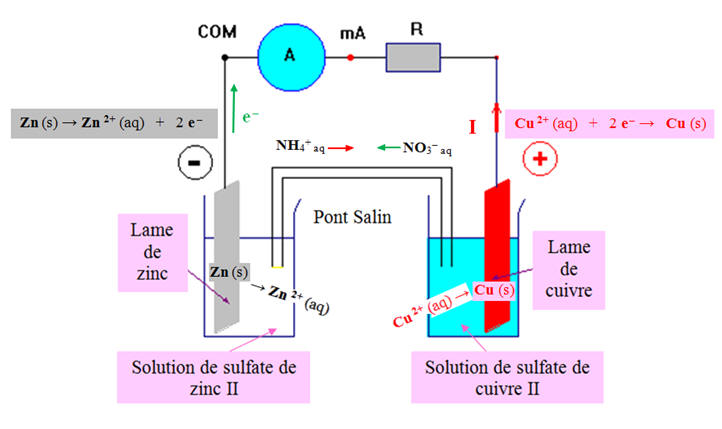
Dans la pile zinc-cuivre, du document ci-dessous, le courant : |
sort de l’électrode
de
cuivre. |
traverse la pile de l’électrode de zinc vers l’électrode
de cuivre. |
a le même sens que le déplacement
des électrons. |
AB |
|
4 |
Dans la pile zinc-cuivre, du document ci-dessous, les électrons arrivant à l’électrode de cuivre : |
passent
en solution. |
sont captés par les ions
Cu2+ (aq) |
s’accumulent dans
l’électrode. |
B |
|
5 |
Dans la pile zinc-cuivre, du document ci-dessous, des ions
Zn2+
(aq) : |
captent des
électrons. |
sont
formés. |
se déplacent dans la
solution |
BC |
|
6 |
Dans une pile, les réactions aux électrodes dépendent : |
du circuit
extérieur. |
des deux couples constituant
la pile. |
de la nature du pont
salin. |
B |
|
7 |
Pour le couple Ag+
(aq) / Ag (s) : |
l’oxydant
est
Ag (s) |
l’oxydant est
Ag+ (aq) |
le réducteur
est
Ag (s) |
BC |
|
8 |
Dans la demi-équation redox :
Cl2
(g) + 2 e
– = 2
Cl–
(aq) : |
Cl2 (g) est
l’oxydant. |
Cl– (aq) est le
réducteur. |
Cl2 (g) est oxydé
en
Cl–
(aq) |
AB |
|
9 |
Une réaction d’oxydoréduction :
|
a lieu lorsqu’une pile
fonctionne. |
met toujours en jeu un transfert d’ions
H+ (aq). |
met toujours en jeu un transfert
d’électrons. |
AC |
|
10 |
La
réaction d’équation : Fe2+ (aq) + Zn (s) → Fe (s) +
Zn2+
(aq) |
met en jeu les couples Zn (s) / Zn2+ (aq) et
Fe (s) / Fe2+
(aq) |
met en jeu un transfert
d’électrons |
correspond à la réduction de Fe2+ (aq)
par
Zn (s). |
BC |
►
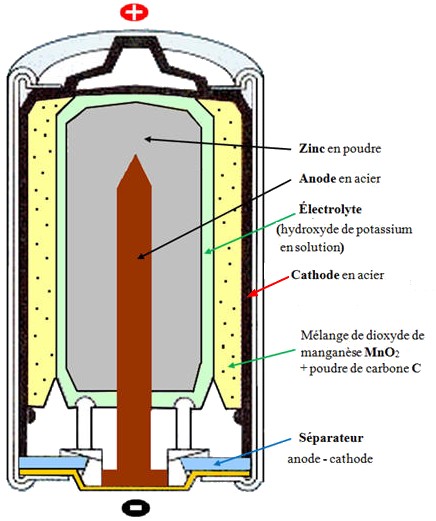
Les piles et accumulateurs :
-
Les piles et les accumulateurs sont des
générateurs électrochimiques.
-
Ils convertissent de l’énergie chimique en
énergie électrique.
-
Ils sont constitués :
-
De deux électrodes,
-
Les électrodes sont en contact d’un milieu
conducteur, appelé électrolyte.
-
Ils sont caractérisés par une force
électromotrice E (f.é.m) (volt V) et une résistance interne r
(Ω).
-
Lorsque la pile débite du courant électrique,
des réactions chimiques se produisent au niveau des électrodes.
-
Le bilan des réactions chimiques (réactions
électrochimiques) qui se produisent à chacune des électrodes de la pile
donne l’équation de la réaction chimique :
-
Il faut recycler les piles car elles
contiennent des produits chimiques, des métaux lourds,….
-
Une pile ne peut pas être rechargée.
-
Lorsqu’on l’utilise, elle s’use et se
décharge.
-
Un accumulateur se décharge lors de son
utilisation. Mais, on peut le recharger.
-
Lors de la charge de l’accumulateur par le
générateur, on transforme de l’énergie électrique en énergie chimique.
-
Il se produit les réactions
inverses aux niveaux des électrodes. On réalise une électrolyse.
-
Exemple : accumulateur au lithium

-
Un accumulateur est un système chimique qui
fonctionne comme une pile (générateur), lorsqu'il se décharge et qui a la
possibilité d'être rechargé comme une batterie de voiture classique (d'où le
nom impropre de « pile rechargeable ») ; il se comporte alors comme un
récepteur.
-
Les recherches actuelles pour les véhicules
électriques tendent à utiliser des accumulateurs « Li-ion » dans lesquels
l'élément lithium est apporté sous forme ionique par le composé LiFePO4.
La tension de fonctionnement de ces accumulateurs est de l'ordre de UPN
= 3,3 V.
-
Leur temps de recharge a été considérablement
diminué mais reste malgré tout encore d'environ de trois heures
►
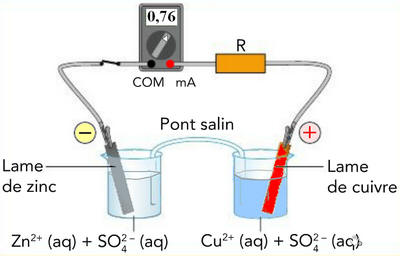
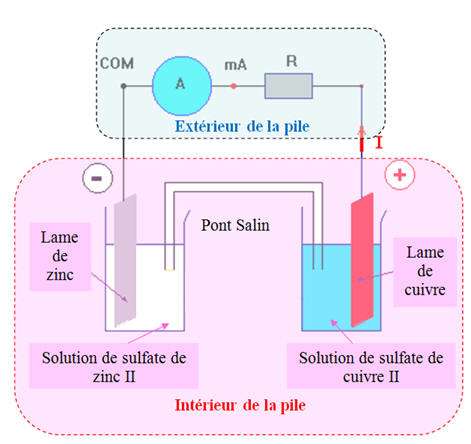
Pile Zinc-Cuivre :
La pile Daniell
-
Fonctionnement :
-
Dans le cas présent, l’électrode de cuivre
constitue la borne positive de la pile et l’électrode de zinc la borne
négative.
-
Le courant généré par cette pile circule de
l’électrode de cuivre vers l’électrode de zinc à l’extérieur de la pile.
-
Les électrons, responsables du passage de ce
courant dans le circuit électrique (fils et électrodes), circule de
l’électrode de zinc vers l’électrode de cuivre à l’extérieur du circuit.
-
À l’intérieur de la pile les porteurs de
charges sont les ions.
-
Le courant électrique à l’intérieur de la
pile est dû à la double migration des ions positifs et négatifs, présents
dans les différentes solutions, se déplaçant en sens inverses.
-
Remarque : Les électrons n’existent pas en
solution aqueuse et ils ne peuvent pas s’accumuler sur la plaque. Ils se
déplacent vers l’électrode de cuivre grâce au circuit électrique.
-
Les cations se déplacent dans le sens du
courant électrique et les anions se déplacent en sens inverse de celui du
courant électrique.
►
Pile Zinc-Cuivre :
La pile Daniell
-
Réactions aux électrodes :
-
À la borne positive, ici l’électrode de
cuivre, les électrons qui arrivent sont consommés par la réaction
Cu 2+ (aq)
+ 2
e
– →
Cu
(s)
-
Cette électrode est appelée la Cathode.
-
À la borne négative de la pile, ici
l’électrode de zinc les électrons sont créés par la réaction
Zn (s)
→
Zn 2+
(aq)
+ 2
e
–
-
Cette électrode est appelée l’anode.
-
Réaction de fonctionnement de la pile.
-
Lorsque la pile débite du courant électrique,
des réactions chimiques se produisent au niveau des électrodes.
-
Le bilan des réactions chimiques (réactions
électrochimiques) qui se produisent à chacune des électrodes de la pile
donne l’équation de la réaction chimique :
-
Équation de la réaction :
|
Cu 2+
(aq)
+
2 e
– →
Cu
(s) |
|
Zn
(s)
→
Zn 2+
(aq)
+
2 e
– |
|
Cu
2+ (aq)
+
Zn
(s)
→
Cu
(s)
+
Zn
2+ (aq) |
-
On est en présence d’un générateur
électrochimique qui transforme de l’énergie chimique en énergie électrique.
►
Couples oxydant / réducteur :
-
Oxydant ;
-
Un oxydant est une entité chimique capable de
gagner un ou plusieurs électrons.
-
Oxydant : gagne
-
Exemples : Ag +, Cu
2+, Zn 2+
-
Réducteur :
-
Un réducteur est une entité chimique capable
de perdre un ou plusieurs électrons.
-
Réducteur : perd
-
Exemples : Cu, Zn
►
Couple
Ag
+ (aq) /
Ag
(s) :
-
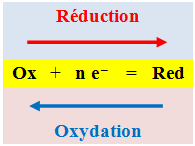
À tout couple oxydant / réducteur, on associe
la demi-équation électronique d’oxydoréduction suivante :
|
Couple Oxydant /
Réducteur |
Ox
+
n
e
–
=
Red |
|
Ag +
(aq) /
Ag
(s) |
Ag
+ (aq)
+ e
–
=
Ag
(s) |
-
L’espèce Ag +
(aq) est réduite en
l’espèce Ag (s).
-
L’espèce Ag
(s) est oxydée en l’espèce
Ag + (aq).
-
Ceci est une écriture formelle.
-
Le signe égal traduit la possibilité de
passer d’une forme à l’autre suivant les conditions expérimentales.
►
Couple Cl2 (g) /
Cl– (aq) :
|
Couple Oxydant /
Réducteur |
Ox
+
n
e
–
=
Red |
|
Cl2 (g) /
Cl– (aq) |
Cl2
(g)
+ 2
e
–
=
2 Cl–
(aq) |
-
L’espèce Cl2 (g) est
réduite en l’espèce Cl– (aq).
-
L’espèce Cl– (aq) est
oxydée en l’espèce Cl2 (g).
►
Réaction d’oxydoréduction :
-
Une réaction d’oxydoréduction est une
réaction qui met en jeu un transfert d’électrons entre ses réactifs.
-
Elle fait agir l’oxydant d’un couple avec le
réducteur d’un autre couple pour donner leurs espèces conjuguées.
-
On peut écrire : Ox1
+ Red2
→
Red1
+ Ox2
-
Lorsque la pile débite du courant électrique,
des réactions chimiques se produisent au niveau des électrodes.
-
Le bilan des réactions chimiques (réactions
électrochimiques) qui se produisent à chacune des électrodes de la pile
donne l’équation de la réaction chimique :
►
Réaction entre les couples Ox / Red :
Fe2+
(aq) / Fe
(s) et
Zn2+
(aq) / Zn
(s)
-
Il se produit la réaction suivante :
Fe2+
(aq) +
Zn
(s)
→
Fe (s) +
Zn2+
(aq)
-
Au cours de cette :
-
L’espèce Fe2+
(aq) a été réduite. C’est
l’oxydant.
-
L’espèce Zn
(s)
a été oxydée. C’est le réducteur.
-
L’oxydant est réduit et le réducteur oxydé.
|
|