|
Chim. N° 07 |
Piles et accumulateurs. Exercices. |
|
|
Mots clés : Piles, accumulateurs, pile saline, pile alcaline, pile Volta,
Pile Daniell, |
|
|
I- Exercice 7 page 298. Étudier la constitution d’une pile.
|
Les piles zinc-air sont actuellement utilisées pour alimenter les systèmes auditifs ou les clôtures électriques. Le schéma de cette pile est donné ci-dessous : 1)- Quelles sont les électrodes de cette pile ? 2)- Quel est son électrolyte ? 3)- Le dioxygène est un des réactifs de la pile. Quel est l’intérêt de cette pile ? Pourquoi les trous d’aération sont-ils obturés jusqu’à la mise en service ? |
|
1)- Les électrodes de cette pile : - Les électrodes de la pile sont les deux parties en acier nickelé (le boîtier de la pile). 2)- L’électrolyte de la pile : - L’électrolyte de la pile est la solution de potasse - K+ (aq) + HO– (aq) 3)- Intérêt de cette pile - L’un des réactifs de cette pile est le dioxygène. - Le dioxygène est l’un des constituants de l’air qui nous entoure. - Ainsi la pile est constituée d’un seul réactif, la poudre de zinc amalgamé, l’autre réactif est le dioxygène de l’air. - Les trous d’aération sont obturés jusqu’à la mise en service, ainsi l’un des réactifs (dioxygène) n’est pas présent et la pile ne peut pas fonctionner. - Elle ne s’use pas jusqu’à son utilisation (lors de l’utilisation, on enlève le scotch d’obturation). |
II- Exercice 9 page 298. Utiliser la polarité d’une pile.
|
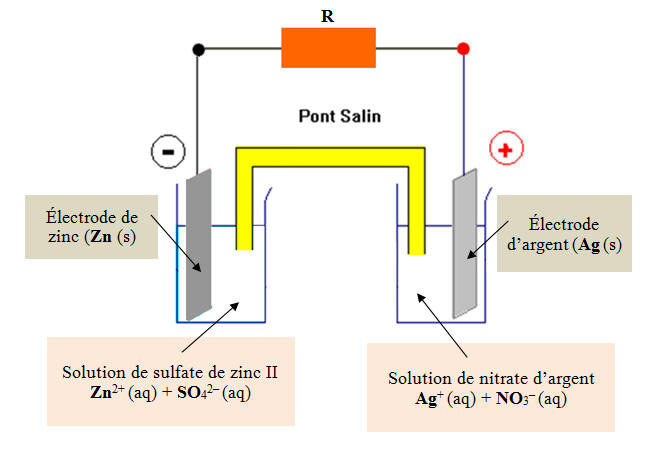
On considère la pile zinc-argent, représentée ci-dessous : 1)- À l’extérieur de la pile : a)- Quel est le sens du courant ? b)- Quels sont les porteurs de charge et dans quel sens se déplacent-ils ? 2)- À l’intérieur de la pile : a)- Quel est le sens du courant ? b)- Quels sont les porteurs de charge et dans quel sens se déplacent-ils ? 3)- Écrire l’équation de la réaction se produisant au niveau de chacune des électrodes. |
|
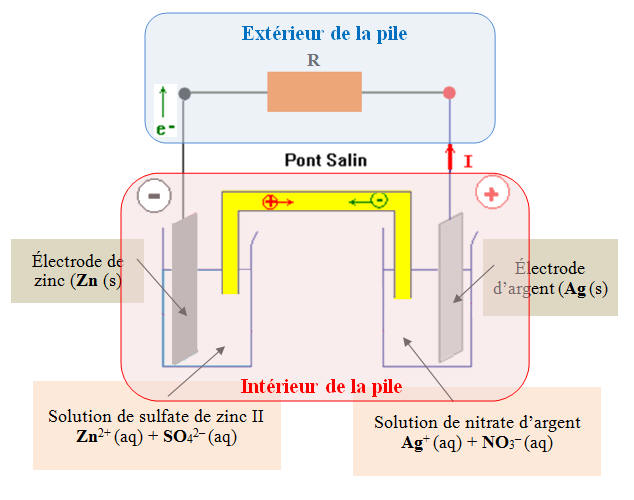
Schéma de la pile : 1)- À l’extérieur de la pile : a)- Sens du courant : - Le courant se déplace de la borne positive vers la borne négative à l’extérieur de la pile, c'est-à-dire de l’électrode d’argent vers l’électrode de zinc à l’extérieur de la pile. b)- Les porteurs de charge et sens de déplacement : - À l’extérieur de la pile, les porteurs de charge sont les électrons qui se déplacent de l’électrode de zinc vers l’électrode d’argent (circuit électrique) en sens inverse du courant électrique. 2)- À l’intérieur de la pile : a)- Sens du courant : - À l’intérieur de la pile, le courant circule de l’électrode de zinc vers l’électrode d’argent. - Le courant électrique à l’intérieur de la pile est dû à la double migration des ions positifs et négatifs, présents dans les différentes solutions, se déplaçant en sens inverses. b)- Les porteurs de charge et sens de déplacement : - À l’intérieur de la pile les porteurs de charges sont les ions. - Les cations se déplacent dans le sens du courant électrique et les anions se déplacent en sens inverse de celui du courant électrique. - Rôle du pont salin : - Le pont salin assure la jonction électrique entre les solutions contenues dans les deux béchers. Il contient une solution gélifiée d’ions (anion et cation). 3)- Équation de la réaction se produisant au niveau de chacune des électrodes : - Électrode de zinc : borne moins : c’est une réaction qui produit des électrons - C’est une oxydation (ANODE) - Zn (s) → Zn2+ (aq) + 2 e– - Électrode d’argent : borne plus : c’est une réaction qui consomme des électrons - C’est une réduction (CATHODE) - Ag+ (aq) + e– → Ag (s) |
III- Exercice 10 page 298. Déterminer la polarité d’une pile.
|
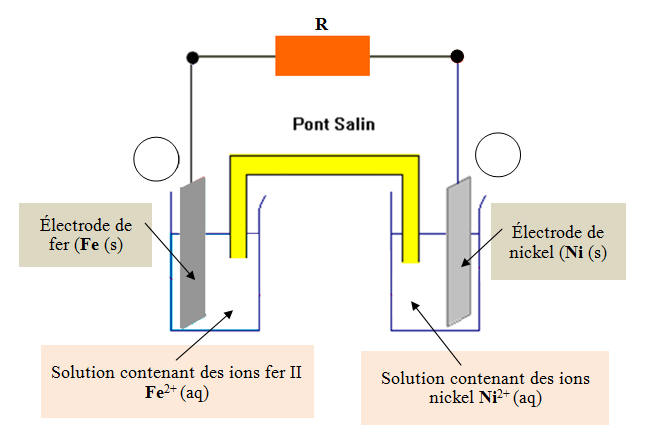
Lorsque la pile, schématisée ci-dessous, fonctionne, des réactions se produisent aux électrodes : À l’électrode de fer : Fe (s) → Fe2+ (aq) + 2 e– À l’électrode de nickel : Ni2+ (aq) + 2 e– → Ni (s) 1)- Quel est le sens de déplacement des électrons à l’extérieur de la pile ? 2)- Quel est le sens du courant à l’extérieur de cette pile ? 3)- Quelle est la borne positive de cette pile ? |
|
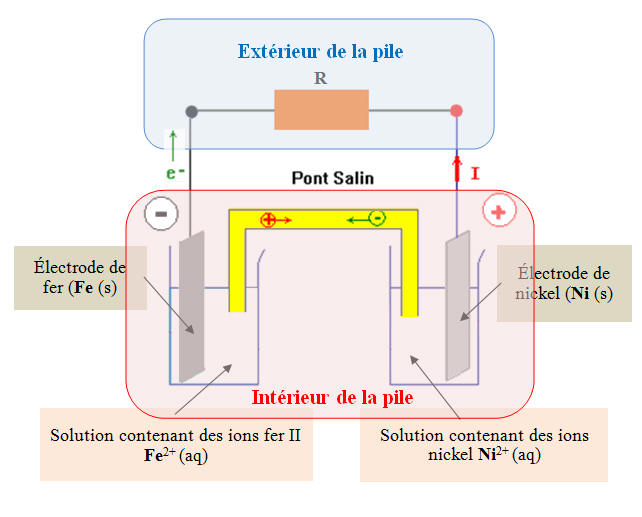
Schéma de la pile : 1)- Sens de déplacement des électrons à l’extérieur de la pile : - À l’électrode de fer se produit la réaction suivante : Fe (s) → Fe2+ (aq) + 2 e– - Cette réaction est une oxydation, elle se produit à l’anode. - Cette réaction produit des électrons. - À l’électrode de nickel se produit la réaction suivante : Ni2+ (aq) + 2 e– → Ni (s) - Cette réaction est une réduction, elle se produit à la cathode. - Cette réaction consomme des électrons. - En conséquence, à l’extérieur de la pile, les électrons se déplacent de l’électrode de fer vers l’électrode de nickel (circuit électrique). 2)- Sens du courant à l’extérieur de cette pile : - Le courant électrique, à l’extérieur de la pile se déplace en sens inverse de celui des électrons. - Le courant électrique se déplace de l’électrode de nickel vers l’électrode de zinc. 3)- Borne positive de cette pile : - Par définition, le courant sort de la borne positive d’un générateur. - Comme le courant circule de l’électrode de nickel vers l’électrode de fer à l’extérieur de la pile, l’électrode de nickel constitue la borne positive de cette pile. |
IV- Exercice 12 page 299. Reconnaître un oxydant et un réducteur.
|
Des piles au magnésium équipent certains gilets de sauvetage, mais aussi des torpilles. Le magnésium métallique Mg (s) réagit avec les ions hydrogène H+ (aq) d’une solution d’acide chlorhydrique selon la réaction d’équation :
2
H+ (aq) + Mg (s)
→ H2 (g) + Mg2+
(aq) 1)- Le magnésium est-il oxydé ou réduit ? 2)- Les ions hydrogène ont-ils été oxydés ou réduits ? 3)- Identifier l’oxydant et le réducteur qui réagissent. 4)- Quels sont les couples oxydant/réducteur mis en jeu ? |
|
Équation bilan de la réaction : 2
H+ (aq) + Mg (s)
→ H2 (g) + Mg2+
(aq) 1)- Le magnésium métallique Mg (s) : - Au cours de la réaction précédente,le magnésium métal Mg (s) subit la demi-équation électronique suivante : Mg (s) → Mg2+ (aq) + 2 e– - Cette réaction est une oxydation, elle cède des électrons. - En conséquence, le magnésium métal Mg (s) a été oxydé. 2)- Les ions hydrogène ont-ils été oxydés ou réduits ? - Au cours de la réaction précédente, les ions hydrogène H+ (aq) subissent la demi-équation électronique suivante : 2 H+ (aq) + 2 e–
→ H2 (g) - Cette réaction est une réduction, elle consomme des électrons. - En conséquence, les ions hydrogène H+ (aq) ont été réduits. 3)- Identifier l’oxydant et le réducteur qui réagissent. - Au cours d’une réaction oxydoréduction, le réducteur a été oxydé et l’oxydant a été réduit : - Le magnésium métal Mg (s) est le réducteur - L’ion hydrogène H+ (aq) est l’oxydant. 4)- Les couples oxydant/réducteur mis en jeu : -
Couple 1 : Mg2+ (aq) / Mg
(s)
-
Couple 2 : H+ (aq) / H2
(g)
|
V- Exercice 16 page 299. Établir des demi-équations redox.
|
Établir les demi-équations redox des couples suivants en présence d’ions hydrogène H+ (aq) : a)- IO3– (aq) / I2 (aq) b)- H2O2 (aq) / H2O (ℓ) c)- O2 (g) / H2O (ℓ) d)- HOCl (aq) / Cl2 (g) |
|
Les demi-équations électroniques : a)-
Couple IO3– (aq) / I2
(aq) :
b)- Couple H2O2 (aq) / H2O (ℓ) :
c)-
Couple O2 (g) / H2O
(ℓ) :
d)- Couple HOCl (aq) / Cl2 (g) :
|
VI- Exercice 23 page 301. Pile SR à l’oxyde d’argent.
|
Les piles SR 44 à oxyde d’argent alimentent les calculatrices, les montres, etc. Leur électrolyte est constitué de potasse K+ (aq) + HO– (aq). Lorsque ces piles fonctionnent, les réactions aux électrodes ont pour équation : Ag2O
(s) + H2O (ℓ) + 2
e
–
→ 2 Ag (s) + 2
HO–
(aq) Zn
(s)
+ 2 HO–
(aq) → ZnO (s) + H2O
(ℓ) + 2 e– 1)- L’électrode de zinc est-elle la borne positive de cette pile ? 2)- Quels sont les couples oxydant / réducteur mis en jeu ? 3)- Écrire l’équation de la réaction de fonctionnement de ces piles. |
|
1)- L’électrode de zinc : - À l’électrode de zinc se produit la réaction suivante : -
Zn
(s) + 2 HO–
(aq) → ZnO (s) + H2O
(ℓ) + 2 e– - Cette réaction cède des électrons, c’est une oxydation. - L’oxydation se produit à l’anode. - La borne de zinc constitue la borne négative de la pile. 2)- Les couples oxydant / réducteur mis en jeu : -
Couple 1 :
Ag2O
(s) /
Ag
(s) -
Couple 2 : ZnO
(s) / Zn
(s) - Remarque : un moyen de retrouver l’oxydant et le réducteur d’un couple Ox / Red - D’après la demi-équation électronique suivante : - Ox + n e– = Red - L’oxydant du couple se trouve avec les électrons. - Car l’oxydant est réduit et le réducteur oxydé. 3)- Équation bilan de la réaction de fonctionnement de ces piles :
|
VII- Exercice 24 page 301. Accumulateur lithium-ion.
|
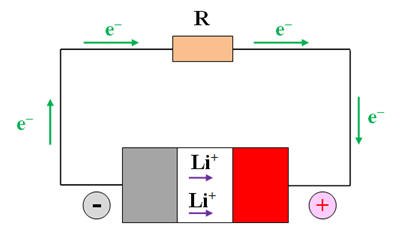
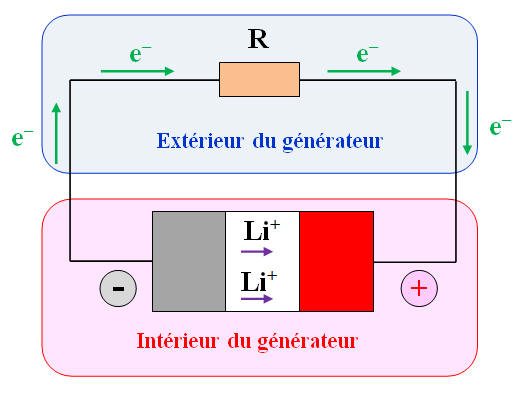
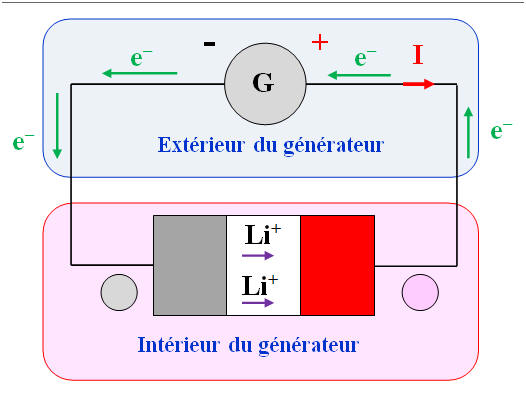
Les accumulateurs lithium-ion alimentent des téléphones et ordinateurs portables, des voitures électriques, etc., car ils ont des caractéristiques très intéressantes. Lorsqu’un accumulateur lithium-ion débite un courant, l’électrode de graphite est le lieu de la réaction d’équation : Li (graphite) → (graphite) + Li+ + e– À l’autre électrode a lieu la réaction d’équation : CoO2 + Li+ + e– → CoLiO21)- Le lithium est-il oxydé ou réduit à l’électrode de graphite ? 2)- Cette électrode constitue-t-elle le pôle positif de l’accumulateur ? Justifier la réponse. 3)- Écrire l’équation bilan de la réaction de fonctionnement en générateur de l’accumulateur. Le fonctionnement en générateur de l’accumulateur est schématisé ci-dessous :
4)- Quels sont les porteurs de charge responsables du passage du courant dans les différentes parties du circuit ? 5)- Quel est le réactif qui limite la durée de fonctionnement de l’accumulateur en générateur ? 6)- Lorsque l’accumulateur est déchargé, on le recharge en le reliant à un générateur électrique. La réaction traduisant la charge est l’inverse de celle qui se produit lors de la décharge. a)- Quel doit être alors le sens de déplacement des électrons dans le circuit extérieur à l’accumulateur ? b)- Pour cela, à quelle électrode doit-on relier la borne positive du générateur électrique ? c)- Quel est la transformation d’énergie qui a lieu dans l’accumulateur lors de la charge ? |
|
1)- Étude du lithium : - Le lithium subit la réaction suivante : Li (graphite) → (graphite) + Li+ + e– - Cette réaction cède des électrons : c’est une oxydation. - Le lithium est oxydé. 2)- L’électrode de graphite : - Cette électrode où se produit l’oxydation du lithium est la borne négative du générateur, l’anode. 3)- Équation bilan de la réaction :
4)- Réactif limitant de l’accumulateur : - Le réactif limitant est le lithium, car il est oxydé à l’électrode de graphite en Li+ qui se déplace vers l’autre électrode à l’intérieur de l’accumulateur (électrode constituée d’oxyde de cobalt CoO2) 5)- Étude du fonctionnement en générateur : - Les porteurs de charge responsables du passage du courant dans les différentes parties du circuit sont : - Les électrons à l’extérieur du générateur - Les ions lithium à l’intérieur du générateur.
6)- Charge de l’accumulateur : a)- Sens de déplacement des électrons dans ce cas :
- Les électrons doivent circuler dans le sens inverse dans ce cas, c’est-à-dire de l’électrode constituée d’oxyde de cobalt CoO2 vers l’électrode de graphite à l’extérieur de l’accumulateur. b)- Branchement du générateur qui permet la charge de l’accumulateur. - Dans ce cas, le générateur impose le sens du courant dans le circuit. - Le courant sort de la borne positive de ce générateur. - Les électrons circulent dans le sens inverse du sens du courant. - La borne négative du générateur est reliée à l’électrode de graphite de l’accumulateur. c)- Transformation d’énergie qui a lieu dans l’accumulateur leur de la charge : - Lors de la charge de l’accumulateur par le générateur, on transforme de l’énergie électrique en énergie chimique. - Il se produit les réactions inverses aux niveaux des électrodes. - On réalise une électrolyse. - Remarque : on transforme aussi de l’énergie électrique en énergie thermique. |
VIII- Exercice 26 page 302. Gravure à l’eau forte.
|
La gravure à l’eau forte est une méthode de reproduction ancienne. L’artiste dessine à l’aide d’une pointe en métal sur une plaque de cuivre recouverte de vernis. Lorsque la gravure est terminée, la plaque est plongée dans une solution d’acide nitrique, H+ (aq) + NO3– (aq), anciennement appelée eau forte : les parties de cuivre non protégées par le vernis sont attaquées par les ions nitrate NO3– (aq) et la solution utilisée devient bleue. La plaque est ensuite rincée à l’eau et le vernis restant est enlevé : la gravure est terminée. Le dessin peut être reproduit sur les feuilles de papier en remplissant d’encre les sillons creusés par l’acide. 1)- Première partie : a)- Quel est l’ion responsable du bleuissement de la solution ? b)- Le métal cuivre est-il l’oxydant ou le réducteur ? Écrire la demi-équation d’oxydoréduction du couple oxydant / réducteur mis en jeu. 2)- Deuxième partie : a)- Les ions nitrate NO3– (aq) constituent-ils l’oxydant ou le réducteur ? b)- L’espèce conjuguée de l’ion nitrate NO3– (aq) est le monoxyde d’azote NO (g). Écrire la demi-équation correspondante en présence d’ions hydrogène H+ (aq). c)- En déduire l’équation de la réaction. d)- Pourquoi doit-on utiliser une solution d’acide nitrique et non une solution de nitrate de potassium K+ (aq) + NO3– (aq) ? |
|
1)- Première partie : a)- L’ion responsable du bleuissement de la solution : - C’est l’ion cuivre II Cu2+ (aq). b)- Le cuivre métal : Cu (s). - Les ions cuivre II obtenus proviennent du cuivre métal - Il se produit la réaction suivante : - Cu (s) → Cu2+ (aq) + 2 e– - C’est une oxydation : c’est le réducteur qui est oxydé - Le cuivre métal Cu (s) est le réducteur. 2)- Deuxième partie : a)- L’ion nitrate NO3– (aq) : - Au cours d’une réaction d’oxydoréduction, le réducteur d’un couple est oxydé et l’oxydant d’un autre couple est réduit : - En conséquence, l’ion nitrate NO3– (aq) a été réduit, c’est l’oxydant de la réaction. b)-
Couple NO3– (aq) /
NO (g) :
c)- L’équation de la réaction :
d)- Choix de la solution aqueuse : - Les réactifs de la réaction précédente sont : - Les ions nitrate NO3– (aq), - Le cuivre métal Cu (s) - Et les ions hydrogène H + (aq). - Il faut utiliser la solution d’acide nitrique, H+ (aq) + NO3– (aq), car elle apporte, les ions nitrate NO3– (aq) mais aussi les ions hydrogène
H
+
(aq) qui sont indispensables à la réaction précédente. - La solution de nitrate de potassium, K+ (aq) + NO3– (aq), n’apporte que les ions nitrate NO3– (aq). - Les ions potassium, K+ (aq) ne participent pas à la réaction. - Gravure à l’eau forte : - L’eau forte était le nom donné à l’acide nitrique (aqua-fortis). - Aujourd’hui, l’acide nitrique a
été remplacé par le perchlorure de fer (FeCℓ3)
moins toxique.
|
|
|