|
Chim. N° 08 |
Les Piles. Cours. |
|
|
|
|
Programme 2012 : Physique et Chimie Programme 2020 : Physique et Chimie |
|
QCM N° 17 |
Pour aller plus loin :
|
Mots clés : la pile ; pile alcaline ; pile saline ; le générateur électrochimique ; quantité d'électricité : capacité d'une batterie ; la batterie au plomb ; réactions aux électrodes ; Volta ; les courants galvaniques ; ... |
1)- Transferts spontanés directs.
a)- Expérience 1 :
|
Solution A : |
Solution B : |
||
|
Solution de sulfate de cuivre II C = 1,00 × 10 – 1 mol / L |
Solution de sulfate de zinc II C = 1,00 × 10 – 1 mol / L |
||
|
Couple 1 Cu2+/ Cu |
Couple 2 Zn2+ / Zn |
||
|
Volume de la solution A |
VA = 50,0 mL |
Volume de la solution B |
VB = 50,0 mL |
On verse les solutions dans un bécher et on plonge une lame de cuivre et une lame de zinc dans la solution obtenue.
b)- Observations.
- Le zinc se recouvre d’un dépôt rouge de cuivre métallique et la solution se décolore lentement au cours du temps.
-La réaction a lieu à l’interface entre la solution contenant les ions cuivre II et le zinc métal.
c)- Interprétation.
- L’équation de la réaction :
Cu2+
(aq) + Zn (s) = Cu (s) + Zn2+(aq)K = 1,9 × 10 37
- Valeur du quotient de réaction du système à l’état initial :
|
[Zn2+]i |
||||
|
Q r.i = |
|
= |
1,0 |
|
|
[Cu2+]i |
- Les ions cuivre II et les ions zinc II ont la même concentration.
- Qr,i < K
- Le système évolue dans le sens direct de l’équation de cette réaction d’oxydoréduction.
|
Cette réaction met en jeu un transfert d’électrons du zinc métallique, réducteur du couple Zn2+ / Zn, vers les ions cuivre II, oxydant du couple Cu2+ / Cu. |
|
Zn = Zn2+ + 2 e – Oxydation. Cu2+ + 2 e – = Cu Réduction. |
- Les électrons n’existent pas en solution aqueuse.
- Le transfert se fait par contact entre le zinc métal et les ions cuivre II.
d)- Conclusion.
|
Lorsque les espèces chimiques participant à une réaction d’oxydoréduction en solution aqueuse sont mélangées, il se produit un transfert spontané et direct d’électrons du réducteur vers l’oxydant. |
2)- Transfert spontané indirect.
a)- Expérience 2.
|
Solution A : |
Solution B : |
||
|
Solution de sulfate de cuivre II C = 1,00 × 10 – 1 mol / L |
Solution de sulfate de zinc II C = 1,00 × 10 – 1 mol / L |
||
|
Couple 1 Cu2+/ Cu |
Couple 2 Zn2+ / Zn |
||
|
Volume de la solution A |
VA = 50,0 mL |
Volume de la solution B |
VB = 50,0 mL |
- Dans un bécher A, on verse la solution A et on dispose une plaque de cuivre.
- Dans un bécher B, on verse la solution B et on dispose une plaque de zinc.
- On relie les deux béchers par un pont salin.
- On relie les deux plaques par un conducteur ohmique de résistance R, branchée en série avec un ampèremètre.
b)- Observations.
- On observe le passage d’un courant électrique allant de la plaque de cuivre vers la plaque de zinc.
- Schéma :
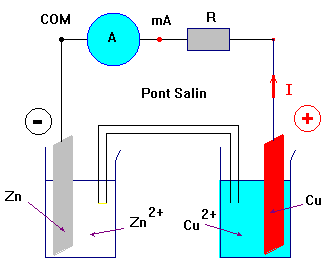
c)- Interprétation.
- Les porteurs de charge dans les métaux et le graphite sont les électrons.
- Les porteurs de charge dans les électrolytes sont les ions.
- Le sens conventionnel du courant est lié en sens de déplacement des porteurs de charge positifs.
- Le courant traverse le conducteur ohmique et l’ampèremètre en se déplaçant de la plaque de cuivre vers la plaque de zinc.
- Les plaques métalliques, les fils de connexion, le conducteur ohmique et l’ampèremètre sont parcourus par des électrons qui se déplacent en sens inverse du sens du courant.
- Les solutions aqueuses ioniques sont le siège de déplacement d’ions.
- Les ions positifs ou cations ( Zn2+, Cu2+, …) se déplacent dans le sens du courant.
- Les ion négatifs ou anions ( SO42 – , NO3–,…) se déplacent dans le sens inverse du courant.
- D’où proviennent les électrons ?
- La réaction qui libère des électrons est l’oxydation du zinc métallique en ions zinc II, selon l’équation :
-
Oxydation :
Zn
(s)
=
Zn2+(aq)
+
2 e
–
- Les électrons n’existent pas en solution aqueuse et ils ne peuvent pas s’accumuler sur la plaque.
- Ils se déplacent vers l’électrode de cuivre grâce au circuit électrique.
- Ils sont consommés à l’interface cuivre métal – solution de sulfate de cuivre II par la réaction suivante :
- Réduction : Cu2+(aq) + 2 e – = Cu (s)
- Il s’est produit un échange d’électrons de façon indirecte par l’intermédiaire du circuit électrique.
- Le bilan de cet échange peut se traduire par l’équation de la réaction suivante :
Cu2+(aq) + Zn (s) = Cu (s) + Zn2+(aq)
- L’évolution spontanée de ce système a lieu dans le sens direct de cette l’équation.
d)- Conclusion.
|
Lorsque les espèces chimiques participant à la réaction d’oxydoréduction sont séparées, on peut réaliser un transfert spontané et indirect du réducteur vers l’oxydant, par l’intermédiaire d’un conducteur métallique. Les piles fonctionnent sur ce principe. |
II- Constitution d’une pile et fonctionnement d’une
pile.![]()
|
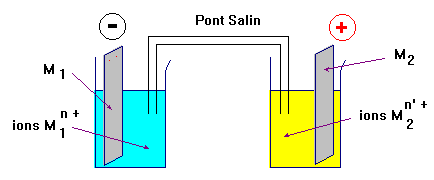
- Deux compartiments distincts contenant chacun un couple Ox / Red du type Mn+ (aq) / M (s) et reliés par un pont électrochimique (ou pont salin) constituent un générateur électrochimique appelé pile. - L’ensemble constitué par une plaque de métal M plongeant dans une solution contenant des cations Mn+ constitue une demi-pile. - La plaque de métal M est appelée aussi électrode. - Les transferts d’électrons se produisent à la surface de l’électrode. - Écriture conventionnelle :
|
2)- Force électrochimique d’une pile.
- Pour mesurer la f.é.m. d’une pile ou d’un générateur, on utilise un voltmètre électronique.
- Un voltmètre électronique possède une grande résistance interne.
- En conséquence, lors de la mesure, la pile débite un courant d’intensité très faible.
- La tension mesurée est sensiblement égale à la force électromotrice de la pile.
- On peut écrire U = ( VCu – VZn) ≈ E Cu – Zn ≈ 1,1 V

3)- Fonctionnement d’une pile.
- Le fonctionnement de la pile se déduit de la mesure de la f.é.m. ou du sens de déplacement du courant.
- Exemple : Lorsque l’on mesure la f.é.m. de la pile zinc – cuivre, on trouve :
- U = ( VCu – VZn) ≈ E Cu - Zn ≈ 1,1 V
- Cette f.é.m. est positive.
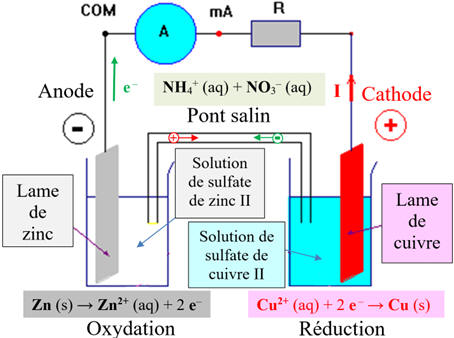
- Lors du fonctionnement de la pile Zinc – cuivre, le courant circule, à l’extérieur de la pile du pôle positif (électrode de cuivre)vers le pôle négatif (électrode de zinc).
- En conséquence, les électrons, responsables du passage du courant dans le circuit extérieur (circuit électrique), se déplacent de l’électrode de zinc vers l’électrode de cuivre.
- À l’électrode de zinc se produit une réaction qui cède des électrons, c’est une oxydation :
- Zn (s) = Zn2+(aq) + 2 e –
- à l’électrode de cuivre se produit une réaction qui consomme des électrons, c’est une réduction :
- Cu2+(aq) + 2 e – = Cu (s)
- à l’intérieur de la pile, le courant électrique est dû à une double migration des ions positifs et négatifs se déplaçant en sens inverse.
- Les cations se déplacent dans le sens du courant et les anions dans le sens inverse.
- Lorsque la pile fonctionne :
- La demi-pile Cu2+ / Cu consomme des ions cuivre II : leur concentration diminue.
- La demi-pile Zn2+ / Zn forme des ions zinc II : leur concentration augmente.
- L’électroneutralité de chaque solution est maintenue grâce à la circulation des ions dans le pont salin.
Généralisation

4)- Évolution spontanée d’une pile.
- Le critère d’évolution permet de prévoir le sens d’évolution spontanée d’une pile.
- En fonctionnement, une pile est un système hors d’équilibre.
- Le critère d’évolution spontanée permet de déterminer le sens de déplacement des porteurs de charge dans une pile.
- La connaissance du quotient de réaction dans l’état initial et de la constante d’équilibre de la réaction associée permet de connaître l’évolution spontanée du système chimique.
- Remarque : une pile usée est une pile qui a atteint son état d’équilibre, elle ne peut plus débiter du courant.
- Si Qr = K => Ieq = O.
III-
Quantité d’électricité fournie.![]()
|
On écrit : Q = n (e –) . F |
La quantité d’électricité mise en jeu au cours du fonctionnement d’une pile est égale à la valeur absolue de la charge totale des électrons échangés. |
- Q quantité d’électricité : grandeur positive : coulomb C
- n (e –) quantité de matière d’électrons échangés : mol.
- La valeur absolue de la charge d’une mole d’électrons définit le faraday de symbole F .
|
1 F = | NA . (– e) | ≈ 96500 C / mol |
2)- Quantité d’électricité débitée par une pile.
- Une pile débitant un courant d’intensité constante I, pendant la durée Δt, fait circuler une quantité d’électricité Q telle que :
|
Q = I . Δt |
Q quantité délectricité en coulomb (C) |
|
I intensité du courant continu en ampère (A) |
|
|
Δt durée en seconde (s) |
3)- Quantité de matière mise en jeu.
|
Application : Exercice 19 page 208. On considère la pile formée en associant les deux demi-piles mettant en jeu les couples Fe2+ / Fe et Cu2+ / Cu. Chaque demi-pile contient V = 100 mL de concentration Ci = 0,100 mol / L. à l’extérieur du circuit, les électrons circulent de l’électrode de fer vers l’électrode de cuivre. a)- Donner la représentation conventionnelle de la pile. b)- Quelles sont les réactions qui se produisent aux électrodes quand la pile débite ? Justifier. c)- Écrire l’équation de la réaction qui se produit dans la pile lorsqu’elle débite. Cette pile débite un courant d’intensité constante I = 20,0 mA pendant une durée Δt = 2,00 h. d)- Quelle quantité d’électricité la pile a-t-elle débitée ? e)- En déduire la quantité de matière d’électrons qui a transporté cette quantité d’électricité. f)- Calculer alors la variation de masse des électrodes. g)- Déterminer les concentrations finales en ions fer II et en ions cuivre II. |
- La capacité C d’une pile est la quantité d’électricité maximale qu’elle peut fournir avant d’être usée.
- De façon générale, une pile est usée lorsque le réactif limitant a été complètement consommé.
- C = Qmax = I . Δt
- Pour les piles ou les batteries du commerce, on exprime la capacité en ampère.heure : A.h
- Remarque 1 A.h = 3600 C.
- Exemple : une batterie de capacité 40 A.h peut débiter un courant de 40 A pendant une heure ou 120 A pendant 20 min.
|
QCM N° 17 |