|
QCM N° 11 |
Les alcanes et les alcools |
|
|
|
|
QCM N° 11
De la structure aux propriétés, cas des
Alcanes et des Alcools. Pour chaque question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
Un hydrocarbure de formule brute C10H22 |
Est un alcane |
Ne peut pas présenter de ramifications |
N’a que des atomes de carbone tétragonaux |
AC |
|
2 |
|
Est le méthylpropane |
Est un isomère du propane |
Est linéaire |
A |
|
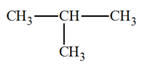
3 |
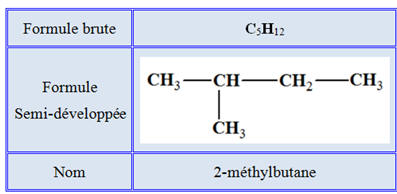
Le 2-méthylbutane a pour
formule : |
C5H10 |
BC |
||
|
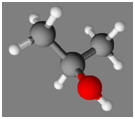
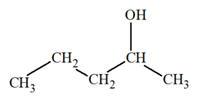
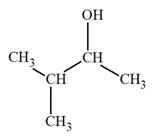
4 |
Le modèle moléculaire suivant
est :
|
Celui d’un
alcool |
Celui du propan-1-ol |
Celui du propan-2-ol |
AC |
|
5 |
Le 2-méthylpropan-1-ol a pour
formule : |
C |
|||
|
6 |
Deux molécules d’alcanes sont
d’autant plus liées : |
Que leur chaîne carbonée est ramifiée |
Que leur chaîne carbonée est longue |
Que la distance séparant leurs chaînes est grande |
B |
|
7 |
La température d’ébullition d’un alcane linéaire CnH2n
+2 : |
Augmente avec n |
Diminue avec la taille de la molécule |
Est inférieure à celle d’un isomère ramifié |
A |
|
8 |
L’alcane de formule :
|
Est le butane |
Bout à une température inférieure à celle du butane |
Bout à une température supérieure à celle du butane |
B |
|
9 |
L’éthanol C2H5–OH obtenu par fermentation du moût de raisin : |
Bout à une température supérieure à celle du méthanol |
Bout à une température inférieure à celle de l’éthane |
Bout à une température inférieure à celle du propan-1-ol |
AC |
|
10 |
Une distillation fractionnée permet de séparer deux liquides |
Miscibles |
Non miscibles |
Dont les températures d’ébullition sont différentes |
AC |
|
11 |
Lors de la distillation d’un mélange méthanol CH3OH et propan-1-ol
C3H7 OH :
|
Le méthanol est l’espèce la plus volatile |
Le méthanol constitue le distillat |
Le méthanol constitue le résidu |
AB |
|
12 |
Un alcool est miscible avec
l’eau : |
Si sa chaîne carbonée est courte |
Si sa chaîne carbonée est longue |
Grâce à l’existence de liaisons hydrogène |
AC |
|
13 |
Dans l’eau, le butan-1-ol est : |
moins soluble que l’hexan-1-ol |
plus soluble que l’hexan-1-ol |
moins soluble que le propan-1-ol |
BC |
|
14 |
On considère la molécule de formule semi-développée :
La chaîne
carbonée est : |
Linéaire |
Ramifiée |
Cyclique |
B |
|
15 |
On considère la molécule suivante :
Cette molécule s’appelle le : |
Méthylhexane |
4-méthylpentane |
2-méthylpentane |
C |
|
16 |
On considère la molécule de formule semi-développée :
Il s’agit d’un alcool : |
Primaire |
Secondaire |
Tertiaire |
B |
|
17 |
On considère la molécule suivante :
Cette molécule s’appelle le : |
3-méthyl-2-olbutane |
3-méthylbutan-2-ol |
1,2-diméthylpropan-1-ol |
B |


►
Les hydrocarbures :
-
Les hydrocarbures sont des composés organiques dont la
molécule ne contient que des atomes de carbone C et
d’hydrogène H.
►
Les Alcanes :
-
Les alcanes sont des hydrocarbures saturés. Leurs atomes
de carbones sont tétragonaux.
-
La formule générale d’un alcane non cyclique est : CnH2n+2.
-
Les cycloalcanes sont des alcanes à chaîne cyclique.
-
La formule générale d’un alcane cyclique est : CnH2n.
-
Un hydrocarbure, non cyclique, de formule brute C10H22
est un alcane.
-
Il peut être linéaire ou ramifié.
-
Exemples :
►
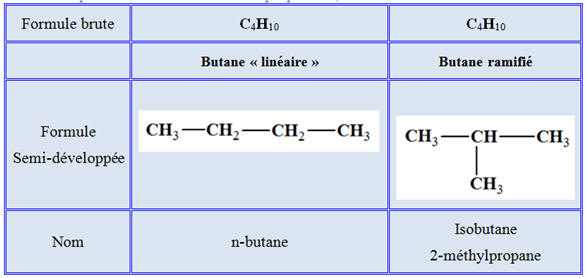
Le butane : formule brute : C4H10
-
On peut donner différentes représentation de cette
molécule :
-
Le 2-méthylpropane est un isomère du butane (il a la même
formule brute que le butane).
►
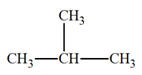
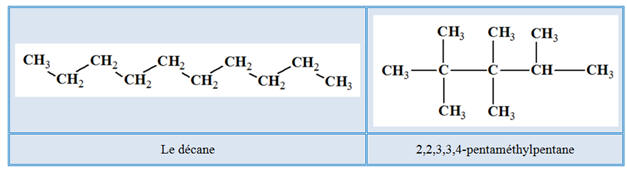
Le 2-méthylbutane :
►
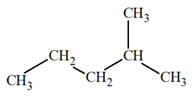
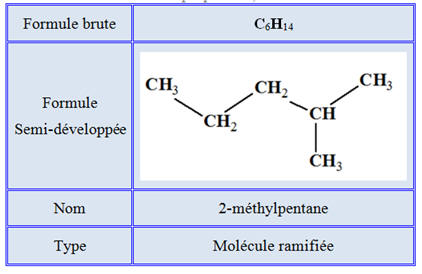
Molécule de 2-méthylpentane :
-
Cette molécule est un isomère de l’hexane.
►
Les alcènes.
-
Les alcènes sont des
hydrocarbures insaturés, non cycliques, qui possèdent une double
liaison carbone ‑ carbone C=C.
-
Leur formule brute
générale : C nH 2n.
-
Remarque : les atomes de
carbone de la double liaison sont trigonaux.
►
Nomenclature des alcanes.
►
Les Alcanes à chaîne linéaire.
-
Les quatre premiers
alcanes ont un nom consacré par l'usage : méthane (C H4),
éthane (C2H6), propane
(C3H8), butane (C4H10).
-
Pour les autres
alcanes à chaîne linéaire, on utilise un préfixe grec indiquant
le nombre d'atomes de carbone que l'on fait suivre du suffixe
-ane.
►
Les Alcanes à chaîne carbonée ramifiée.
-
On obtient le nom de
l'alcane de la manière suivante :
-
On cherche la chaîne
carbonée la plus longue et le nom de l'alcane à chaîne linéaire
comportant le même nombre d'atomes de carbone.
-
L'alcane considéré
est nommé comme un dérivé de cet alcane linéaire.
-
La chaîne la plus
longue s'appelle la chaîne principale.
-
On identifie les groupes
substituants sur cette chaîne et leur place par un indice de
position.
-
Cet indice s'obtient
grâce à la numérotation des atomes de carbone de la chaîne
principale.
-
Deux sens de
numérotation existent, pour trouver le bon sens de numérotation
:
-
On écrit tous les
indices obtenus par ordre croissant. Le sens à retenir est celui
pour lequel le premier chiffre différent est le plus petit.
-
Ou bien
on choisit celui pour lequel la somme des indices est la plus
petite.
-
Dans l'écriture du
nom de l'alcane, on doit respecter deux règles :
-
Les indices de
position des groupes alkyles se placent devant le nom du groupe.
-
Les groupes alkyles
s'écrivent avant le nom de l'alcane. (Deux chiffres sont séparés
par une virgule et entre un chiffre et une lettre, on place un
tiret).
-
On fait élision du "e" du
nom de l'alkyle.
-
Les groupements alkyles sont
placés par ordre alphabétique.
-
S'il existe plusieurs
groupes identiques, en utilise les préfixes : di, tri, tétra…
-
Les substituants halogènes
se traitent comme les groupes alkyles.
►
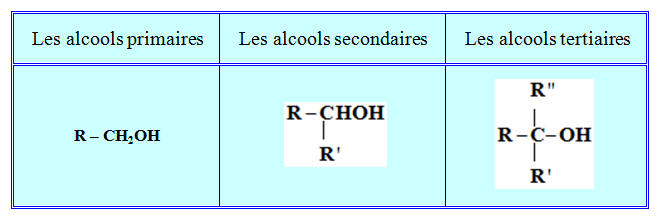
Les Alcools :
-
On appelle alcool tout composé organique possédant un
groupe hydroxyle – OH lié à un atome de carbone
tétragonal.
-
Formule générale d’un alcool : R – OH.
-
On distingue :
-
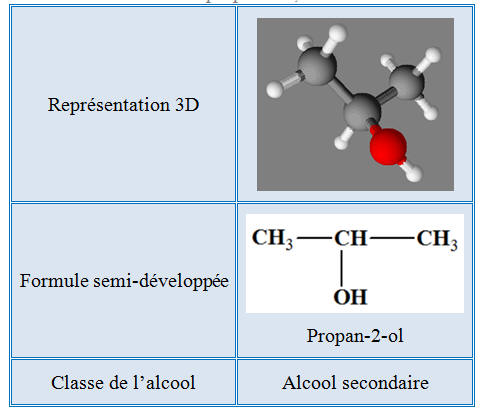
Le propan-2-ol :
►
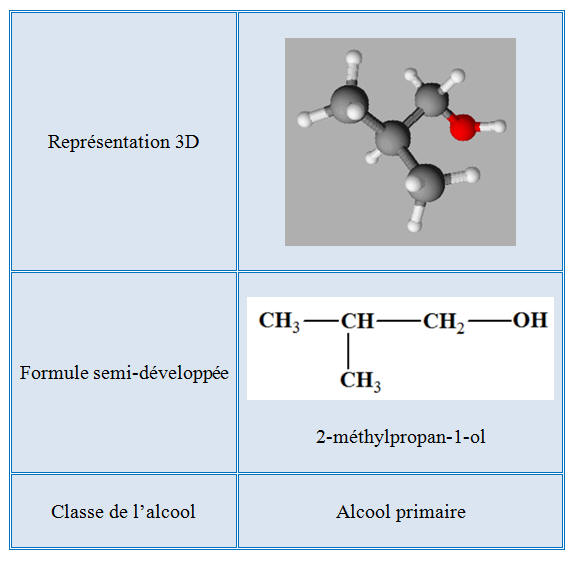
2-méthylpropan-1-ol :
►
Molécule de pentan-2-ol :
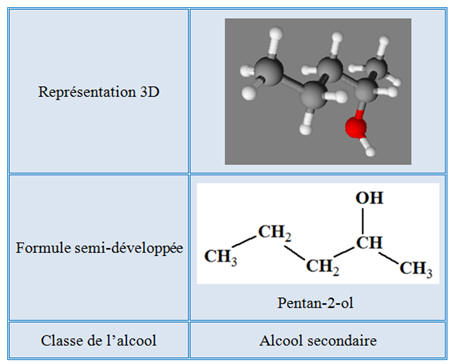
►
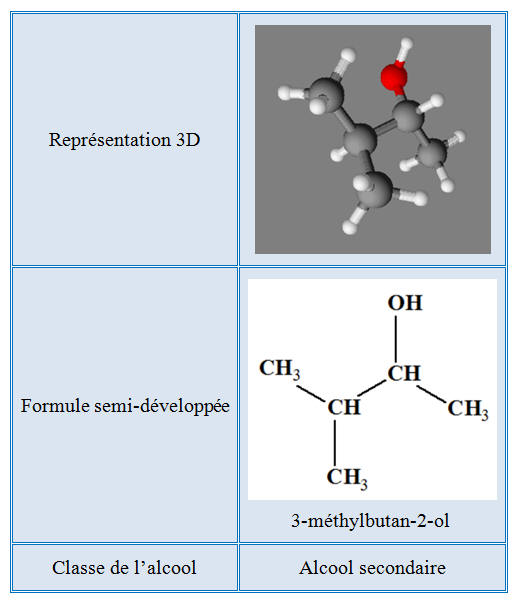
Molécule de 3-méthylbutan-2-ol :
►
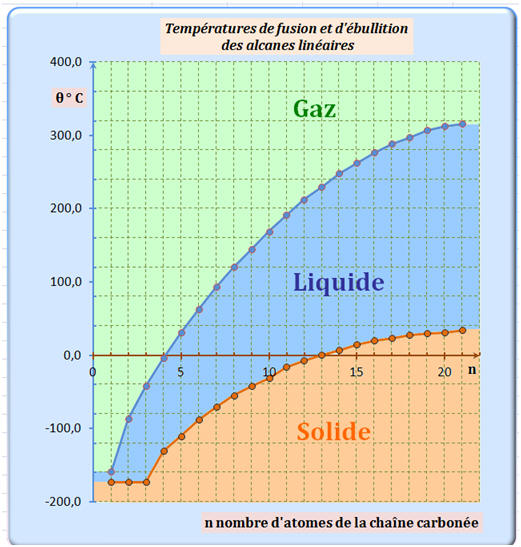
Propriétés des alcanes :
-
Alcanes linéaires :
-
Les températures de fusion et d’ébullition des alcanes
linéaires augmentent avec le nombre n d’atomes de carbone
de la chaîne carbonée.
-
L’intensité des interactions de Van Der Waals et de ce
fait les températures de fusion et d’ébullition des alcanes
linéaires augment avec la longueur de la chaîne carbonée des
molécules.
-
Alcanes ramifiés :
-
Pour des alcanes isomères, la température d’ébullition θéb
est d’autant plus basse que l’isomère est ramifié.
-
Les interactions de Van Der Waals sont moins importantes
pour les molécules ramifiées que pour les isomères linéaires.
-
Les alcanes isomères sont d’autant plus volatils qu’ils
sont ramifiés.
►
Conséquence :
-
L’isobutane (2-méthylpropane, butane ramifié) bout à une
température inférieure à celle du butane.
►
Interactions entre les molécules d’alcanes :
-
Deux molécules d’alcanes sont d’autant plus liées que
leur chaîne carbonée est longue.
-
Au plus la molécule est ramifié, au moins elle est longue
et au plus elle est compacte.
-
La distance qui sépare deux molécules est plus grande et
de plus les moments dipolaires instantanés sont plus faibles (le
moment dipolaire instantané augmente avec la longueur de la
chaîne).
►
Propriétés des alcools :
-
La température d’ébullition d’un alcool croît avec le
nombre n d’atomes de carbone de la chaîne carbonée.
-
La température d’ébullition d’un alcool est supérieure à
celle de l’alcane correspondant.
-
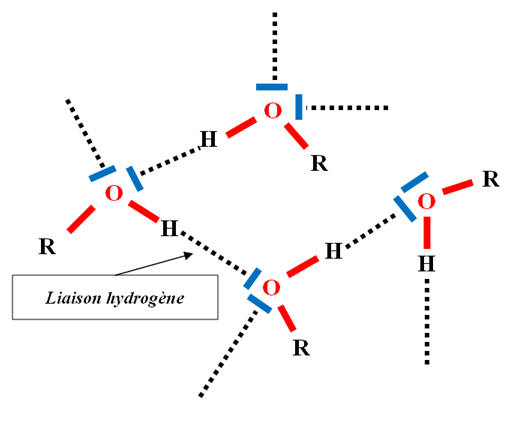
Les alcools possède le groupe hydroxyle – OH.
-
La liaison O – H est une liaison polarisée.
-
La présence de cette liaison entraine l’existence de
liaison hydrogène entre les molécules d’alcool, liaison
hydrogène qui n’existe pas entre les molécules d’alcanes.
►
Propriétés des alcools :
-
Les alcools dont la chaîne carbonée comporte moins de 10
atomes de carbone sont des liquides incolores à la température
ordinaire.
-
La température d'ébullition des alcools est nettement
plus importante que celle des alcanes correspondants.
-
Cette particularité est liée à la présence du groupe
hydroxyle.
-
La plupart des alcools sont miscibles à l'eau en toutes
proportions.
-
Toutefois cette miscibilité décroît avec la longueur de
la chaîne carbonée.
-
La molécule d'un alcool possède deux parties :
-
Un groupe hydroxyle – OH, on parle de
groupe hydrophile (il peut
s’entourer de molécules d’eau et former des liaisons hydrogène)
-
Un groupe alkyle R –, chaîne carbonée, qui est le
groupe hydrophobe.
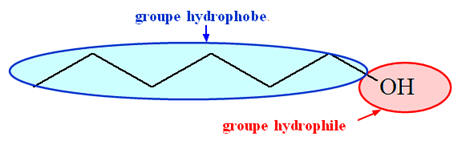
-
La miscibilité est liée à l'importance relative de ces
deux parties.
-
Les deux alcools les plus importants sont :
-
L'éthanol
(alcool éthylique) que l'on retrouve dans les boissons
alcoolisées.
-
Des petites quantités d'éthanol provoquent un état
euphorique.
-
Des doses plus importantes dépriment gravement le système
nerveux : à
consommer avec modération !
-
Le méthanol ou
alcool de bois que l'on peut retrouver dans les alcools
frelatés.
-
Il provoque la cécité et la mort.
-
On utilise les alcools comme solvant en pharmacie, en
cosmétologie…
►
Conséquence :
-
Un alcool est miscible avec l’eau si sa chaîne carbonée
est courte, ceci grâce à l’existence de liaisons hydrogène.
-
Dans l’eau, le butan-1-ol est plus soluble que
l’hexan-1-ol, mais moins soluble que le propan-1-ol.
-
Les alcools ont donc des températures d’ébullition
supérieures à celle des alcanes de même chaîne carbonée.
►
Conséquences :
-
Ainsi, l’éthanol bout à une température supérieure à
celle du méthanol, mais bout à une température inférieure à
celle du propan-1-ol.
-
L’éthanol bout à une température supérieure à celle de
l’éthane.
|
|