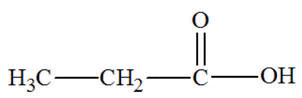La chimie organique, cours, première S,
|
Chim. N°
07
|
La
Chimie
Organique.
Cours.
Exercices |
|
|
Exercices
énoncé avec correction
|
|
1)-
Exercice 2 page 192.
|
|
2)-
Exercice 3 page 192.
|
|
3)-
Exercice 7 page 192.
|
|
4)-
Exercice 9 page 193.
|
|
5)-
Exercice 10 page 193.
|
|
6)-
Exercice 13 page 193.
|
|
7)-
Exercice 20 page 195.
|
Pour aller
plus loin :
|
Logiciel pour la
construction
de molécule
|
Chemsketch |
Gratuit |
|
Mots clés :
groupes fonctionnels ; alcanes ; alcènes ;
chaîne carbonée
; isomères ; chimie organique ;
molécule organique ; formule
topologique ; ...
|
I-
Introduction.
1)-
Définition.
| La chimie organique est la chimie des composés du carbone
d'origine naturelle ou produits par synthèse |
|
- Remarque :
Le carbone
C,
le dioxyde de carbone
CO2,
l’ion
carbonate
CO32–
et l’ion hydrogénocarbonate
HCO3–
sont des composés inorganiques.
Jusqu’au début du 19ième siècle, la chimie
organique étudie les substances issues des êtres vivants.
Au 18ième siècle, le chimiste français Lavoisier
montre que les molécules organiques sont formées
à partir d’un nombre
restreint d’éléments chimiques :
le carbone
C,
l’hydrogène
H,
parfois l’oxygène
O,
l’azote
N,
et aussi le soufre
S,
le chlore
Cl…
|
|
Au milieu du 19ième siècle, les chimistes (Wöhler
et Berthelot)
parviennent à synthétiser des substances organiques
naturelles,
puis à créer de nouvelles molécules organiques n’existant pas
dans la nature.
Wöhler arrive
à synthétiser l’urée et Berthelot synthétise l’acétylène.
Friedrich Wöhler
(Eschersheim, près de Frankfort, né le 31 juillet, 1800
- Göttingen, mort
le 23 septembre, 1882) était un chimiste allemand.
Pierre Eugène Marcellin
Berthelot, habituellement désigné sous
le nom de
Marcellin
Berthelot,
né le 25 octobre 1827 à Paris,
mort le 18 mars 1907, était un chimiste,
essayiste, historien des
sciences, homme politique et académicien français.
|
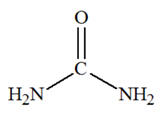
- Additif :
|
L'urée naturelle, découverte
en 1773 par Hilaire Rouelle, est formée dans le foie lors du cycle de
l'urée à partir
de l'ammoniac provenant de la dégradation des
acides aminés.
Il est éliminé par l'urine.
Sa synthèse en 1828 par
Friedrich Wöhler a
provoqué une révolution en démontrant
qu'il est possible de synthétiser un composé organique, en dehors d'un organisme vivant.
Cette expérience
marque le début de la chimie organique et la fin de la théorie de la
force vitale.
Formule de l’urée :
|
|
L´acétylène
(appelé éthyne par la nomenclature IUPAC)
est un composé chimique
de formule C2H2,
découvert par Edmund Davy en Angleterre en 1836.
Sa structure est :

Berthelot, en 1862, fut le premier à le
synthétiser par
un arc voltaïque produit entre une électrode de
graphite
baignant dans une atmosphère de dihydrogène :
|
|
Avant 1828, la
force
vitale est une cause mystérieuse et unique
censée être capable
d'édifier in vivo des composés
comme
l'acide acétique ou l'éthanol.
En 1828, cette théorie est battue en brèche par
Friedrich Wöhler,
qui parvient à synthétiser l'urée,
à partir d'une solution de
cyanate d'ammonium qui est un réactif minéral.
Mais la théorie subsiste
jusqu'à la fin du siècle sous une forme plus faible :
même si
la chimie ordinaire explique la formation des molécules organiques,
c'est la force vitale qui expliquerait leur agencement complexe caractéristique
des êtres vivants.
Une telle théorie implique la possibilité d'une
véritable génération spontanée, par application de la « force
vitale » à un milieu propice.
Les expériences de
Pasteur, permettant de relier tous les phénomènes mystérieux à
l'existence de microbes,
et l'impossibilité de mettre en évidence une
génération spontanée une fois prise toutes les précautions utiles
(élimination des « germes ») font définitivement abandonner cette
théorie par la science.
|
- La chimie organique regroupe l’ensemble des techniques utilisées
en chimie :
- Extraction, analyse, synthèse…

2)-
Les ressources des matières organiques.
a)- Origine du carbone.
- La totalité du carbone
C
constituant les molécules organiques naturelles provient du dioxyde de
carbone
CO2
atmosphérique.
-
Les végétaux, grâce à leur chlorophylle et grâce à l’énergie
solaire transforment le dioxyde de carbone
CO2
atmosphérique en molécules organiques, le glucose :
|
|
|
Lux
|
|
|
|
6
CO2 (g)
|
+ 6
H2O
(ℓ)
|
→
|
C6H12CO6
(aq)
|
+ 2
O2 (g)
|
|
|
|
|
Glucose
|
|
- C’est la synthèse chlorophyllienne.
-
Remarque :
-
Le glucose participe à la formation d’autres
glucides simples comme le saccharose, puis à des glucides complexes comme
l’amidon.
- Les cellules des êtres vivants fabriquent leurs propres
substances organiques à partir des aliments : c’est la synthèse
biochimique.
b)- Ressources organiques naturelles.
- Ce sont principalement les combustibles fossiles : les
charbons, les pétroles et les gaz naturels.
- Ils constituent les matières premières de la chimie
organiques.
II-
L’atome de carbone et ses voisins.
1)-
Stéréochimie de l’atome de carbone.
- La chimie du carbone doit son importance à la propriété
particulière qu’a le carbone de former des chaines carbonées.
- L’élément carbone
Z
= 6, sa structure électronique est
K (2)
L (4).
- L’atome de carbone possède quatre électrons sur sa couche électronique
externe.
-
Il est de ce fait tétravalent.
-
Mais suivant le nombre de voisins qu’il possède, sa géométrie
change.
- On rencontre :
|
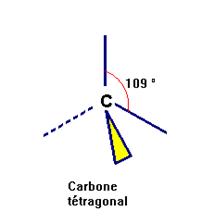
Le
carbone tétragonal :
=> Carbone qui échange quatre liaisons simples
avec quatre
atomes distincts voisins.
=>
On parle aussi de carbone tétraédrique.
=> L’atome de carbone se trouve au
centre d’un tétraèdre
dont les autres atomes occupent les sommets.
|
|
|
On
peut utiliser la représentation de CRAM :
Convention :
►
Un trait plein représente une liaison entre
deux atomes
situés dans le plan de la figure
►
Un triangle allongé plein représente une liaison
entre
un atome situé dans le plan de la figure
et un atome situé en avant
de ce plan.
►
Un trait en pointillé représente une
liaison
entre un atome situé dans le plan de la figure
et un atome
situé en arrière de ce plan
|
|
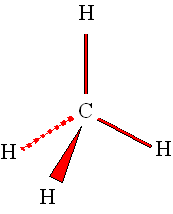
|
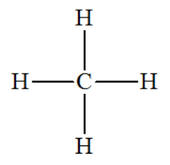
►
Exemple : cas du carbone dans la molécule de méthane.
CH4
|
 (exercice)
(exercice)

|
Le
carbone trigonal :
=> Carbone qui échange deux liaisons simples et une double
liaison.
=> Il possède 3 atomes distincts voisins.
=> L’atome
de carbone se trouve au centre d’un triangle.
|
|

|
►
Exemple de molécule : la propanone ou acétone

|
 (exercice)
(exercice)

|
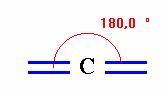
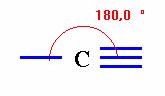
Le
carbone digonal :
=>
Il peut échanger soit une simple liaison
et une triple
liaison soit deux doubles liaisons,
=> Il possède deux atomes voisins distincts.
|
|
Ou
|
►
Exemple de molécule :
Dioxyde
de carbone
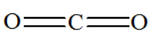
Acétylène
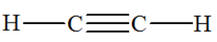
|
 (exercice)
(exercice)

2)-
Les autres atomes.
- Dans les molécules organiques, l’atome de carbone
C se lie avec l’atome d’hydrogène
H,
l’atome d’oxygène
O et l’atome d’azote
N.
a)- L’atome d’hydrogène
- Z =
1 , structure électronique :
K (1)
-
Il possède 1 électron sur sa couche électronique externe.
-
Il
respecte la règle du
DUET.
- Il forme une
liaison covalente.
-
L’atome d’hydrogène est monovalent.
b)- L’atome d’oxygène.
- Z = 8, structure électronique :
K (2)
L (6).
- Il possède 6 électrons sur sa couche électronique externe.
-
Il
respecte la règle de l’OCTET.
- Il forme deux liaisons covalentes.
-
L’atome d’oxygène est divalent.
-
Il peut former, deux simples liaisons comme dans la molécule
d’eau, ou une double liaison comme dans la molécule de dioxygène.
-
Exemples :
|
Molécule
d’eau
|
Molécule de
dioxygène
|
|
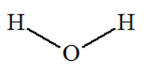
|

|
- Z = 7, structure électronique :
K (2)
L (5).
- Il possède 5 électrons sur sa couche électronique externe.
-
Il
respecte la règle de l’OCTET.
-
Il forme trois liaisons covalentes.
- L’atome d’azote est trivalent.
- Il peut former, trois simples liaisons comme dans la molécule
d’ammoniac,
ou une double liaison et une simple liaison comme dans la molécule
de dioxygène.
- Exemples :
|
Molécule
d’ammoniac
|
Molécule
de diazène :
|
|
NH3

|
HN
= NH
H –
N = N – H
|
III-Constitution d’une molécule organique.
1)-
La molécule organique.
- Une molécule organique comporte le plus souvent une chaine
carbonée et éventuellement un groupe caractéristique ou groupe fonctionnel.
- Les liaisons entre atomes constituant une molécule organique
sont covalentes.

2)-
La chaîne carbonée ou squelette carboné.
- On appelle chaine carbonée l’enchainement des atomes de
carbone liés entre eux par des liaisons covalentes.
-
Exemple le butane
C4H10.
-
On peut donner différentes représentations de cette molécule.
|
Formule
brute
|
C4H10
|
|
Formule développée
|
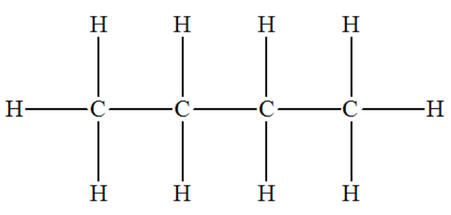
|
|
Formule semi-développée
|
CH3
–
CH2
–
CH2
–
CH3
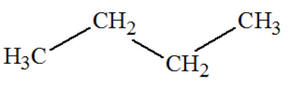
|
|
Formule topologique
|

|
|

|
|
Butane
|

3)-
Groupe caractéristique.
-
Certaines molécules organiques présentent un groupe caractéristique
ou groupe fonctionnel.
- Les différents groupes caractéristiques permettent de
regrouper les molécules organiques en différentes familles.
- Les molécules qui possèdent le même groupe caractéristique
présentent des propriétés chimiques semblables.
- Exemples :
|
Famille
|
Exemple
|
|
Famille des alcools
|
Éthanol
CH3
–
CH2
–
OH
|
|
Famille des aldéhydes
|
Éthanal
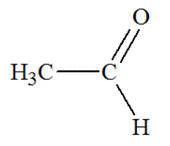
|
|
Famille des cétones
|
Acétone ou propanone
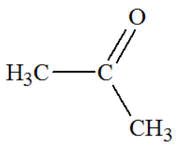
|
|
Famille des acides
carboxyliques
|
Acide
acétique
ou éthanoïque
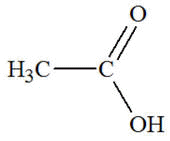
|
|
Famille des amines
|
Éthanamine
CH3
–
CH2
–
NH2
|
|
Famille des amides
|
Acétamide
ou éthanamide
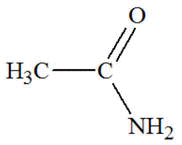
|
|
Famille des esters
|
Éthanoate
d’éthyle
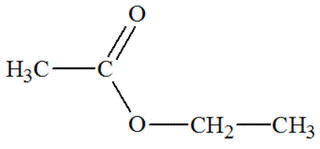
|
|
Famille
des dérivés
halogénés
|
Chloroéthane
CH3
–
CH2
–
Cl
|
IV-
Diversité des chaînes carbonées.
1)-
Chaîne ‘’linéaire’’, chaîne ramifiée et chaîne cyclique.
-
La chaîne carbonée est dite linéaire lorsque chaque atome de
carbone n’est lié qu’à deux atomes de carbone au plus.
- Exemple : le n-butane ou le butane linéaire :
|
Formule
brute
|
C4H10
|
|
Formule développée
|

|
|
Formule semi-développée
|
CH3
–
CH2
–
CH2
–
CH3
ou

|
|
Formule topologique
|

|
- La chaîne carbonée est ramifiée si un ou plusieurs atomes de
carbone sont liés à plus deux autres atomes de carbone.
- Exemple : l’isobutane ou méthylpropane
|
Formule
brute
|
C4H10
|
|
Formule
développée
|

|
|
Formule
semi-développée
|
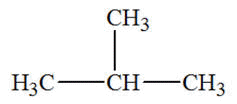
Ou
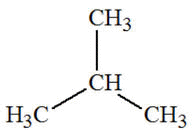
|
|
Formule
topologique
|
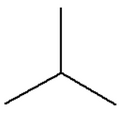
|
|

|

|
|
Butane
|
Isobutane
|
- La chaîne carbonée peut former un cycle si elle se referme sur
elle-même.
-
C’est le cas de la molécule de cyclohexane, de benzène de styrène,…
|
cyclohexane
|

|
|
Benzène
|
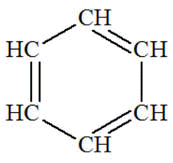
ou

|
|
Styrène
|
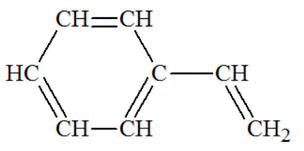
ou
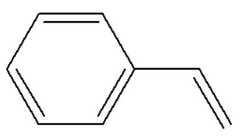
|

2)-
Chaîne saturée et chaîne insaturée.
- Une chaîne carbonée est saturée si tous les atomes de carbone
ne forment que des liaisons simples entre eux.
-
C’est le cas de la molécule de butane et de la molécule
d’isobutane.
-
Lorsque au moins deux atomes de carbone voisins sont liés par
une double (ou une triple) liaison, la chaîne carbonée est dite insaturée.
- C’est le cas de l’éthylène :
C2H4.
|
CH2
= CH2
ou
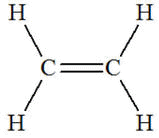
|
V-
Représentation des molécules. Isomérie.
1)-
Formule brute.
-
La formule brute d’une molécule indique la nature et le
nombre des atomes constituant la molécule.
- Elle ne donne aucune indication sur la structure de la molécule :
chaîne carbonée, groupe fonctionnel,…
- Exemple :
|
Formule
brute
|
Indication
|
|
C4H10
|
Butane
ou isobutane ?
|
|
C2H6O
|
Alcool
ou éther oxyde ?
|

2)-
La formule développée plane.
- Elle indique l’enchaînement des atomes et la nature des
liaisons qui les unissent.
- Exemples :
|
Formule
développée :
n-butane
|

|
|
Formule
développée :
éthanol
|

|

3)-
Formule semi-développée.
- Elle dérive de la formule développée.
-
Elle ne fait pas apparaître
les liaisons entre un atome d’hydrogène et un autre atome.
- Exemple : butane linéaire
|
Formule
brute
|
C4H10
|
|
Formule
développée
|

|
|
Formule
semi-développée
|
CH3
–
CH2
–
CH2
–
CH3
ou

|

4)-
Formule
topologique.
- La chaîne carbonée est représentée sous forme de ligne brisée.
- Les atomes autres que
le carbone
C
et l’hydrogène
H sont représentés de manière
explicite ainsi que les atomes d’hydrogène
H
qu’ils portent.
- Exemples :
|
|
Formule
topologique
|
|
n-butane
|

|
|
isobutane
|

|
|
Propan-1-ol
|

|

5)-
Les isomères de constitution.
- Définition :
- Les isomères de constitution sont des molécules qui ont la même
formule brute mais qui différent par l’enchaînement de leurs atomes.
-
Parmi les isomères de constitution, on distingue :
- Les isomères de chaîne : les chaînes carbonées sont
différentes.
- Les isomères de position : la position du groupe
fonctionnel ou de la double liaison sont différentes.
-
Les isomères de fonction : les groupes fonctionnels sont
différents.
- Exemples :
|
Isomérie
de chaîne
|
le butane et
l’isobutane
|
|
CH3
–
CH2
–
CH2
–
CH3

|
|
Isomérie
de position
|
CH3
–
CH2
–
CH2
–
OH
Propan-1-ol
|
|
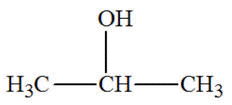
Propan-2-ol
|
|
Isomérie
de fonction
|
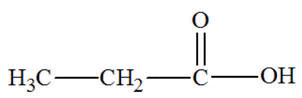
Acide propanoïque
|
|
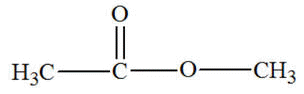
Éthanoate de
méthyle (ester)
|
VI-
Les Alcanes.
1)-
Définitions.
- Les hydrocarbures sont des composés organiques dont la molécule
ne contient que des atomes de carbone
C
et d’hydrogène
H.
- Les alcanes sont des hydrocarbures saturés.
-
Leurs atomes de
carbones sont tétragonaux.
- La formule générale d’un alcane non cyclique est :
CnH2n+2.
- Les cycloalcanes
(ou cyclanes) sont des alcanes à chaîne cyclique.
- La formule générale d’un alcane cyclique est :
CnH2n.

2)-
Nomenclature des alcanes.
a)- Les alcanes à chaîne linéaire.
- Les quatre premiers alcanes ont un nom consacré par l'usage :
- méthane (CH4), éthane (C2H6), propane (C3H8), butane (C4H10).
- Pour les autres alcanes à chaîne linéaire, on utilise un préfixe
grec indiquant le nombre d'atomes de carbone que l'on fait suivre du suffixe
-ane.
- Le tableau ci-dessous donne les préfixes des alcanes de
n =
5 à n = 18.
|
Nombre
d'atomes
de carbone :
n
|
Formule
|
Préfixe
|
Nom
|
|
5
|
C5H12
|
pent-
|
pentane
|
|
6
|
C6H14
|
hex-
|
hexane
|
|
7
|
C7H16
|
hept-
|
heptane
|
|
8
|
C8H18
|
oct-
|
octane
|
|
9
|
C9H20
|
non-
|
nonane
|
|
10
|
C10H22
|
déc-
|
décane
|
|
11
|
C11H24
|
undéc-
|
undécane
|
|
12
|
C12H26
|
dodéc-
|
dodécane
|
|
13
|
C13H28
|
tridéc-
|
tridécane
|
|
14
|
C14H30
|
tétradéc-
|
tétradécane
|
|
15
|
C15H32
|
pentadéc-
|
pentadécane
|
|
16
|
C16H34
|
hexadéc-
|
hexadécane
|
|
17
|
C17H36
|
heptadéc-
|
heptadécane
|
|
18
|
C18H38
|
octadéc-
|
octadécane
|
b)- Les groupements alkyles.
- Un alcane non cyclique peut s'écrire :
CnH2n
+1
–
H
ou R
–
H
- R
–
est un groupement alkyle.
- On obtient un groupement alkyle en enlevant un atome d'hydrogène
à la formule d'un alcane.
- Exemples :
|
CH3
–
|
Groupe méthyle
|
|
CH3
–
CH2
–
|
Groupe éthyle
|
|
CH3
–
CH2
–
CH2
–
|
Groupe propyle
|
|

|
Groupe
isopropyle
ou
Méthyléthyle
|
c)- Alcanes à chaîne carbonée ramifiée.
|
Nomenclature des alcanes ramifiés
Méthode :
- On obtient le nom de l'alcane de la manière suivante :
- On cherche la chaîne carbonée la plus longue et le
nom de
l'alcane à chaîne linéaire
comportant le même nombre d'atomes de carbone.
- L'alcane considéré est nommé comme un dérivé de cet alcane
linéaire.
- La chaîne la plus longue s'appelle la
chaîne principale.
- On identifie les groupes substituants sur cette chaîne et leur
place par un indice de position.
- Cet indice s'obtient grâce à la numérotation des atomes de
carbone de la chaîne principale.
- Deux sens de numérotation existent, pour trouver le bon sens de
numérotation :
- On écrit tous les indices obtenus par ordre croissant.
- Le sens
à retenir est celui pour lequel le premier chiffre différent est le plus
petit.
- Ou bien on choisit celui pour lequel la somme des indices
est la plus petite.
- Dans l'écriture du nom de l'alcane, on doit respecter deux règles
:
- Les indices de position des groupes alkyles se placent devant le
nom du groupe.
- Les groupes alkyles s'écrivent avant le nom de l'alcane.
- Deux
chiffres sont séparés par une virgule et entre un chiffre et une lettre, on
place un tiret.
- On fait élision du "e" du nom de l'alkyle.
- Les
groupements alkyles sont placés par ordre alphabétique.
- S'il existe plusieurs groupes identiques, en utilise les préfixes
: di, tri, tétra…
- Les substituants halogènes se traitent comme les groupes
alkyles.
|
d)- Exemple : Nommer la molécule suivante :

- Première étape : on cherche la chaîne principale que
l’on numérote.
|
On cherche la chaîne principale et les différents groupes substituants
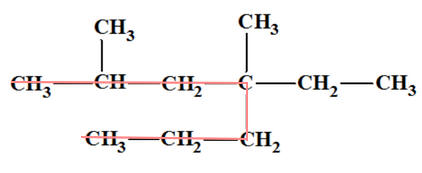
On met en évidence les différents groupes substituants.

On peut donner une autre représentation pour plus de simplicité.
On donne les deux sens de numérotation.
Numérotation 1:
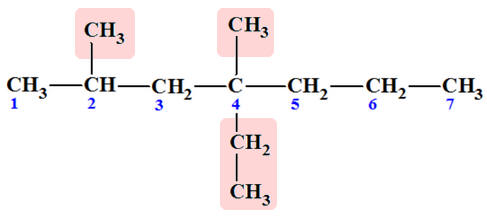
Nom 1 :
4-éthyl-2,4-diméthylheptane
Numérotation 2 :

Nom 2 :
4-éthyl-4,6-diméthylheptane
Le sens de numérotation
à retenir est celui pour lequel
le premier chiffre différent est le plus
petit.
Le nom retenu est celui de la numérotation 1 :
4-éthyl-2,4-diméthylheptane
|
VII-
Les alcènes.
1)-
Définition.
- Les alcènes sont des hydrocarbures insaturés, non cycliques,
qui possèdent une double liaison carbone - carbone
: C
=
C.
- Leur formule brute générale :
CnH2n.
- Remarque :
-
Les atomes de carbone de la double liaison sont
trigonaux.

2)-
Nomenclature des alcènes.
- Le suffixe
-ène caractérise les alcènes.
|
Méthode :
- On obtient le nom d'un alcène de la manière suivante :
- On cherche la chaîne carbonée la plus longue contenant la
double liaison.
- On compte le nombre d'atomes de carbone de cette chaîne
principale et on obtient le nom de l'alcène grâce au
préfixe grec
indiquant le nombre d'atomes
de carbone suivi du suffixe
-ène.
- On numérote les atomes de carbone de la chaîne principale de
façon à avoir les plus petits indices pour les atomes de carbone doublement
liés.
- La place de la double liaison est indiquée par son indice de
position placé avant le suffixe - ène.
- C'est la place de la double liaison qui impose le sens de numérotation.
- Comme pour les alcanes, on indique les groupes substituants de
la chaîne principale avec leur indice de position.
|
- Exemple : nommer la molécule suivante :

-
2,3-diméthylbut-2-ène

3)-
L’isomérie
Z
et E
ou stéréo-isomérie.
- Autour d’une simple liaison carbone – carbone
C
– C, il y a libre rotation alors qu’il n’existe pas de libre
rotation autour d’une double liaison carbone - carbone
C
=
C.
- Exemple : Que peut-on dire des molécules suivantes ?
Les nommer.
|

Molécule A
But-2-ène
|

Molécule B
But-2-ène
|
- Les molécules
A
et B
différent par la position, par rapport à l’axe de la double liaison, des
deux atomes d’hydrogène.
- Les deux molécules ne sont pas superposables.
- Pour passer de la molécule
A
à la molécule
B, il faut rompre certaines
liaisons et en reformer d’autres.
- Il n’y a pas libre rotation autour d’une double liaison
carbone - carbone :
C = C.
- Les molécules
A
et B
sont des molécules distinctes que l’on peut séparer.
- La température d'ébullition normale du (Z)-but-2-ène est de
3,7 °C
alors que celle de l'isomère (E)-but-2-ène est de
0,9 °C
- Les molécules
A
et B
sont des stéréo-isomères.
- On dit que le but-2-ène existe dans deux configurations :
- La configuration
Z
(de l'allemand
zusammen:
ensemble) où les deux atomes d’hydrogène sont situés du même côté de
la double liaison,
- Et la configuration
E (de l'allemand
entgegen:
opposé) où les deux atomes d’hydrogène sont situés de part et d'autre de
la double liaison.
|
Définition :
- Si, dans un alcène de formule générale
CHX
=
CHY,
les deux atomes d’hydrogène sont dans le même demi-plan
par rapport à
l’axe de la double liaison
C = C, le stéréo-isomère
est Z
,
dans le cas contraire, il est
E.
|

stéréo-isomère
E
Entgegen
|

stéréo-isomère
Z
Zusammen
|
|
- Cas du but-2-ène :
|

(Z) But-2-ène
|

(E) But-2-ène
|
VIII-
Influence de la chaîne carbonée.
1)-
Évolution des propriétés physiques.
a)-
La température de changement d’état.
- Au sein d’une même famille, les températures de fusion
θfus
et d’ébullition
θeb
augmentent avec le nombre d’atomes de carbone
ou la longueur de la chaîne carbonée.
- Remarque :
-
Les alcanes ramifiés ont une température d’ébullition
θeb supérieure à celle de
l’alcane
linéaire ayant le même nombre d’atomes de carbone dans la chaîne
principale
-
( il faut comparer le propane avec le méthylpropane et ainsi de
suite)
|
Alcanes
linéaires
|
Alcanes
ramifiés
|
|
Nom
|
θfus
°C
|
θeb
°C
|
Nom
|
θfus
°C
|
θeb
°C
|
|
Méthane
|
- 184
|
- 164
|
Méthylpropane
(C4H10)
|
-
145
|
-
10
|
|
Éthane
|
- 172
|
- 88,5
|
Méthylbutane
(C5H12)
|
-
159
|
28
|
|
Propane
|
- 190
|
- 44,5
|
Diméthylpropane
(C5H12)
|
-
17
|
10
|
|
Butane
|
- 135
|
0,6
|
2-méthylpentane
(C6H14)
|
-
154
|
60,3
|
|
Pentane
|
- 131
|
36,2
|
3-méthylpentane
(C6H14)
|
-
118
|
63,3
|
|
Hexane
|
- 94
|
69
|
2,2-diméthylbutane
(C6H14)
|
-
98
|
49,7
|
|
Heptane
|
- 90
|
98,5
|
2,3-diméthylbutane
(C6H14)
|
-
129
|
58
|
|
Octane
|
- 56.5
|
126
|
2-méthylhexane
(C7H16)
|
-
154
|
61
|
b)-
La densité.
- La densité augmente avec le nombre d’atome de carbone de
la chaîne carbonée.
|
Alcanes
linéaires
|
Alcanes
ramifiés
|
|
Nom
|
Densité
|
Nom
|
Densité
|
|
Méthane
|
0,72
(gaz)
|
Méthylpropane
(C4H10)
|
2,67
(gaz)
|
|
Éthane
|
1,36
(gaz)
|
Méthylbutane
(C5H12)
|
0,62
(liquide)
|
|
Propane
|
2,01
(gaz)
|
Diméthylpropane
(C5H12)
|
0,61
(liquide)
|
|
Butane
|
2,70
(gaz)
|
2-méthylpentane
(C6H14)
|
0,65
(liquide)
|
|
Pentane
|
0,63
(liquide)
|
3-méthylpentane
(C6H14)
|
0,66
(liquide)
|
|
Hexane
|
0,66
(liquide
|
2,2-diméthylbutane
(C6H14)
|
0,65
(liquide)
|
|
Heptane
|
0,68
(liquide
|
2,3-diméthylbutane
(C6H14)
|
0,66
(liquide)
|
|
Octane
|
0,70
(liquide
|
2-méthylhexane
(C7H16)
|
0,66
(liquide)
|
c)-
Solubilité.
-
D’une manière générale, la solubilité dans l’eau décroît
lorsque la longueur de la chaîne carbonée augmente.
|
Alcanes
linéaires
|
Alcanes
ramifiés
|
|
Nom
|
Solubilité
|
Nom
|
Solubilité
|
|
Méthane
|
Eau : 5,0 mL / L
Éthanol :
0,05 L
/ L
Éther : très soluble
|
Méthylpropane
(C4H10)
|
Eau : peu soluble
Éthanol :
1,35 L
/ L
Ether :
2,84 L
/ L
|
|
Éthane
|
Eau : 4,7 mL/L
Éthanol :
0,15 L
/ L
|
Méthylbutane
(C5H12)
|
Eau : très peu soluble
Éthanol : soluble
Éther : soluble
|
|
Propane
|
Eau : peu sol
Éthanol : très
soluble
Éther : très soluble
|
Diméthylpropane
(C5H12)
|
Eau : insoluble
Éthanol : soluble
Éther : soluble
|
|
Butane
|
Eau : 15 mL / L
Éthanol :
1,9 L
/ L
Éther :
3 L
/ L
|
2-méthylpentane
(C6H14)
|
Eau : peu soluble
Éthanol : soluble
Éther : soluble
|
|
Pentane
|
Eau : insoluble
Éthanol : soluble
Éther : soluble
|
3-méthylpentane
(C6H14)
|
Eau : peu soluble
Éthanol : soluble
Éther : soluble
|
|
Hexane
|
Eau : peu soluble
Éthanol : très
soluble
Éther : très soluble
|
2,2-diméthylbutane
(C6H14)
|
Eau : peu soluble
Éthanol : soluble
Éther : très soluble
|
|
Heptane
|
Eau : insoluble
Éthanol : très
soluble
Éther : Très soluble
|
2,3-diméthylbutane
(C6H14)
|
Eau : peu soluble
Éthanol : soluble
Éther : soluble
|
|
Octane
|
Éthanol : soluble
Ether :
soluble
|
2-méthylhexane
(C7H16)
|
Eau : insoluble
Éthanol : soluble
Éther : soluble
|

2)-
Application à la distillation fractionnée.
- La distillation permet de séparer deux liquides miscibles qui
ont des températures d’ébullition différentes.
- On connaît la distillation simple et la distillation fractionnée.
-
La distillation simple :
- Schéma du montage :

Cliquer sur l'image pour l'agrandir
|
(1)‑
Chauffe-ballon.
(2)‑ Mélange.
(3)‑ Thermomètre.
(4)‑ Réfrigérant oblique.
(5)‑Arrivée et Sortie de l’eau.
(6)‑ Éprouvette.
(7)‑ Fleur de lavande.
(8)‑ Huile essentielle.
(9)- Support élévateur (Vallet)
|
- La distillation fractionnée :

|
|
|
(1)‑Chauffe-ballon.
(2)‑Mélange.
(3)‑Colonne de Vigreux.
(4)‑Thermomètre.
(5)‑Arrivée et Sortie de l’eau.
(6)‑Condenseur.
(7)‑Éprouvette.
(8)‑Distillat.
(9)- Support élévateur
(Vallet) |
- La distillation fractionnée permet de séparer et de recueillir
les constituants d’un mélange d’espèces chimiques ayant des températures
d’ébullition différentes.
- L’espèce chimique extraite en premier est l’espèce la plus
volatile, celle dont la température d’ébullition est la plus faible.
- La distillation fractionnée des pétroles, qui est un mélange
d’hydrocarbures est la première étape du raffinage.
- La séparation et la
purification s’effectuent dans une tour à distillation.

Tour de distillation
pour le pétrole, Montréal, Québec

IX-
Applications.
1)- QCM :

2)- Exercices :
|
Exercices
|
|
1)-
Exercice 2 page 192.
|
|
2)-
Exercice 3 page 192.
|
|
3)-
Exercice 7 page 192.
|
|
4)-
Exercice 9 page 193.
|
|
5)-
Exercice 10 page 193.
|
|
6)-
Exercice 13 page 193.
|
|
7)-
Exercice 20 page 195.
|

![]()