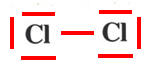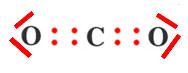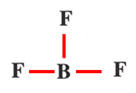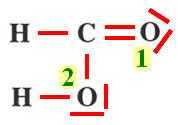|
Géométrie des molécules. Méthode VSEPR. Cours. |
|
|
1)- Formule électronique d’un atome.
► Le principe de Pauli
- Une couche électronique de nombre quantique n contient au maximum 2 n2 électrons.
- Les électrons d’un atome dans son état fondamental (état le plus stable) remplissent les couches de plus basse énergie.
- Ordre de remplissage :
|
Nombre quantique n |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
Couche |
K |
L |
M |
N |
O |
P |
Q |
- Ainsi la couche K ne peut contenir au plus que : 2 électrons.
- La couche L, 8 électrons,
- Et la couche M, 18 électrons (Pour le moment, on se limite à 8 électrons sur la couche M et la couche N).
- Les électrons de l’atome remplissent progressivement les différentes couches électroniques.
- Une couche électronique est saturée lorsqu’elle contient son nombre maximal d’électrons.
- Les électrons se placent d’abord dans la couche K,
- Puis quand celle-ci est saturée à 2 électrons, ils remplissent la couche L.
- Quand la couche L est saturée à 8 électrons, ils remplissent la couche M.
- L’état de l’atome obtenu en utilisant ce principe de
remplissage est appelé : l’état fondamental.
- Représentation sur un axe :

► Formule électronique de quelques atomes :
|
Atome |
Symbole |
Numéro atomique |
Structure électronique |
|
Carbone |
C |
Z = 6 |
K 2 L 4 |
|
Sodium |
Na |
Z = 11 |
K 2 L 8 M 1 |
|
Calcium |
Ca |
Z = 20 |
K
2 L
8 M
8 N
2 |
2)- Représentation de Lewis des atomes. Schéma de Lewis.
► La représentation de Lewis schématise la structure électronique externe, on parle aussi de couche de valence.
► Règles :
|
Les électrons appariés sont représentés par des tirets — Les électrons célibataires sont représentés par des points • Le nombre d’électrons célibataires donne la valence de l’atome. |
► Schéma de Lewis des premiers atomes :
► Valence d’un atome :
- L’atome d’hydrogène
 possède
1 électron célibataire : il est monovalent.
possède
1 électron célibataire : il est monovalent.
- L’atome d’oxygène
![]() possède
2 électrons célibataires : il est divalent.
possède
2 électrons célibataires : il est divalent.
- L’atome d’azote
![]() possède
3 électrons célibataires : il est trivalent.
possède
3 électrons célibataires : il est trivalent.
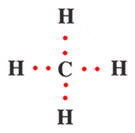
- L’atome de carbone
![]() possède
4 électrons célibataires : il est tétravalent.
possède
4 électrons célibataires : il est tétravalent.
3)- Représentation de Lewis des molécules.
► La liaison covalente :
- C’est une liaison forte et dirigée. Elle résulte de la mise en commun de deux électrons entre deux atomes.
► Règles de l’octet :
- Un atome cherche toujours à acquérir la configuration électronique la plus stable qui est celle du gaz rare le plus proche dans la classification périodique.
![]() Pour acquérir une structure électronique en octet,
les atomes peuvent :
Pour acquérir une structure électronique en octet,
les atomes peuvent :
- Gagner ou perdre des électrons pour former des ions.
- Former des liaisons covalentes par la mise en commun d’une ou plusieurs paires d’électrons.
- Remarque :
- Les paires d’électrons sont appelés doublets de liaisons, on les représente par un tiret entre les deux atomes
► Exemples :
- La molécule de dichlore Cl2.
|
La molécule de dichlore Cl2 |
Mise en commun
|
Schéma de Lewis
|
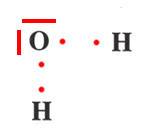
- La molécule d’eau H2O.
|
La molécule d’eau H2O |
Mise en commun
|
Schéma de Lewis
|
- La molécule de dioxyde de carbone CO2.
|
La molécule de dioxyde de carbone CO2 |
Mise en commun
|
Schéma de Lewis
|
► Remarques :
- Les paires d’électrons liées sont engagés dans une liaison covalente.
- On parle aussi de paires liantes ou de doublets liants.
- Les paires d’électrons libres ne sont pas engagés dans une liaison covalente.
- Elles sont attachées à un seul atome.
- On parle de paires non liantes ou de doublets non liants.
4)- Insuffisance du modèle de Lewis.
- La formule de Lewis ne rend pas compte de la géométrie des molécules et du caractère dirigé des liaisons covalentes.
►
Cas de molécules complexes :
L'acide nitrique
HNO3
- C’est une méthode assez récente (1960) que l’on doit à Ronald J. GILLEPSIE (chimiste britannique)
- Le sigle est l’abréviation de VALENCE SHELL ELECTRON PAIR REPULSION
- C’est-à-dire répulsion des paires d’électrons de la couche de valence.
![]() La méthode VSEPR permet, après analyse du schéma
de Lewis, de prévoir la géométrie des molécules ou ions simples.
La méthode VSEPR permet, après analyse du schéma
de Lewis, de prévoir la géométrie des molécules ou ions simples.
![]() Elle s’applique à des molécules ou des ions du
type :
Elle s’applique à des molécules ou des ions du
type :
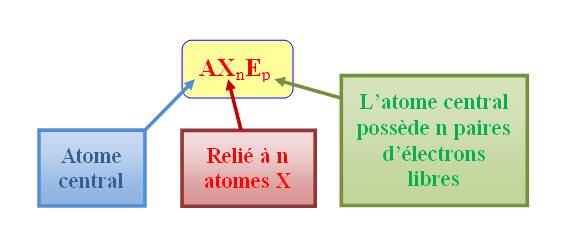
AXnEp
- A désigne l’atome central qui est lié à n atomes X et qui possède p paires d’électrons libres (ou p doublets non liants).
► Exemples :
|
La molécule de dioxyde de carbone
CO2 |
2 atomes d’oxygène O :
n = 2
de paires libres : p = 0. |
Schéma de Lewis |
|
Type :
AX2 |
||
|
La molécule d’eau H2O |
2 atomes d’hydrogène H :
n = 2
2 paires libres : p = 2. |
Schéma de Lewis |
|
Type :
AX2E2 |
||
- Représentation schématique :
![]() La géométrie d’une molécule ou d’un ion dépend du
nombre total de paires d’électrons (doublets d’électrons) de la
couche de valence de l’atome central
A.
La géométrie d’une molécule ou d’un ion dépend du
nombre total de paires d’électrons (doublets d’électrons) de la
couche de valence de l’atome central
A.
![]() Les paires d’électrons de la couche de valence de
l’atome central se disposent de façon à ce que leurs répulsions
mutuelles soient minimales (c’est-à-dire que leurs distances
soient maximales)
Les paires d’électrons de la couche de valence de
l’atome central se disposent de façon à ce que leurs répulsions
mutuelles soient minimales (c’est-à-dire que leurs distances
soient maximales)
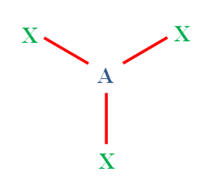
III- Molécules de type AXn avec liaisons simples.
- Tableau :
|
Type de molécule |
AX2 |
AX3 |
AX4 |
|
Nombre de paires liantes d’électrons |
2 |
3 |
4 |
|
Géométrie de la molécule |
Atome central digonal X — A — X Molécule linéaire |
Atome central trigonal
Molécule trigonale plane |
Atome central tétragonal
Molécule tétraédrique |
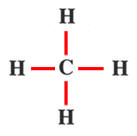
a)- Donner la géométrie des molécules suivantes : BeCl2, BF3, CH4.
![]() Pour appliquer la méthode
VSEPR :
Pour appliquer la méthode
VSEPR :
- On compte les paires
liantes de la couche de valence de l’atome central en s’aidant
de la formule de Lewis
- On en déduit la géométrie de la molécule ou de l’ion en s’aidant du tableau.
|
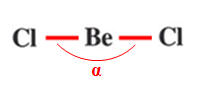
BeCl2 |
Mise en commun
Schéma de Lewis
Formule développée
|
Géométrie de la molécule
Molécule linéaire |
ℓBe
– Cl = 225 pm
α = 180 ° |
|
Type :
AX2 |
|||
|
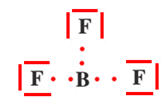
BF3 |
Mise en commun
Schéma de Lewis
Formule développée
|
Géométrie de la molécule
|
ℓB
– F = 129 pm
α = 120 ° |
|
Type :
AX3 |
|||
|
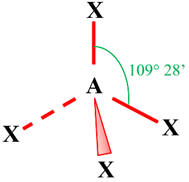
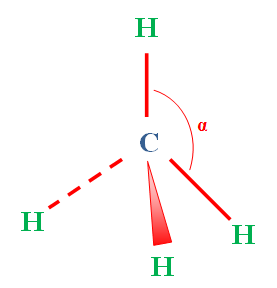
CH4 |
Mise en commun
Schéma de Lewis
Formule développée
|
Géométrie de la molécule
|
ℓC
– H = 109 pm
α =
109°28’ |
|
Type :
AX4 |
|||
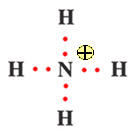
b)- Écrire la formule de Lewis de l’ion ammonium. Proposer une structure géométrique pour cet ion (VSEPR).
|
NH4+ |
Schéma de Lewis de chaque atome :
L’atome d’azote a perdu un électron :
Formule développée
|
Géométrie de la molécule 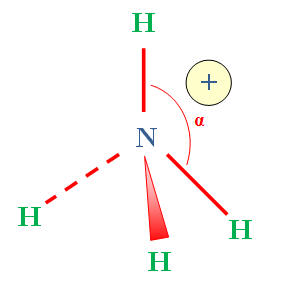
|
ℓN
– H = 101 pm
α =
109°28’ |
|
Type :
AX4 |
|||
c)- Écrire la formule de la molécule éthane C2H6. Proposer une structure géométrique pour cette molécule (VSEPR).
|
C2H6 |
Schéma de Lewis de chaque atome :
Formule développée
|
Géométrie de l a molécule : On prend individuellement chaque atome de carbone.
La molécule est de type AX3X’ analogue à AX4. Chaque atome de carbone est tétraédrique, mais le tétraèdre formé est irrégulier.
|
ℓC
– H = 109 pm
ℓC
– C = 153 pm
α =
109°28’ |
|
Type :
AX4 |
|||
- Remarque : ces caractéristiques se retrouvent dans tous les alcanes :
- Carbone tétragonal
- Angle entre 2 liaisons 109° 28’
d)- Conclusion :
![]() Une molécule de type
AXnYm
a une structure géométrique semblable à celle d’une molécule de
type AXn+m
Une molécule de type
AXnYm
a une structure géométrique semblable à celle d’une molécule de
type AXn+m
![]() La méthode s’applique également aux ions
polyatomiques.
La méthode s’applique également aux ions
polyatomiques.
IV- Molécules de type AXn avec liaisons multiples.
![]() On compte le nombre de liaisons entourant l’atome
central, chaque liaison multiple comptant comme une liaison
simple.
On compte le nombre de liaisons entourant l’atome
central, chaque liaison multiple comptant comme une liaison
simple.
![]() On en déduit la géométrie de la molécule ou de
l’ion conditionnée par la répulsion minimale.
On en déduit la géométrie de la molécule ou de
l’ion conditionnée par la répulsion minimale.
► Remarque :
- Une liaison multiple est toutefois plus répulsive qu’une simple liaison.
- Une triple liaison est plus répulsive qu’une double liaison.
- Les angles formés par des doubles liaisons sont plus grands que ceux formés par des simples liaisons.
a)- Donner la représentation de Lewis de la molécule de dioxyde de carbone. Donner son type et sa géométrie.
|
La molécule de dioxyde de carbone CO2 |
Schéma de Lewis de
la molécule :
|
Géométrie de la molécule
Molécule linéaire |
|
Type :
AX2 |
||
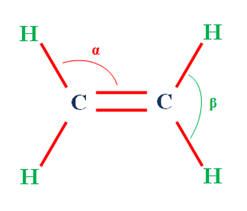
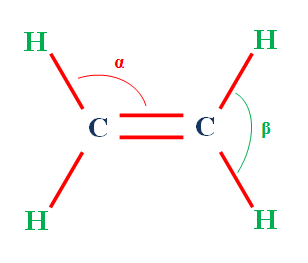
b)- Donner la représentation de Lewis de la molécule de d’éthène. Donner son type et sa géométrie.
- On prend individuellement chaque atome de carbone comme atome central.
|
La molécule d'éthène C2H4 |
Schéma de Lewis de la molécule :
|
Géométrie de la molécule On prend individuellement chaque atome de carbone comme atome central. On fait la même chose pour chaque atome de carbone. Le type est AX2X’ qui est analogue à AX3 pour chaque atome de carbone. Chaque atome de carbone est trigonal. |
|
Type :
AX3
pour chaque atome de carbone |
||
► Insuffisance du modèle :
- La méthode VSEPR ne permet pas de déterminer complètement la géométrie de la molécule.
- L’association de
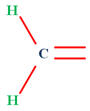 et
et
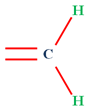 peut
donner :
peut
donner :
|
1
|
ou |
2
|
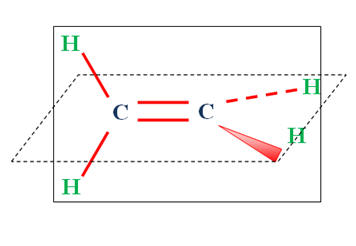
- L’étude stéréochimique montre que la molécule est plane.
|
Géométrie de la molécule
α =
117,4° β = 121,3°
ℓC
– H = 109 pm
ℓC
= C = 134 pm |
► Les caractéristiques géométriques obtenues avec l’éthène se retrouvent dans tous les alcènes.
- Les 2 atomes de carbones doublement liés sont trigonaux,
- Les angles sont voisins de 120 ° pour les atomes trigonaux.
V- Molécules de types AXnEp.
![]() On compte le nombre total de paires d’électrons
liés et libres entourant l’atome central sans les différencier.
On compte le nombre total de paires d’électrons
liés et libres entourant l’atome central sans les différencier.
![]() On en déduit la géométrie de la molécule ou de
l’ion conditionnée par la répulsion minimale.
On en déduit la géométrie de la molécule ou de
l’ion conditionnée par la répulsion minimale.
![]() Une paire d’électrons libres est plus répulsive
qu’une paire d’électrons liés.
Une paire d’électrons libres est plus répulsive
qu’une paire d’électrons liés.
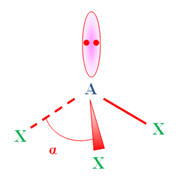
- L’angle entre deux paires libres est plus grand que l’angle entre deux paires liantes.
|
Paires libres p |
1 |
2 |
1 |
|
Type de molécules |
AX3E1 |
AX2E2 |
AX2E1 |
|
Géométrie |
|
Ou
|
|
|
Angle |
α < 109,5 ° |
α < 109,5 ° |
β < 120 ° |
|
Structure |
Pyramidale trigonale |
Angulaire ou coudée |
Structure angulaire |
3)- Exemples de molécules et d’ions.
- Donner la représentation de Lewis des molécules et ions suivants :
- H2O, H3O+, OH–, NH3, CO32–, de l’ozone O3,
- Donner le type et en déduire la géométrie.
|
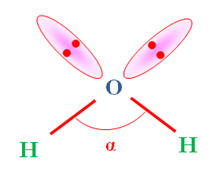
La molécule d’eau H2O |
Schéma de Lewis de la molécule :
|
Géométrie de la molécule Arrangement tétraédrique
Molécule coudée α < 109,5 ° α ≈ 104,5 ° |
|
Type :
AX2E2 |
||
|
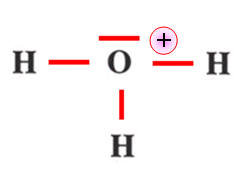
L’ion oxonium H3O+ |
Schéma de Lewis
de l’ions :
|
Géométrie de l’ion Arrangement tétraédrique
L’oxygène est tétraédrique L’ion oxonium a une structure Pyramidale à base triangulaire α < 109,5 ° α ≈ 107,5 ° |
|
Type :
AX3E |
||
|
L’ion carbonate CO32– |
Schéma de Lewis :
|
Géométrie
Forme triangulaire plane Carbone trigonal |
|
Type :
AX3 |
||
|
La molécule d’ozone O3 |
Schéma de Lewis
:
La règle de l’octet n’est pas vérifiée pour l’atome d’oxygène central
La règle de l’octet est vérifiée pour tous les atomes d’oxygène |
Géométrie Forme triangulaire plane Oxygène trigonal
α ≈ 120 ° |
|
Type :
AX2E1 |
||
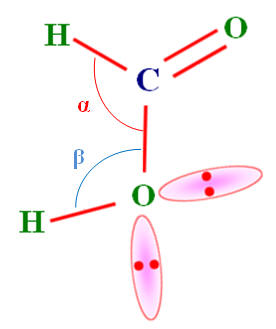
- Déterminer la représentation de Lewis de la molécule d’acide méthanoïque CH2O2.
- En déduire sa géométrie à l’aide de la méthode VSEPR.
|
La molécule d’acide méthanoïque CH2O2 |
Schéma de Lewis :
|
Géométrie L’atome de carbone joue un rôle central Carbone trigonal
L’atome d’oxygène 2 est tétraédrique α ≈ 120 ° β ≈ 105 ° |
|
Type de l’atome de carbone central :
AX3
Type de
l’atome d’oxygène 2 :
AX2E2 |
||
|
|