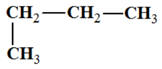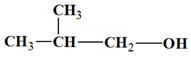|
QCM N° 11 a |
Alcanes et Alcools |
|
|
QCM
N° 11 a :
Pour chaque
question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
La molécule
de
formule brute
C2H6O :
|
est un
alcane. |
ne peut
présenter
de
ramifications. |
peut être
un alcool. |
BC |
|
2 |
La molécule
d’alcane
de formule
semi-développée : |
est
ramifiée. |
possède
trois
isomères. |
est
linéaire. |
C |
|
3 |
Le
2-méthylbutane a
pour
formule : |
|
|
|
BC |
|
4 |
Le modèle
moléculaire
ci-dessous
est celui : |
2,3,3-triméthyl
propan-1-ol |
2,3-diméthyl
butan-4-ol |
2,3-diméthyl
butan-1-ol |
C |
|
5 |
La molécule
de
2-méthylpropan-1-ol
a pour
formule
semi-développée : |
|
|
|
C |
|
6 |
Le butane
bout à une
température : |
supérieure à
celle du
2-méthylpropane. |
inférieure à
celle du
propane. |
inférieure à
celle du
pentane. |
AC |
|
7 |
L’éthanol
C2H5OH
obtenu par
fermentation
du moût de
raisin bout
à une
température : |
supérieure à
celle du
méthanol. |
inférieure à
celle de
l’éthane. |
inférieure à
celle du
propan-1-ol. |
AC |
|
8 |
Le butan-1-ol
a une
température
d’ébullition
plus élevée
que le
propan-1-ol
car : |
sa chaîne
carbonée est
plus longue. |
les liaisons
hydrogène
entre
les
molécules de
butan-1-ol
sont
plus
intenses
qu’entre
celles
de
propan-1-ol. |
les
interactions
de Van der
Waals
entre
molécules
de butan-1-ol
sont
plus
intenses
qu’entre
celles
de
propan-1-ol. |
AC |
|
9 |
Une
distillation
fractionnée
permet de
séparer deux liquides : |
miscibles. |
non
miscibles. |
dont les
températures
d’ébullition
sont
très
différentes. |
AC |
|
10 |
Lors de la
distillation
du mélange
pentane (θéb
= 36 ° C),
octane (θéb = 125 ° C) : |
le pentane
et l’octane
sont séparés. |
le pentane
constitue le
distillat. |
le pentane
constitue
le résidu. |
AB |
|
11 |
Un alcool est
miscible
à l’eau :
|
si sa chaîne
carbonée est
courte. |
si sa chaîne
carbonée
est longue. |
grâce à
l’existence
de liaisons
hydrogène. |
AC |
|
12 |
La
miscibilité avec
l’eau du
butan-1-ol
est : |
moins grande
que celle
de
l’hexan-1-ol
avec l’eau. |
plus grande
que celle de
l’hexan-1-ol
avec l’eau. |
moins grande
que celle
du butane
avec l’eau. |
BB |
►
La chaîne carbonée :
-
On appelle chaine carbonée l’enchaînement des atomes de carbone liés
entre eux par des liaisons covalentes.
-
Une chaîne carbonée ramifiée comprend plus de trois atomes de
carbone.
►
Les alcanes :
-
Les hydrocarbures sont des composés organiques dont la molécule ne
contient que des atomes de carbone C
et d’hydrogène H.
-
Les alcanes sont des hydrocarbures saturés. Leurs atomes de carbones
sont tétragonaux.
-
Chaque atome de carbone forme avec ses atomes voisins quatre liaisons
simples.
-
Les alcanes sont des hydrocarbures acycliques (non cyclique) de
formule brute générale : CnH 2n+2.
-
Les cyclanes sont des hydrocarbures présentant au moins une chaîne
cyclique.
-
La formule brute générale d’un cyclane ne présentant qu’un seul cycle
est : CnH 2n.
►
Les alcools :
-
On appelle alcool tout composé organique possédant un groupe
hydroxyle – OH lié à un atome de carbone tétragonal.
-
Formule générale d’un alcool : R – OH.
►
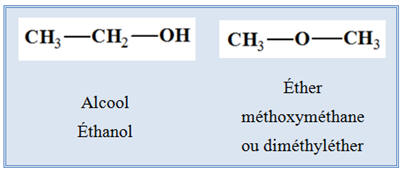
La molécule de formule brute : C2H6O
-
Les différents isomères :
►
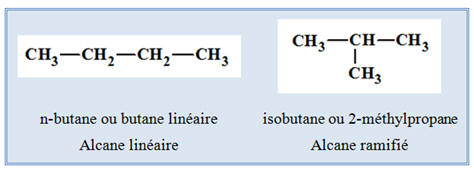
Molécule de butane : C4H10
-
Cette molécule possède deux isomères.
►
2-méthylbutane :
-
Formule brute : C5H12
-
Formule semi-développée :
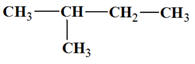 ou
ou
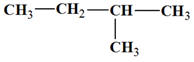
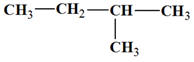
►
Modèle moléculaire :
-
Formule brute : C6H14O
-
Formule semi développée :
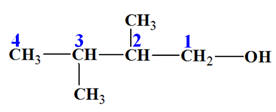

-
Nom : 2,3-diméthylbutan-1-ol
-
Vue 3 D : 

►
Molécule et nom :
►
Températures de changement d’état des alcanes :
-
Alcanes linéaires : Les températures de fusion et d’ébullition des
alcanes linéaires augmentent avec le nombre n
d’atomes de carbone de la chaîne carbonée.
-
L’intensité des interactions de Van Der Waals et de ce fait les
températures de fusion et d’ébullition des alcanes linéaires augmentent avec
la longueur de la chaîne carbonée des molécules.
- Alcanes ramifiés :
- Pour des alcanes isomères, la température
d’ébullition θéb
est d’autant plus basse que l’isomère est ramifié.
-
Les interactions de Van Der Waals sont moins importantes pour les
molécules ramifiées que pour les isomères linéaires.
-
Le butane bout à une température supérieure à celle du
2-méthylpropane ‘isomère ramifié du butane).
-
Le butane (la chaîne a 4 atomes de carbone) bout à une
température inférieure à celle du pentane (la chaîne a 5 atomes de carbone).
►
Températures de changement d’état des alcools :
-
La température d’ébullition d’un alcool croît avec le nombre
n d’atomes de carbone de la chaîne carbonée.
-
Les alcools ont des températures d’ébullition supérieures à celle des
alcanes de même chaîne carbonée
-
L’éthanol C2H5OH
bout à une température supérieure à celle du méthanol.
-
L’éthanol C2H5OH
bout à une température inférieure à celle du propan-1-ol.
-
L’intensité des interactions de Van Der Waals et de ce fait les
températures de fusion et d’ébullition des alcanes linéaires augmentent avec
la longueur de la chaîne carbonée des molécules.
-
Les interactions de Van Der Waals sont moins importantes pour les
molécules ramifiées que pour les isomères linéaires.
►
Distillation fractionnée :
-
Montage :
|
(1)‑Chauffe-ballon. (2)‑Mélange. (3)‑Colonne de Vigreux. (4)‑Thermomètre. (5)‑Arrivée et Sortie de
l’eau. (6)‑Condenseur. (7)‑Éprouvette. (8)‑Distillat. (9)- Support élévateur (Vallet) |
-
La distillation fractionnée permet de séparer et de recueillir les
constituants d’un mélange d’espèces chimiques miscibles ayant des
températures d’ébullition différentes.
-
L’espèce chimique extraite en premier est l’espèce la plus volatile,
celle dont la température d’ébullition est la plus faible.
►
Distillation :
-
Lors de la distillation du mélange pentane (θéb
= 36 ° C), octane (θéb = 125 ° C), le distillat est
constitué par l’espèce la plus volatile.
-
Ici, le pentane.
- La distillation permet de séparer le pentane de l’octane.
- L’octane
constitue le résidu.
►
Miscibilité des alcools dans l’eau :
- Les alcools à chaîne courte (nombre de d’atomes de carbone de la chaîne carbonée n < 4) sont solubles dans l’eau en toutes proportions.
- méthanol, éthanol, propan-1-ol et propan-2-ol
- On obtient des mélanges homogènes.
-
Lorsque la longueur de la chaîne carbonée des alcools augmente, on
remarque que la miscibilité dans l’eau diminue.
-
Les molécules d’eau et les molécules d’alcools forment des liaisons
hydrogène.
-
Un alcool possède :
-
Un groupe hydroxyle – OH, on parle de
groupe hydrophile (il peut s’entourer de
molécules d’eau et former des liaisons hydrogène)
-
Un groupe alkyle R –, chaîne carbonée, qui est le
groupe hydrophobe.
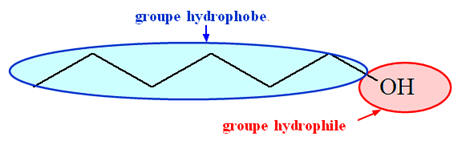
-
La miscibilité est liée à l'importance relative de ces deux parties.
►
Tableau :
|
|