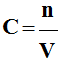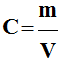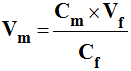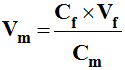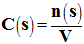|
QCM N° 01 Révisions |
Couleurs et images |
|
|
|
|
QCM N° Révisons 01:
Couleurs et images
Pour chaque
question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
Dans un milieu homogène et transparent,
la lumière : |
se propage
en
ligne
courbe. |
se propage
en ligne
droite. |
ne se
propage
pas. |
B |
|
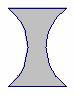
2 |
La lentille
photographiée
ci-dessous :
|
est
convergente. |
peut être
schématisée
par
|
peut modéliser les milieux
transparents
de l’œil. |
AC |
|
3 |
Le point d’intersection des rayons lumineux de la photographie
ci-dessous :
|
est le point
où se concentre
l’énergie
lumineuse. |
est appelé
le foyer de
la lentille. |
est appelé
le centre
de la
lentille. |
AB |
|
4 |
La lumière perçue d’un
objet
dépend : |
de
l’objet. |
de la
lumière
qui
l’éclaire. |
des radiations
émises par
la source
lumineuse. |
ABC |
|
5 |
Le spectre
représenté
ci-dessous : |
est un spectre
d’émission. |
permet
d’identifier
les entités
chimiques
qui absorbent
des
radiations. |
peut être
obtenu à
l’aide d’un
prisme. |
BC |
|
6 |
Une espèce chimique
est : |
un corps
pur. |
un
mélange. |
toujours
liquide. |
A |
|
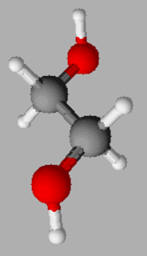
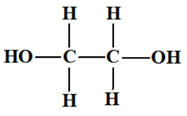
7 |
La molécule d’éthylène
glycol,
représentée
ci-dessous, a :
|
pour
formule
brute
C2H6O2 |
pour
formule
semi-développée :
|
pour
formule
semi-développée :
|
AB |
|
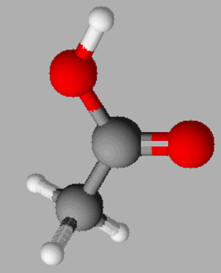
8 |
L’acide éthanoïque,
représenté
ci-dessous, et
l’éthylène
glycol sont
deux espèces :
|
isotopes. |
isomères. |
différentes. |
C |
|
9 |
Une solution de volume V contient une quantité de matière n de soluté correspondant à une
masse
m. Sa concentration molaire
est : |
|
|
|
B |
|
10 |
La quantité de soufre
(M (S) = 32,1 g / mol) présente dans 3,21 g
de
soufre est :
|
0,100 mol |
1,00 mol |
0,321 mol |
A |
|
11 |
Pour préparer un volume Vf de solution fille de concentration Cf, à partir
d’une solution mère de concentration Cm, il faut prélever un volume Vm
de
solution mère
tel que : |
|
|
|
C |
|
12 |
Les équations qui vérifient la conservation des éléments chimiques et de la charge électriques
sont : |
O2 (g)
+ H2 (g) →
H2O
(g) |
C2H6O
(ℓ)
+ 3 O2 (g) →
2 CO2 (g)
+ 3 H2O (g) |
Mg (s)
+ 2 H+ (aq)
→
Mg2+ (aq)
+ H2(g) |
BC |
Les chapitres concernés :
|
Chimie |
|
Chap. N° 05 Dissolution des composés ioniques et moléculaires. |
►
Principe de propagation rectiligne de la
lumière.
-
La lumière se propage en ligne droite dans
tout milieu transparent homogène (comme l’air, l’eau et le vide).
-
Le trajet suivi par la lumière peut être
modélisé par une ligne droite fléchée dans le sens de la propagation.
-
Ce modèle de représentation s’appelle le
rayon lumineux.
- Schéma :
|
Œil |
Modélisation |
|
Pupille |
Diaphragme |
|
Cristallin - cornée |
Lentille convergente |
|
Rétine |
Écran |
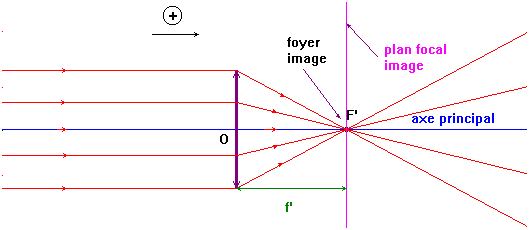
►
Les lentilles convergentes :
-
Un rayon lumineux passant par le centre
optique ne subit aucune déviation.
-
Tout rayon incident parallèle à l’axe
principal d’une lentille convergente en émerge en passant par le point
F’
appelé foyer - image de la lentille.
-
La loi du retour inverse de la lumière permet
de dire que tout rayon passant par F, symétrique de
F’ par
rapport au centre optique O émerge parallèlement à l’axe principal.
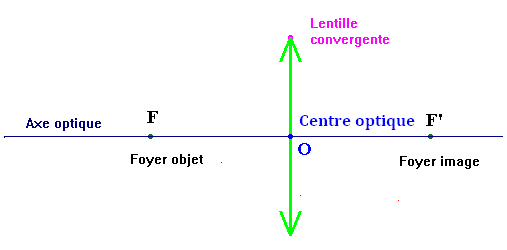
-
Représentation symbolique d’une lentille
convergente :

-
Foyer de la lentille : point où se concentre
l’énergie lumineuse.
►
Couleur d’un objet :
-
Absorption, transmission, diffusion :
-
Les objets qui nous entourent sont visibles
car ils nous envoient une partie de la lumière qu’ils reçoivent généralement
d’une source extérieure.
-
Lorsqu’un objet reçoit de la lumière, il peut
(en partie ou totalement) :
-
L’absorber
-
La transmettre si la lumière peut
traverser l’objet
-
La diffuser, c’est-à-dire la renvoyer
dans toutes les directions.
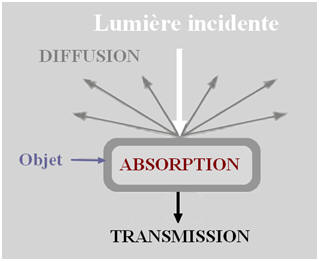
-
L’absorption est le phénomène par
lequel un objet éclairé absorbe une partie de la lumière incidente (s’il
absorbe toute la lumière incidente, il apparait noir)
-
La transmission est le phénomène par
lequel un objet transparent est traversé par une partie de la lumière
incidente.
-
La diffusion est le phénomène par
lequel un objet éclairé envoie dans toutes les directions une partie de la
lumière incidente.
-
La couleur d’un objet dépend :
-
De la nature de la lumière incidente
-
De l’absorption et de la diffusion de la
lumière incidente par l’objet
-
De la synthèse des lumières reçues par l’œil.
-
La couleur perçue d’un objet dépend :
-
Des lumières colorées que l’objet absorbe,
diffuse et transmet
-
De l’éclairage
-
De l’observateur
►
Spectre d’émission :
-
Un spectre d’émission est un spectre produit
par la lumière directement émise par une source.
-
Un spectre lumineux est la figure obtenue par
décomposition d’une lumière complexe en ses radiations lumineuses.
-
Pour décomposer ou disperser la lumière, on
utilise un prisme ou un réseau.
►
Les spectres de raies d’émission.
-
Un gaz, à faible pression et à température
élevée, émet une lumière constituée d’un nombre limité de radiations.
-
On obtient un spectre de raies.
-
Ce spectre est constitué de raies colorées
sur fond noir.
-
Le spectre obtenu est caractéristique des
atomes du gaz qui émet les radiations.
-
Un spectre de raies constitue la signature
d’un élément chimique et révèle sa présence.
-
Il permet d’identifier une entité chimique
(atome ou ion).
-
Un spectre d’absorption est un spectre obtenu
en analysant la lumière blanche qui a traversé une substance.
►
Spectres de raies d’absorption.
-
Un gaz, à basse pression et à basse
température, traversé par une lumière blanche, donne un spectre
d’absorption.
-
Ce spectre est constitué de raies noires se
détachant sur le fond coloré du spectre de la lumière blanche.
-
Ce spectre est caractéristique de la nature
chimique d’un atome ou d’un ion.
►
Espèce chimique :
-
Un ensemble d’entités moléculaires, ioniques
ou atomiques identiques constitue une espèce chimique.
-
Une espèce chimique est symbolisée par une
formule chimique.
-
Une espèce chimique constitue un corps pur :
-
Un mélange est constitué de plusieurs corps
purs.
►
Éthylène glycol :
-
Tableau :
|
Formule
brute |
Formule
développée |
Formule
semi-développée |
|
C2H6O2 |
|
|
►
Molécule isomères :
-
Deux molécules isomères ont même formule
brute mais des enchaînements d’atomes différents.
-
Les isomères ont des propriétés physiques et
chimiques différentes et constituent des espèces chimiques distinctes.
-
L’acide éthanoïque (C2H4O2)
et l’éthylène glycol (C2H6O2)
sont des molécules différentes.
►
Concentration molaire :
-
La concentration molaire volumique
C (s)
en soluté apporté est égale au quotient de la quantité de matière
n (s)
en soluté apporté par le volume V de la solution :
|
|
|
►
Quantité de matière :
-
Relation :
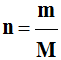
-
Application numérique :
-
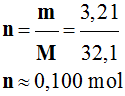
►
La dilution :
-
Lors d’une dilution, la concentration molaire
du soluté diminue, mais sa quantité de matière ne change pas.
-
On dit qu’au cours d’une dilution, la
quantité de matière de soluté se conserve.
-
La solution de départ est appelée la solution
mère et la solution diluée est appelée la solution fille.

-
la quantité de matière
de soluté présente dans la solution mère :
![]() (1)
(1)
-
la
quantité de matière de soluté présente dans la solution fille :
![]() (2)
(2)
- Conséquence :
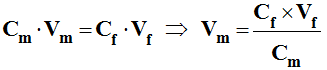
- Avec obligatoirement :
![]()
►
Équations chimiques :
|
O2
(g) +
2
H2 (g)
→
2
H2O
(g) |
|
C2H6O
(ℓ) +
3
O2 (g)
→
2
CO2 (g) +
3
H2O
(g) |
|
Mg
(s) +
2
H+ (aq) →
Mg2+ (aq)
+ H2(g) |