![]()
La spectroscopie
Cours
Exercices
|
|
La spectroscopie |
|
|
|
|
|
III- Interprétation énergétique. 2)- Émission de la lumière par un atome. 3)- Absorption de la lumière par un atome. 4)- Exemple : Spectre d’émission et d’absorption de l’atome de sodium : |
|
|
1)- Niveaux d’énergie de l’atome d’hydrogène. |
|
|
|
|
|
QCM N° 03
Sources de lumières, couleurs et photons |
-
La spectroscopie a
pour but d’analyser la lumière émise par une source ou transmise par un corps
absorbant.
-
On peut faire
l’analyse :
-
De la lumière émise
par une source lumineuse : on obtient un spectre d’émission ;
-
De la lumière ayant
traversée une substance transparente : on obtient un spectre d’absorption.
-
On utilise un
spectroscope.
-
Son fonctionnement est
basé sur la décomposition de la lumière en ses différentes radiations.
-
Le dispositif
essentiel d’un spectroscope est :
-
Soit un prisme ;
-
Soit un réseau.
►
Spectroscope à
prisme :

-
Décomposition de la
lumière blanche :
-
Le prisme dévie et
décompose la lumière blanche en lumières colorées du rouge au violet.
-
C'est un phénomène de
dispersion.
-
L'ensemble des
couleurs obtenues constitue le spectre de la lumière blanche.
-
Le spectre est continu
du rouge au violet.
-
Le prisme dévie plus
la radiation violette que la radiation rouge.
►
Spectroscope à
réseau :
- Un réseau est constitué d'un film transparent sur lequel on a gravé des traits parallèles, équidistants et très fins
- ( exemple le réseau noté : 580 : on a
gravé 580 traits par millimètre).
-
Schéma :
►
Remarques :
-
Dans le
spectroscope à prisme, on utilise le fait que la déviation d’une radiation
dépend de sa longueur d’onde
λ.
-
Dans le cas du prisme,
la radiation violette est plus déviée que la radiation rouge.
-
Dans le spectroscope à
réseau, on utilise les phénomènes de diffraction et d’interférences.
-
Un spectroscope à
réseau décompose la lumière blanche.
-
Il dévie plus le rouge
que le violet.
-
On distingue trois
sortes de spectres :
►
Les spectres
continus :
-
Ils sont émis par les corps
incandescents.
-
Ils permettent de
connaître la température d’un corps
-
Le spectre s’étend du
rouge vers le violet au fur et à mesure que la température du corps augmente.
►
Les spectres de
raies :
-
Ils sont émis par un
gaz monoatomique qui subit une décharge électrique (néon, hélium, lampe à vapeur
de mercure)
-
Les spectres de raies
sont caractéristiques des atomes qui les émettent.
-
On analyse à l’aide du
spectroscope la lumière émise par une lampe à vapeur de mercure puis une lampe à
vapeur de sodium.
-
La lampe à vapeur de
mercure contient des atomes (Hg)
de mercure sous faible pression.
-
Ces atomes subissent
des décharges électriques et sont excités.
-
Spectre de la lampe à
vapeur de mercure :
-
Longueurs d’ondes (les plus visibles) : 615 nm, 580
nm, 579 nm, 577 nm, 546 nm, 492 nm, 436 nm,
405 nm (que l’on devrait voir)
-
La lampe à vapeur de
sodium contient des atomes de sodium (Na).
-
Eux aussi subissent
des décharges électriques et sont excités.
-
Spectre de la lampe à
vapeur de sodium :
-
Le
doublet du sodium : radiations jaunes de longueur d’onde voisine de 590 nm (en
réalité, il s’agit d’un doublet :589,0 nm et 589,6 nm)
-
Spectre de l’atome
d’hydrogène :
-
Spectre de l’atome
d’hélium :
-
Quelques spectres
d’émission :
►
Les spectres de
bandes :
-
Ils sont émis par de
gaz polyatomique qui sous faible pression subit des décharges électriques.
-
Les spectres de bandes
sont caractéristiques des molécules qui les émettent.
-
Les molécules sont le
plus souvent constituées de plusieurs atomes.
-
Dans le calcul de
l’énergie d’une molécule il faut tenir compte de l’énergie de vibration, mais
aussi de l’énergie de rotation.
-
Les vibrations d’une
molécule sont dues aux oscillations des atomes autour d’une position
d’équilibre.
-
Une molécule peut
aussi posséder des mouvements de rotation autour de différents axes.
-
Cela dépend de la
géométrie de la molécule.
-
Les molécules
présentent des niveaux d’énergie quantifiés.
-
Chaque niveau est
associé à un état de vibration et de rotation donné.
-
Les spectres
moléculaires sont plus complexes que les spectres atomiques.
-
Le spectre de raies
d’absorption typique d’une molécule montre des séries de raies très proches les
unes des autres.
-
L’énergie
correspondante à ces transitions est de l’ordre du meV.
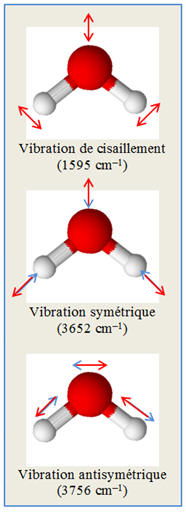
-
Schéma : niveaux
d’énergie électronique d’une molécule et sous niveaux.
-
Avec les spectroscopes
usuels dont le pouvoir de résolution est faible, les raies sont très proches les
unes des autres, on observe des bandes noires d’absorption.
-
On distingue :
-
Les spectres de raies
caractéristiques des atomes
-
Les spectres de bandes
caractéristiques des molécules ou des ions.
►
Spectres de raies
d’absorption :
-
Exemple :
-
Spectre d’absorption et d'émission
de l’atome d’hydrogène.
- Spectre d'absorption et d'émission du mercure :
- Spectre d'absorption et d'émission du néon :
-
Un atome absorbe les
radiations qu’il est capable d’émettre.
-
Un gaz, à basse
pression et à basse température, traversé par une lumière blanche, donne un
spectre d’absorption.
-
Ce spectre est
constitué de raies noires se détachant sur le fond coloré du spectre de la
lumière blanche.
-
Ce spectre est
caractéristique de la nature chimique d’un atome ou d’un ion.
-
Autres exemples :
-
Spectre
d'absorption de l'argon :
-
Spectre
d'absorption du cadmium :
-
Spectre d’absorption
du calcium :
►
Spectre de bandes
d’absorption :
-
Exemple spectre de
bande de la solution de permanganate de potassium :
-
Pour observer un
spectre de bande, on utilise le dispositif suivant :
-
On éclaire en lumière
blanche une solution aqueuse de permanganate de potassium :
-
K+
(aq) + MnO4–
(aq)
-
Lorsque que la
solution aqueuse de permanganate de potassium est éclairée en lumière blanche,
elle apparait de couleur magenta.

-
On peut obtenir le
spectre d’absorption de cette solution lorsqu’elle est éclairée en lumière
blanche :
![]() Expérience :
Expérience :
-
Observation :
-
La solution de
permanganate de potassium est violette lorsqu’on observe à la lumière du jour.
-
L’analyse de la
lumière transmise par la solution de permanganate de potassium révèle la
présence d’une bande sombre dans le spectre de la lumière blanche.
-
Une partie du vert et
du bleu a été absorbée par la solution.
-
On obtient un spectre
de bandes d’absorption. Les radiations absorbées dépendent de la nature du
milieu.
-
Un spectre de bande
est caractéristique de la substance dissoute.

-
Profil spectral :
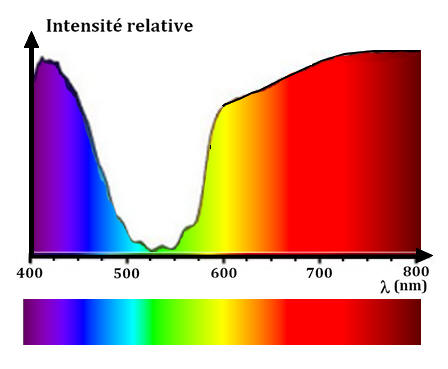
III-
Interprétation énergétique.
-
L’énergie d’un atome
ne peut prendre que certaines valeurs formant une suite discontinue( ou
discrète).
-
On dit que l’énergie
d’un atome est quantifiée.
-
Les états
correspondant à ces valeurs particulières sont appelés niveaux d’énergie d’un
atome.
►
Diagramme de niveaux
d’énergie.
-
Sur le diagramme de
niveaux d’énergie d’un atome :
-
Le niveau d’énergie
le plus bas correspond à l’état stable de l’atome.
-
On l’appelle
l’état
fondamental
-
Les autres niveaux
correspondent à des états moins stables.
-
On les appelle
les états
excités.
-
L’état de plus
haute énergie correspond à la perte d’un électron : l’atome est dit ionisé.
-
Par convention, son
énergie est notée :
E∞ = 0 eV.
-
Comme les écarts
entre les niveaux d’énergie sont faibles, on utilise l’électron-volt :
-
1 eV = 1,6 × 10–19
J
-
Remarque : Les
énergies des autres états sont négatives.
►
Schéma d’un diagramme
d’énergie d’un atome :
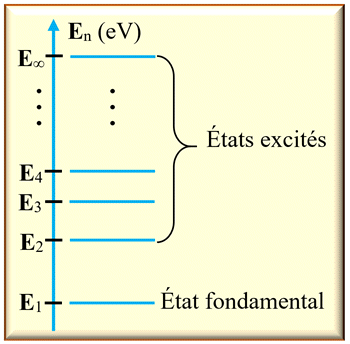
-
Le passage d’un niveau
d’énergie à un autre est appelé transition électronique.
2)- Émission de la lumière par un atome.
-
Dans ce cas,
Einitial >
Efinal
-
L’atome perd de
l’énergie en émettant un photon.
-
Sur un diagramme
d’énergie, on représente cette transition par une
flèche verticale
orienté vers le bas.
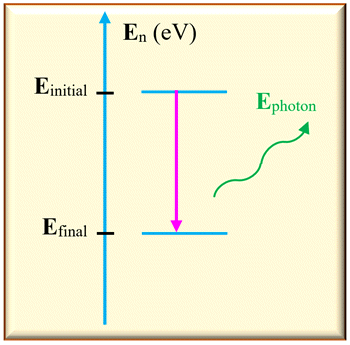
-
L’énergie libérée
est égale à la différence d’énergie entre les deux niveaux :
-
ΔE
= | Efinal –
Einitial
|
-
Cette énergie est
transportée par un photon :
-
Ephoton =
ΔE = |
Efinal
–
Einitial | =
h .
ν
-
La fréquence
ν
découle de la différence d’énergie
ΔE
= | Efinal –
Einitial
|
-
Si cette fréquence
appartient au domaine du visible, elle correspond alors à une raie colorée dans
le spectre d’émission de l’atome.
3)- Absorption de la lumière par un atome.
-
Dans ce cas,
Einitial <
Efinal
-
L’atome gagne de
l’énergie en absorbant un photon.
-
Sur un diagramme
d’énergie, on représente cette transition par une
flèche verticale
orienté vers le haut.
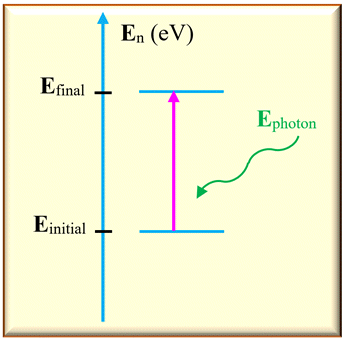
-
L’énergie absorbée
est égale à la différence d’énergie entre les deux niveaux :
-
ΔE
= | Efinal –
Einitial
|
-
Cette énergie est
transportée par un photon :
-
Ephoton =
ΔE = |
Efinal
–
Einitial | =
h .
ν
-
La fréquence
ν
découle de la différence d’énergie
ΔE
= | Efinal –
Einitial
|
-
L’absorption
d’énergie lumineuse par un atome ne peut se faire que si l’énergie du photon
permet une transition d’un niveau
Einitial à un niveau supérieur
Efinal
tel que :
-
Efinal –
Einitial
=
h
. ν
-
Si cette fréquence
ν
appartient au domaine du visible, elle correspond alors à une raie noire dans le
spectre de la lumière blanche.
4)- Exemple : Spectre d’émission et d’absorption de
l’atome de sodium :
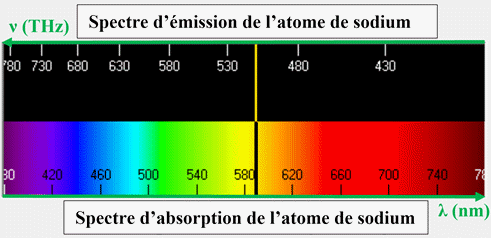
►
En conclusion :
-
Chaque entité
chimique possède son propre diagramme d’énergie.
-
Il est ainsi
possible d’identifier une entité chimique (atome, molécule ou ion) à partir de
son spectre d’émission ou d’absorption.
-
Les radiations
émises ou absorbées sont caractéristiques d’un atome car elles dépendent des
niveaux d’énergie de cet atome.
1)- Niveaux d’énergie de l’atome d’hydrogène.
-
L’atome
d’hydrogène H :
Z
= 1
-
Structure
électronique :
-
Dans
l’état fondamental :
K1 (ou
1s1)
-
On
caractérise cet atome à l’état fondamental par le nombre quantité
n
= 1.
-
Si
l’atome d’hydrogène se trouve dans un état excité, l’électron se trouve alors
sur une autre couche que la couche
K
(ou 1s).
|
Couche |
K |
L |
M |
N |
O |
P |
|
|
|
|
Nombre quantique
n |
1 |
2 |
3 |
4 |
5 |
6 |
|
|
|
►
Relation valable pour
l’atome d’hydrogène seulement :
-
Les
niveaux d’énergie électronique de l’atome d’hydrogène
H
sont donnés par la relation suivante :
![]()
-
n :
nombre quantique principal ( il peut prendre les valeurs entières : 1, 2, 3,4,
5, …∞)
-
E0
= 13,6 eV
-
En
représente l’énergie de l’atome d’hydrogène
H lorsque l’électron occupe la
couche de nombre quantique
n.
►
Construction du
diagramme énergétique de l’atome d’hydrogène.
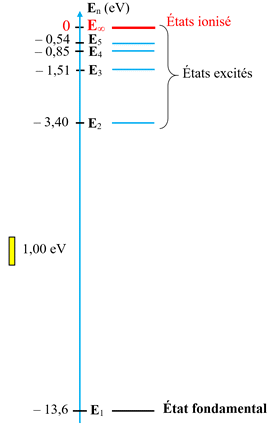
-
Si
n
= ∞ :
-
E∞
= 0 eV
-
L’atome est ionisé. Le
proton et l’électron sont séparés.
-
L’électron a une
énergie cinétique nulle et le proton et l’électron sont infiniment éloignés.
2)- Spectre de l’atome d’hydrogène.
-
Un tube rempli
d’hydrogène, sous faible pression, est soumis à une décharge électrique.
-
Il émet dans le
domaine visible quatre raies spectrales :
|
λα
= 656,3 nm |
Rouge–orange |
|
|
λβ
= 486,1 nm |
Bleu (cyan) |
|
|
λγ
= 434,0 nm |
Indigo |
|
|
λδ
= 410 ,2 nm |
violet |
|
-
Les
quatre raies Hα,
Hβ,
Hγ
et Hδ
forment la série de Balmer.
-
Des atomes d’hydrogène
se trouve dans des états excités.
-
Ils
vont rapidement perdre de l’énergie (10–8
s) pour revenir à l’état fondamental en passant éventuellement par des états
excités intermédiaires.
-
Les atomes d’hydrogène
effectuent des transitions électroniques.
-
Chaque transition
produit un photon d’énergie bien déterminée.
-
Spectre d’absorption
de l’hydrogène
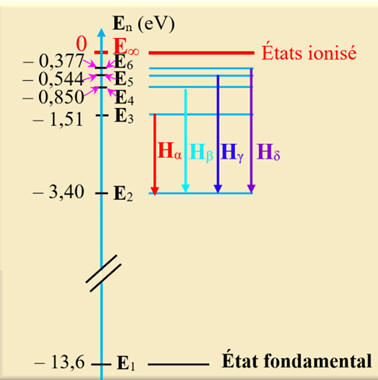
-
Un
atome d’hydrogène passe du niveau
n au niveau
p tel que
En
> Ep.
-
Y-a-t-il absorption ou
émission ?
-
Quel est l’énergie du
photon ? Sa longueur d’onde ? sa fréquence ?
►
Réponses :
-
Si
En
> Ep,
le photon est émis et son énergie
E
vaut :
-
E
= En
– Ep
-
Diagramme :
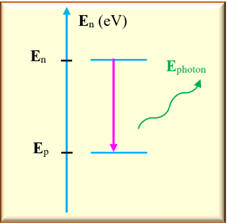
-
Fréquence du photon
émis :
-
E
= En
– Ep
= h
. υnp
-
Dans le cas de l’atome
d’hydrogène :
-
Énergie du photon
émis :
- ![]() et
et ![]()
- 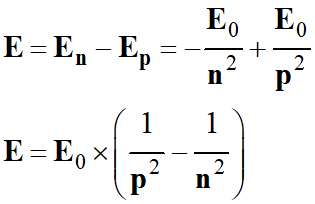
-
Fréquence du photon
émis :
- 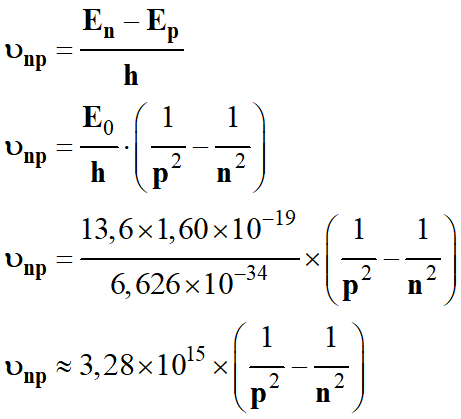
-
Longueur d’onde du
photon émis :
- 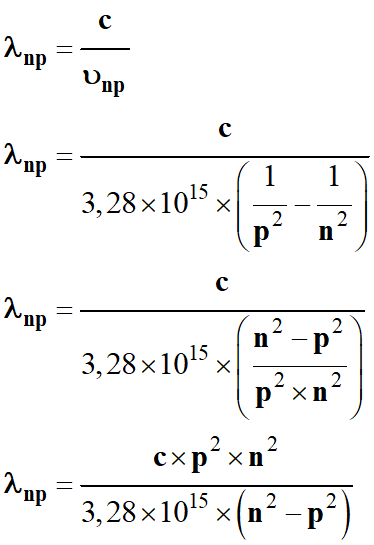
-
En
utilisant le fait que c = 3,00 × 108
m . s–1
-
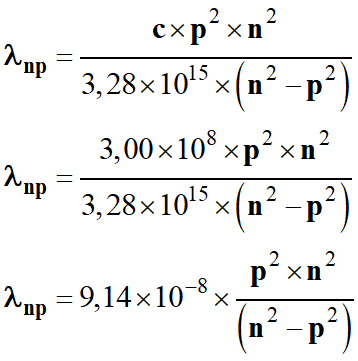
- Avec ces différentes expressions, on peut faire un programme avec la calculatrice
- pour déterminer les valeurs de l’énergie, de la fréquence et la longueur d’onde du photon émis
- à partir de la connaissance des niveaux d’énergie
n
et p.
-
Application
numérique :
-
p
= 2 et n
= 3 :
-
E
≈ 1,89 eV ≈ 3,02 × 10–19
J
-
υ32
≈ 4,56 × 1014 Hz
-
λ32
≈ 6,58 ×107 m ≈ 658 nm
-
C’est
Hα.
|
p
= 2 et n = 3 |
E
≈ 1,89 eV ≈ 3,02 × 10–19 J |
Hα |
|
υ32
≈ 4,56 × 1014 Hz |
||
|
λ32
≈ 6,58 ×107 m ≈ 658 nm |
||
|
p
= 2 et n = 4 |
E
≈ 2,55 eV ≈ 4,08 × 10–19 J |
Hβ |
|
υ42
≈ 6,15 × 1014 Hz |
||
|
λ42
≈ 4,87 ×107 m ≈ 487 nm |
||
|
p
= 2 et n = 5 |
E
≈ 2,86 eV ≈ 4,57 × 10–19 J |
Hγ |
|
υ52
≈ 6,89 × 1014 Hz |
||
|
λ52
≈ 4,35 ×107 m ≈ 435 nm |
||
|
p
= 2 et n = 6 |
E
≈ 3,02 eV ≈ 4,84 × 10–19 J |
Hδ |
|
υ62
≈ 7,29 × 1014 Hz |
||
|
λ62
≈ 4,11 ×107 m ≈ 411 nm |
||
|
p = 2 et n = 7 |
E
≈ 3,12 eV ≈ 5,00 × 10–19 J |
Plus
dans le
visible |
|
υ72
≈ 7,53 × 1014 Hz |
||
|
λ72
≈ 3,98 ×107 m ≈ 398 nm |
-
Comme
les atomes d’hydrogène existent dans tous les niveaux d’énergie possibles, les
raies d’émission correspondent aux transitions du niveau de rang
n
au niveau de rang p
tels que :
-
n
> p
=> En
> Ep
-
La
transition de n →
p
produit la radiation
υnp.
►
1ier
cas : Série de Lyman :
-
Pour
p
= 1, n
peut prendre toutes les valeurs :
n = 2, 3, 4, 5, 6, 7…
►
2ième
cas : Série de Balmer (visible)
-
p
= 2 , n
= 3, 4, 5, 6, 7…
►
3ième
cas : Série de Paschen
(IR)
-
p
= 3 , n
= 4, 5, 6, 7…
►
Série de Brackett (IR)
-
p
= 4 , n = 5,
6, 7…
►
Série de Pfund (IR) :
-
p
= 5 , n = 6,
7…
-
Lors des transitions
électroniques d’un atome, un photon est émis ou capté (absorbé).
►
Émission d’un photon :

-
Si
l’atome passe du niveau n au niveau
p
avec :
-
n
> p
=> En
> Ep
-
Un photon est émis :
-
Il
possède l’énergie E :
-
E
= En
– Ep
= h .
υnp
►
Absorption d’un
photon :
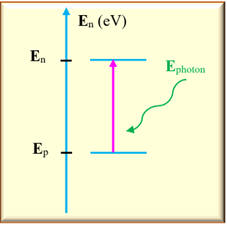
-
Si
l’atome passe du niveau p au niveau
n
avec :
-
n
> p =>
En
> Ep
-
Un photon est capté
(absorbé) :
- Il fournit l’énergie
E :
-
E
= En
– Ep
= h .
υnp
-
L’énergie du photon
émis ou absorbé est égale à l’énergie de la transition électronique mise en jeu.
-
Les spectres
d’émission ou d’absorption sont caractéristiques d’un atome, d’un ion ou d’un
noyau.
-
Ce sont les cartes
d’identité des atomes.
-
Ils permettent de les
identifier.
|
QCM N° 03
Sources de lumières, couleurs et photons |
|
|