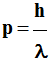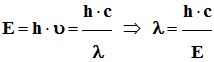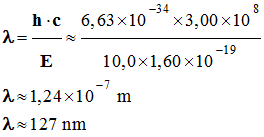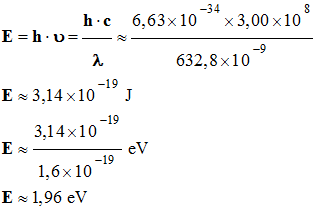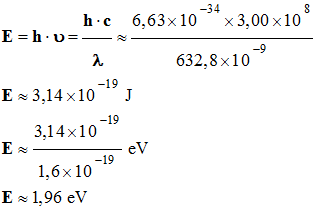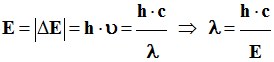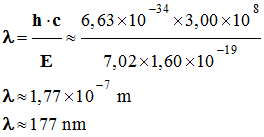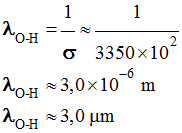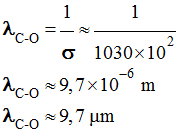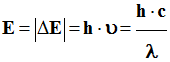|
Chap. N° 15 |
Transfert quantique d'énergie et dualité onde-corpuscule. Exercices. |
|
|
|
I- Exercice 8
page 390 : Créer une onde de matière avec un électron.
|
Un électron animé
d’une vitesse v
très inférieure à la vitesse de la lumière dans le vide
possède une quantité de mouvement noté
p. 1)-
Quelle est la relation entre p et v ?
Indiquer les unités des différentes grandeurs. 2)- Une particule matérielle en mouvement a des propriétés ondulatoires. On note λ la longueur d’onde associée à cette longueur d’onde de matière. Quelle est
la relation entre p et λ ? Indiquer les
unités des différentes grandeurs. |
|
Un électron animé
d’une vitesse v
très inférieure à la vitesse de la lumière dans le vide
possède une quantité de mouvement noté
p. 1)-
Quantité de mouvement de l’électron : - À toute particule matérielle de masse m animée d’une vitesse de valeur v très petite devant la célérité de la lumière,
on associe une grandeur physique appelée
quantité de mouvement.
-
L’électron est non
relativiste : v <<
c
-
Relation entre p
et v
-
p = m .
v
-
Unités des différentes
grandeurs :
2)-
Particule matérielle en mouvement :
-
En 1923, le physicien
français Louis de Broglie propose que la dualité
onde-particule s’applique aussi à toute particule
matérielle.
-
La dualité
onde-corpuscule conduit à associer une onde de longueur
d’onde λ à toute particule, matérielle ou non, de
quantité de mouvement p telle que :
-
Relation entre p
et λ :
-
Relation de de Broglie :
-
Unités des différentes
grandeurs.
-
L’aspect ondulatoire se
manifeste d’autant plus que la masse de la particule est
petite.
-
C’est le cas pour les
particules microscopiques comme l’électron, le proton et
le neutron.
-
Lorsque la masse de la
particule est grande, la longueur d’onde associée est
tellement faible que l’on ne peut pas mettre en évidence
les phénomènes de diffraction et d’interférence.
-
Il n’existe aucune
ouverture suffisamment petite pour pouvoir diffracter
l’onde associée à la particule.
-
Les unités : montrer que
(kg . m . s
– 1) = (J.s) . (m–
1).
-
(J)
= (N . m) = (kg . m . s–2. m) =
(kg . m2 . s–2)
-
(J.s)
. (m–
1)
= ((kg
. m2 . s–2).
s) . (m–
1)
= (kg . m . s–1)
|
II-
Exercice 10 page 390 : Connaître l’aspect
probabiliste.
|
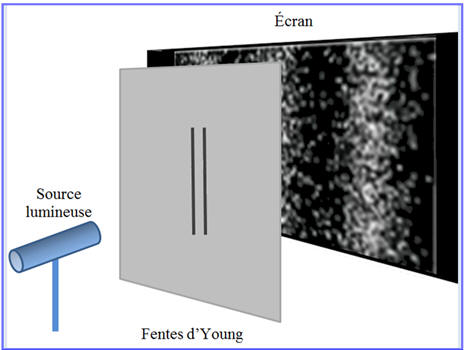
On fait passer des photons un par un à travers des fentes d’Young verticales. Une cellule photosensible placée à la sortie des fentes repère l’impact de chaque photon. La figure 1 est le résultat de l’impact (en blanc) de quelques photons. La figure 2
est obtenue pour un très grand nombre d’impacts.
1)- Peut-on
prévoir le lieu de l’impact d’un photon d’après la
figure 1 ? 2)- Quels sont
les endroits où l’impact d’un photon a le plus de chance
de se produire d’après la figure 2 ? 3)- Que peut-on
dire de ce phénomène quantique ? |
|
1)- Expérience
des fentes de Young :
-
On éclaire des fentes
d’Young avec une source lumineuse (Laser). - Un écran placé derrière les fentes repère l’impact des photons.
- On observe une
figure d’interférence.
-
On diminue l’intensité de
la lumière de telle sorte que les photons arrivent par
un sur les fentes.
-
En raison de cette
discontinuité, on parle de phénomène quantique.
-
Dans ces conditions, on
ne peut pas prévoir le lieu de l’impact des photons sur
l’écran.
-
Les impacts des électrons
sont répartis de façon aléatoire sur l’écran. 2)- Les endroits
où l’impact d’un photon a le plus de chance de se
produire d’après la figure 2 :
-
Pour un grand nombre
d’impacts, cette probabilité est maximale à certains
endroits et minimale à d’autres.
-
Cependant on peut
établir une probabilité de les observer à un endroit
précis.
-
L’impact d’un photon a
plus de chance de se produire sur des bandes verticales
parallèles aux fentes
-
Avec cette expérience, on
a mis en évidence l’aspect probabiliste du phénomène. 3)-
Caractéristique de ce phénomène quantique :
-
Avec cette expérience, on
a mis en évidence l’aspect probabiliste du phénomène. - Les phénomènes quantiques présentent un aspect probabiliste :
- On peut au mieux
établir la probabilité de présence de la particule à un
endroit donné. |
III-
Exercice 11 page 390 : Utiliser un diagramme
énergétique.
|
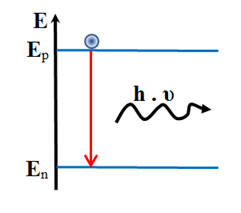
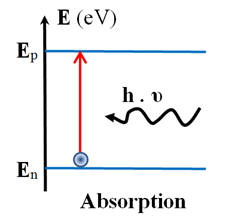
Le schéma ci-dessous représente
l’émission spontanée d’un photon.
1)- Que
représentent En et Ep ? 2)- Que
symbolise la flèche rouge ? 3)- Que
symbolise la flèche noire ? 4)- Expression
et relation : a)-
Que représente l’expression :
h . υ ? b)-
Quelle relation existe-t-il
entre : h . υ, En et
Ep ? |
|
1)-
Signification de En et Ep :
-
Les grandeurs
En et Ep
représentent les niveaux d’énergie d’un atome, d’un ion
ou d’une molécule.
-
Un atome, un ion ou une
molécule
excités peuvent libérer leur énergie par
émission spontanée d’un photon 2)- Que
symbolise la flèche rouge :
-
La flèche rouge indique
que l’entité passe d’un niveau d’énergie Ep
à un autre niveau d’énergie inférieur En.
-
Elle représente une
transition énergétique.
-
Un atome peut émettre
spontanément un photon quand il passe d’un niveau
d’énergie Ep à un niveau d’énergie
inférieur En 3)- Que
symbolise la flèche noire :
-
La flèche noire
représente l’émission spontanée d’un photon.
-
Cette émission a lieu de
façon aléatoire dans n’importe quelle direction de
l’espace.
-
L’émission spontanée
fournit des photons incohérents entre eux. 4)- Expression
et relation : a)-
L’expression : h . υ :
-
Cette expression
représente l’énergie quantifiée du photon émis. b)-
Relation existe-t-il entre :
h . υ, En et Ep :
-
ΔE = Ep
- En = h . ν
-
E = | Ep
- En | = h .
ν. |
IV-
Exercice 14 page 391 : Associer transition et
radiation.
|
1)- Citer deux
types de transitions énergétiques existant dans une
molécule. 2)- Un photon est émis lors d’une transition. La radiation associée à ce photon se situe dans l’infrarouge. À quel type de
transition est associée cette émission ? |
|
1)- Deux types
de transitions énergétiques existant dans une molécule.
-
Les transitions entre
niveaux d’énergie électronique.
-
Les transitions entre
niveaux d’énergie vibratoire.
-
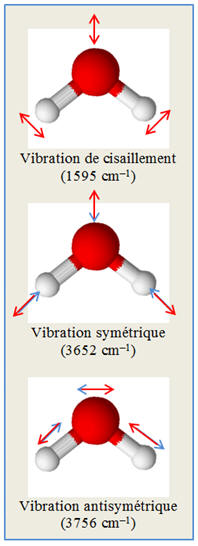
Une molécule est
constituée d’un nombre limité d’atomes qui vibrent les
uns par rapport aux autres.
-
Elle possède de l’énergie
vibratoire en plus de son énergie électronique liée à la
répartition des électrons.
-
Ces deux énergies sont
quantifiées.
-
Ces énergies ne peuvent
prendre que certaines valeurs particulières
caractéristiques de la molécule considérée.
-
On parle aussi de valeurs
discrètes.
-
Pour la molécule, on
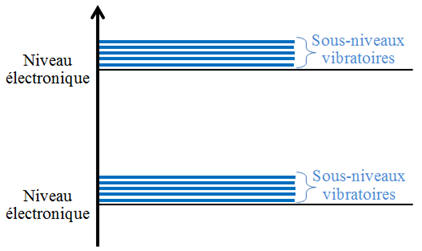
définit aussi des niveaux d’énergie électronique.
-
À chaque niveau d’énergie
électronique correspond des sous-niveaux d’énergie
vibratoire.
-
Exemple : la molécule
d’eau :
2)- Type de
transition est associée cette émission dans
l’infrarouge :
-
Une transition d’un
niveau électronique à un autre nécessite plus d’énergie
qu’une transition vibratoire.
-
Un domaine spectral est
associé à chacune de ces transitions.
-
Une transition d’énergie
électronique est associée à une radiation ultraviolette
ou visible.
-
Une transition d’énergie
vibratoire est associée à une radiation infrarouge.
-
Dans le cas présent, il
s’agit d’une transition entre niveaux d’énergie
vibratoire (émission dans l’infrarouge). |
V-
Exercice 15 page 391 : Étudier une transition.
|
Un photon d’énergie 10,0 eV est
émis, dans l’air, lors d’une transition entre deux
niveaux énergétiques d’une molécule. 1)- Étude de la
radiation associée : a)-
Calculer la longueur d’onde de
la radiation associée. b)-
À quel domaine spectral
appartient cette radiation ? 2)- Quel est le
type de transition mis en jeu ?
Données : 1 eV = 1,60
× 10–19 J ;
h = 6,63
× 10–34
J.s :
c = 3,00
× 108
m . s–1 |
|
1)- Étude de la
radiation associée : a)-
Calcul de la longueur d’onde de
la radiation associée.
-
-
Application numérique :
-
b)-
Domaine spectral de cette
radiation.
-
La longueur d’onde de la
radiation λ < 400 nm.
-
La radiation appartient
au domaine de l’ultraviolet. 2)- Type de
transition mis en jeu.
-
Il s’agit d’une
transition entre niveaux d’énergie électronique. |
VI-
Exercice 16 page 391 : Dualité ou non dualité.
|
On s’intéresse à trois systèmes en
mouvement dont les caractéristiques sont regroupées dans
le tableau suivant :
1)- Calculer
pour chaque système la longueur d’onde de l’onde de
matière associée. 2)- Caractère
ondulatoire : a)-
Justifier que l’électron est le
seul système dont le caractère ondulatoire est
observable ? b)-
Que peut-on dire de la masse
d’une particule pour laquelle le caractère ondulatoire
est observable ?
Données : Les distances entre les nucléons d’un noyau atomique sont de l’ordre de 10–16
à 10–15 m.
h = 6,63
× 10–34
J.s |
|
1)- Calcul pour
chaque système de la longueur d’onde de l’onde de
matière associée.
-
Tableau :
2)- Caractère
ondulatoire : a)-
Caractère ondulatoire observable :
-
L’aspect ondulatoire sera
observable seulement dans le cas de l’électron car λe
= 1,2 m.
-
Pour la boule de bowling
et le moustique λ < 10–16 (distance
entre les nucléons d’un noyau atomique).
-
Il n’existe pas
d’ouvertures ou d’obstacles suffisamment petits pour
diffracter ces deux systèmes. b)-
Masse d’une particule pour
laquelle le caractère ondulatoire est observable :
-
La masse d’une particule
doit être très petite pour que l’on puisse observer son
caractère ondulatoire (et sa vitesse très grande). |
VII-
Exercice 19 page 392 : Laser hélium-néon.
|
Le laser hélium-néon (He–Ne) émet
une lumière monochromatique de longueur d’onde dans le
vide égale à 632,8 nm.
1)- Quelle est
l’énergie d’un photon émis par ce laser ? On donnera une
estimation de cette énergie en joule et en
électron-volt. 2)- Quelle doit
être l’énergie d’un photon incident dans le milieu laser
afin de provoquer une émission stimulée ?
Données : 1 eV = 1,60
× 10–19
J ; h = 6,63
× 10–34
J.s :
c = 3,00
× 108
m . s–1 |
|
1)- Énergie d’un
photon émis par ce laser :
-
2)- Énergie d’un
photon incident dans le milieu laser :
-
L’électron incident doit
avoir la même énergie que l’électron émis.
-
E ≈ 1,96 eV - Un atome excité émet un photon grâce à la stimulation que provoque l’arrivée d’un photon
de même énergie que celui qu’il pourrait
potentiellement émettre. - La particularité de ce type d’émission est que le photon stimulé prend strictement
les mêmes caractéristiques (fréquence,
direction et sens et phase) que le photon incident. |
VIII-
Exercice 20 page 391 : Fonctionnement du laser
hélium-néon.
|
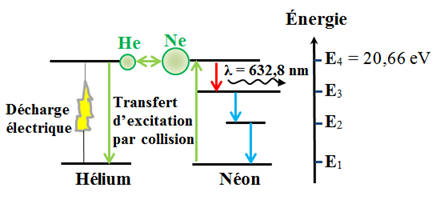
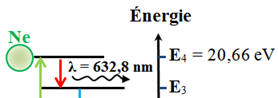
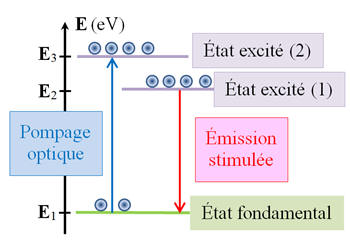
Le milieu laser d’un laser
hélium-néon est un mélange gazeux d’hélium et de néon
sous très faible pression. Lorsque le laser fonctionne, les atomes d’hélium sont excités par décharge électrique. Ces atomes entrent en collision avec les atomes de néon dans leur état fondamental. Ces derniers se retrouvent
dans un état excité d’énergie
E4
= 20,66 eV dit de longue vie. Des émissions spontanées entre les
niveaux d’énergie
E4 et E3 amorcent des émissions stimulées entre ces deux
mêmes niveaux. Les atomes de néon subissent
ensuite deux désexcitations spontanées et rapides vers
les niveaux d’énergie
E2 et E1.
1)- Comment
excite-t-on : a)-
Les atomes d’hélium ? b)-
Les atomes de néon ? 2)- Comment est
initiée l’émission stimulée ? 3)- Énergie : a)-
Au cours de quelle transition
des photons de longueur d’onde λ = 632,8 nm
sont-ils émis ? b)-
Quelle est l’énergie d’un photon
émis ? c)-
En déduire l’énergie du niveau
E3.
Données : 1 eV = 1,60
× 10–19
J ; h = 6,63
× 10–34
J.s :
c = 3,00
× 108
m . s–1 |
|
1)- Excitation
des atomes d’hélium et de néon : a)-
Les atomes d’hélium :
-
Ils sont excités par
« décharge électrique », ceci correspond à un apport
d’énergie électrique. b)-
Les atomes de néon :
-
Ils sont excités par
« collision » avec les atomes d’hélium excités, ceci
correspond à un apport d’énergie mécanique (énergie
cinétique). 2)- Initiation
de
l’émission stimulée :
-
« Des émissions
spontanées entre les niveaux d’énergie E4
et E3 amorcent des émissions stimulées
entre ces deux mêmes niveaux ». - L’émission stimulée est initiée par des photons émis spontanément par des atomes de néon excités
qui effectuent une transition
énergétique du niveau E4 vers le
niveau E3.
3)- Énergie : a)-
Transition des photons de
longueur d’onde λ = 632,8 nm :
-
Partie du diagramme
énergétique :
-
Les photons de longueur
d’onde λ = 632,8 nm sont émis lors de transitions
énergétiques du niveau d’énergie E4
vers le niveau d’énergie E3
b)-
Énergie d’un photon émis :
-
E = ΔE = E4
– E3 = h .
ν
-
c)-
Valeur de l’énergie du niveau
E3.
-
E = ΔE = E4
– E3 = 1,96 eV
-
E3 =
E4 – E
-
E3 =
20,66 – 1,96
-
E3 =
18,7 eV |
IX-
Exercice 26 page 394 : Les alcools en
spectroscopie.
|
Le groupe hydroxyle est caractéristique des alcools. Ce groupe peut être mis en
évidence par des tests chimiques, mais aussi par
spectroscopie. 1)- Lorsqu’un alcool absorbe un photon de longueur d’onde convenable, il peut y avoir une transition entre deux
niveaux d’énergie électronique. a)-
Définir le groupe hydroxyle. b)-
Représenter le schéma illustrant
cette transition énergétique. c)-
À quel domaine spectral
correspond une telle transition ? d)- Confirmer cette prévision en calculant la longueur d’onde du photon associé à cette transition sachant que, dans le cas du méthanol, les
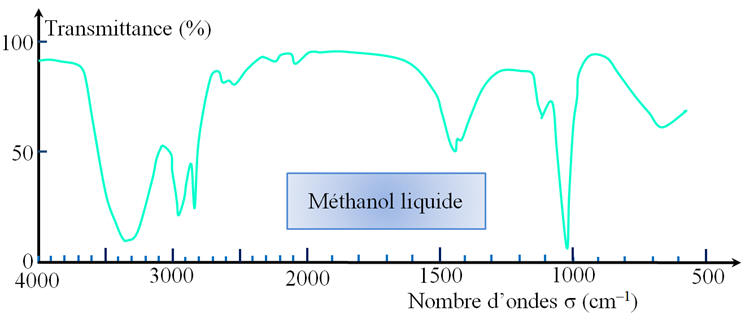
deux niveaux d’énergie sont séparés de 7,02 eV. 2)- Il est aisé de repérer la présence d’un groupe hydroxyle sur un spectre infrarouge d’alcool pur. Un signal large et intense est observé pour un nombre d’onde compris entre 3200 cm–1 et 3600 cm–1. Les alcools présentent aussi un signal intense, mais plus fin, repérable entre 1000 cm–1 et 1200 cm–1 et caractéristique de la liaison carbone-oxygène.
Cliquer sur
l'image pour l'agrandirr a)-
Quelles sont, pour le méthanol,
les longueurs d’onde dans le vide des photons
correspondant aux deux transitions décrites ? b)-
Quelle est la nature des
transitions énergétiques correspondant à ces signaux ? c)-
Comparer les énergies mises en
jeu dans ces deux transitions.
Données : 1 eV = 1,60
× 10–19
J ; h = 6,63
× 10–34
J.s :
c = 3,00
× 108
m . s–1
Rappel :
Le nombre
d’ondes σ est l’inverse de la longueur d’onde
λ. |
|
1)- Transition
entre deux niveaux d’énergie électronique. a)-
Définition du groupe hydroxyle :
-
Le groupe hydroxyle est
le groupe – OH
-
On appelle alcool tout
composé organique possédant un groupe hydroxyle – OH
lié à un atome de carbone tétragonal
-
L’atome de carbone lié au
groupe hydroxyle est appelé : atome de carbone
fonctionnel
-
Formule générale d’un
alcool : R – OH
-
Formule semi-développée
du méthanol : CH3 – OH b)-
Schéma illustrant cette
transition énergétique :
-
Elle correspond à
l’absorption d’un photon :
c)-
Domaine spectral correspond une
telle transition :
d)-
Longueur d’onde du photon
associé :
-
-
Application numérique :
-
-
La longueur d’onde : λ
< 400 nm. Cette radiation appartient au domaine des
U.V. 2)- Cas du
méthanol : a)-
Longueurs d’onde dans le vide
des photons correspondant aux deux transitions
décrites :
-
Pour la liaison O
– H :
-
La liaison O –
H se manifeste par une bande d’absorption forte et
large de 3200 cm–1à 3600 cm–1.
-
Valeur correspondante du
nombre d’ondes : Cliquer sur l'image pour l'agrandirr
-
-
Pour la liaison C – O :
-
La liaison C –
O se manifeste par une bande d’absorption forte et
fine de 1000 cm–1 à 1100 cm–1.
-
Valeur correspondante du
nombre d’ondes : Cliquer sur l'image pour l'agrandirr
-
b)-
Nature des transitions
énergétiques correspondant à ces signaux :
-
Lorsqu’un photon est
absorbé par une molécule, il y a transition entre deux
niveaux d’énergie de vibrations. c)-
Énergies mises en jeu dans ces
deux transitions : Comparaison.
-
De la relation suivante :
-
L’écart énergétique entre
les niveaux d’énergie de vibrations est inversement
proportionnel à la longueur d’onde du photon. - On remarque que λO–H < λC–O, on en déduit que l’écart énergétique est plus important
pour la liaison O – H
que pour la liaison C – O. |
X-
Exercice 27 page 394-395 : Valse laser à trois ou
quatre temps.
|
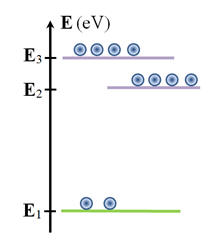
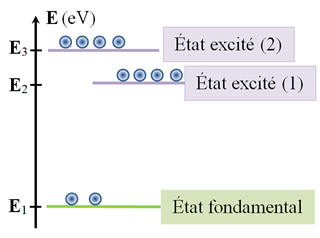
Le fonctionnement d’un laser à trois niveaux peut être illustré par le diagramme énergétique ci-dessous où la transition du niveau
E3
au niveau E2
est spontanée et rapide.
1)- Repérer les
états fondamental et excités de cette population
d’atomes. 2)- Transitions
électroniques : a)-
À quelles transitions sont
associées l’étape de pompage optique pour l’inversion de
population et l’étape d’émission stimulée. b)-
Recopier le schéma et
représenter ces transitions par des flèches. 3)- L’inconvénient de ce type de laser est l’entretien permanent de l’inversion de population : un grand nombre d’atomes doit être excité afin que le niveau (2) reste plus peuplé que le niveau (1). Il peut y avoir surchauffe lors du fonctionnement continu d’un tel laser. Dans un laser à quatre niveaux, l’émission stimulée ramène les atomes dans un état intermédiaire (1’), initialement non peuplé. Puis spontanément et rapidement a lieu une transition (1’) → (1) si bien que ce niveau (1’) reste quasiment toujours non peuplé. Ainsi, toute population de l’état (2) correspondra à une inversion de population de l’état (1’) sans que l’on soit en permanence obligé de dépeupler le niveau (1). Représenter le diagramme énergétique correspondant à ce
type de laser. 4)- Symboliser
par des flèches la transition laser et la transition
permanente permettant de maintenir l’inversion de
population autrement que par pompage optique. 5)- Quel
avantage offre ce fonctionnement à quatre niveaux par
rapport au fonctionnement à trois niveaux ? |
|
1)- État
fondamental et les états excités de cette population
d’atomes.
-
Diagramme énergétique:
-
L’état fondamental est
l’état dont l’énergie est la plus basse (état d’énergie
E1).
-
Les autres états sont les
états excités. 2)- Transitions
électroniques : a)-
Transitions électroniques et
l’étape de pompage optique et l’étape d’émission
stimulée.
-
Le pompage optique :
-
Lors du pompage optique,
on réalise la transition du niveau d’énergie E1
au niveau d’énergie E3.
-
Émission stimulée :
-
Lors de l’étape de
l’émission stimulée il s’effectue la transition du
niveau d’énergie E2 au niveau
d’énergie E1. b)-
Schéma des transitions
électroniques.
-
Diagramme énergétique :
3)- Diagramme
énergétique correspondant au laser à 4 niveaux :
-
Le niveau d’énergie (1’)
est intermédiaire des niveaux d’énergie E1
et E2.
4)- Transition
laser et la transition permanente permettant de
maintenir l’inversion de population :
-
Transition du niveau
d’énergie E2 au niveau d’énergie E1’ :
-
Transition laser : flèche
rouge.
-
Transition maintenant
l’inversion de population autrement que par pompage
optique :
-
Flèche verte : niveau
d’énergie E1’ au niveau d’énergie E1. Transition
rapide et spontanée. 5)- Avantage du
laser à quatre niveaux par rapport au laser à trois
niveaux :
-
Le pompage optique :
-
Lors du pompage optique,
on réalise la transition du niveau d’énergie E1
au niveau d’énergie E3. - Cette transition peut se faire par impulsions (laser à impulsions).
- Ainsi entre
les différentes impulsions, le système à le temps de
refroidir et évite ainsi la surchauffe. |
XI-
Exercice 28 page 395 : Effet
photoélectrique.
|
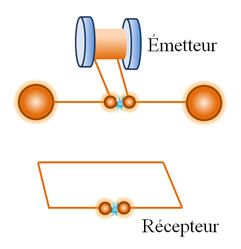
En 1887, le physicien allemand H. Hertz met au point un oscillateur hautes fréquences. Grâce à des étincelles produites entre deux petites
sphères en laiton très proches, le dispositif émet des
ondes électromagnétiques. H. Hertz réceptionne à quelques mètres de là ces ondes à l’aide d’un fil conducteur en forme de boucle ou de rectangle ouvert avec également
deux boules de laiton à chacune de ses extrémités.
Il observe des étincelles de faible
intensité lumineuse entre les boules de laiton du
récepteur. Cette expérience couronne la
théorie de l’Écossais J.C. Maxwell établie en 1865 sur
le comportement ondulatoire des ondes
électromagnétiques. Afin de mieux voir les étincelles au niveau du récepteur, H. Hertz place le récepteur dans l’obscurité. Il constate alors que l’intensité lumineuse des étincelles est encore plus faible. Il en déduit que la lumière émise par les étincelles de l’émetteur, plus
précisément les rayonnements ultraviolets, a un impact
sur les étincelles du récepteur. H. Hertz vient de mettre en
évidence l’effet photoélectrique. Dans les années qui suivent l’expérience de H. Hertz, différents travaux consistent à éclairer un métal par un rayonnement ultraviolet. On
obtient les résultats suivants :
-
Les rayonnements
ultraviolets arrachent des particules négatives que l’on
appellera des électrons.
-
Le nombre d’électrons
arrachés est proportionnel à l’intensité lumineuse du
rayonnement.
-
L’énergie cinétique des
électrons arrachés est indépendante de l’intensité
lumineuse du rayonnement.
-
L’énergie cinétique
augmente lorsque la fréquence de la lumière incidente
augmente. En 1905, pour expliquer l’effet
photoélectrique, A. Einstein propose un aspect
particulaire pour la lumière. Chaque particule possède une
énergie E = h .
υ. Cette
particule sera appelée photon quelques années plus tard.
A. Einstein
explique que l’énergie du photon sert en partie à
arracher l’électron de l’atome, le reste étant emporté
par l’électron sous forme d’énergie cinétique. Ce résultat sera démontré expérimentalement par le physicien américain R. Millikan (1868–1953) onze ans plus tard et la communauté
scientifique mettra quelques années de plus à accepter
la notion d’aspect particulaire de la lumière. En
1921, A. Einstein obtiendra le prix Nobel de physique
pour cette découverte. 1)- En quoi la
formule E = h . υ. illustre les
aspects ondulatoire et particulaire de la lumière ? 2)- Traduire, par une formule mathématique, la phrase écrite en italique. On appellera E1 l’énergie nécessaire pour arracher un électron. Pour un métal
donné cette énergie est constante. 3)- Pourquoi
l’énergie cinétique d’un électron augmente-t-elle
lorsque la fréquence de la lumière incidente augmente ? 4)- L’énergie E1 permettant d’arracher un électron d’un atome de cuivre vaut : E1 (Cu) = 4,70 eV. Quelle est la longueur d’onde de la radiation permettant d’arracher un électron d’un atome de cuivre avec une valeur de vitesse nulle ? Mettre en relation ce résultat
et les observations expérimentales décrites dans le
texte. 5)- On observe que l’effet photoélectrique ne se produit pas pour des radiations incidentes situées dans le visible et dans les infrarouges quelles que soient l’intensité du
rayonnement et la durée d’exposition. Pourquoi ce
résultat met-il en défaut la théorie ondulatoire ?
Données : 1 eV = 1,60
× 10–19
J ; h = 6,63
× 10–34
J.s :
c = 3,00
× 108
m . s–1 |
|
1)- Aspects
ondulatoire et particulaire de la lumière ;
-
La formule : E =
h . υ met en évidence l’aspect ondulatoire
et l’aspect particulaire de la lumière.
-
L’aspect ondulatoire de
la lumière est lié à la fréquence υ de l’onde
lumineuse.
-
L’aspect particulaire est
lié au quantum d’énergie E du photon.
-
L’énergie d’une onde
électromagnétique monochromatique est égale à un nombre
entier de fois celle d’un photon. 2)- Traduction,
par une formule mathématique, de la phrase écrite en
italique.
-
E1
représente l’énergie nécessaire pour arracher un
électron.
-
EC
représente l’énergie cinétique d’un électron.
-
E = E1
+ EC 3)- Énergie
cinétique et fréquence de la lumière incidente :
-
La grandeur E1
est caractéristique de l’atome utilisé (dans le cas
présent c’est l’atome de cuivre Cu).
-
L’énergie E1
nécessaire pour arracher un électron d’un atome de
cuivre, Cu, est constante.
-
Si la fréquence de la
lumière incidente augmente, alors υ ↑ et E ↑.
-
Comme E1
= cte, alors l’énergie cinétique des
électrons arrachés aux atomes augmente, Ec ↑. 4)- Longueur
d’onde de la radiation permettant d’arracher un électron
d’un atome de cuivre avec une valeur de vitesse nulle.
-
E1 (Cu)
= 4,70 eV et EC = 0 eV
-
E = h .
υ = E1 (Cu) = 4,70 eV
-
-
Application numérique :
-
-
λ
< 400 nm, cette
radiation appartient au domaine des U.V. 5)- Effet
photoélectrique et énergie :
-
Un rayonnement visible
est moins énergétique qu’un rayonnement
U.V. - Même si on augmente l’intensité du rayonnement visible et la durée d’exposition, on n’arrive pas à arracher
un électron
alors que l’énergie est suffisante.
-
Alors que la théorie
ondulatoire de la lumière prévoit que cela est possible.
-
Ceci n’est pas confirmé
de façon expérimentale.
-
D’où la dualité
onde-corpuscule pour la lumière. |
|
|