|
|
|
|
La lumière des étoiles |
|
|
|
Exercices :
énoncé avec correction a)-
Exercice 3 : Associer couleur et longueur d’onde. b)-
Exercice 5 : Du spectre au montage. c)-
Exercice 7 : Spectre du lithium. d)-
Exercice 9 : Profil spectral d’une étoile. e)-
Exercice 13 : Sources lumineuses et spectres. f)-
Exercice 14 : Loi de Wien g)- Exercice
17 : Oh, be a fine girl, kiss me. |
|
I- Exercice 10
page 33. Comparer des spectres. II- Exercice 18
page 34. Associer à chaque étoile sa température. III- Exercice
23 page 36. L’étoile Véga. IV- Exercice 27
page 37. Prendre la température d’une étoile. |
I- Lumière monochromatique et lumière polychromatique.
1)- Expérience de Newton (1642 – 1727).
![]() Expérience :
Expérience :
- On éclaire une fente avec une lumière blanche et on envoie le faisceau obtenu sur la face d’un prisme.
- Observations :
- La lumière est déviée par le prisme.
- De plus le faisceau qui émerge du prisme est étalé et présente les différentes couleurs de l’arc-en-ciel
- (rouge, orange, jaune, vert, bleu, indigo, violet).
- La lumière rouge est moins déviée que la lumière violette.
- Conclusion :
- Le prisme dévie et décompose la lumière blanche en lumières colorées du rouge au violet.
- C'est un phénomène de dispersion.
- L'ensemble des couleurs obtenues constitue le spectre de la lumière blanche.
- Le spectre est continu du rouge au violet.
- La lumière blanche est constituée de plusieurs couleurs ou radiations : c’est une lumière polychromatique.
- Arc en Ciel :

2)- Expérience avec la lumière émise par un Laser.
![]() Expérience :
Expérience :
- On éclaire une fente avec un faisceau laser et on envoie le faisceau obtenu sur la face d’un prisme.
- Observation :
- Le faisceau laser est dévié et le spectre ne comporte qu’une seule couleur, la couleur rouge initiale.
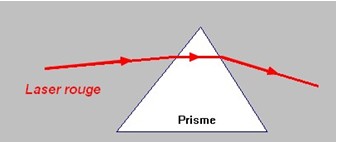
- Conclusion :
- La lumière produite par un laser est constituée d’une seule radiation, elle est monochromatique.
3)- Radiation et longueur d’onde.
- Une lumière monochromatique ne peut être décomposée par un prisme.
- C’est une radiation lumineuse qui est caractérisée par sa longueur d’onde λ (lambda) dans le vide ou l’air.
- Son unité légale est le mètre (m).
- Le laser rouge utilisé au lycée est une radiation de longueur d’onde λ = 633 nm.
- C’est une lumière monochromatique.
|
Une radiation lumineuse est caractérisée par :
- Sa fréquence ν (en Hz)
ou sa période T (en s).
- Sa longueur d’onde
dans le vide λ0. - Remarque : - La fréquence d’une radiation lumineuse ne dépend pas du milieu de propagation
alors
que la longueur d’onde dépend du milieu de propagation. |
![]() Relation fondamentale :
Relation fondamentale :
- La longueur d’onde
dans le vide d’une radiation lumineuse est donnée par la relation :
- 
- Remarque : pour les
radiations lumineuses, on préfère utiliser la lettre grecque ‘’nu’’.
- De manière générale,
on caractérise une radiation lumineuse par sa longueur d’onde dans le vide.
- Complément : l’œil
humain n’est sensible qu’à certaines radiations lumineuses.
- Le domaine de
radiations lumineuses visibles s’étend de 400 nm (violet) à 800 nm (rouge).
- Remarque : une lumière complexe ou polychromatique est un mélange de plusieurs radiations.
- Elle n’est pas caractérisée par une longueur d’onde.
- On lui associe une plage de longueurs d’onde.
- L’œil humain n’est sensible qu’aux radiations dont les longueurs d’onde sont comprises entre 400 nm et 800 nm.
- La lumière blanche est un mélange de toutes les radiations visibles par l’œil humain.
II- Lumière émise et température d’une source. Les messages de la lumière
1)- Analyse de la lumière émise par une lampe (6 V)
![]() Montage :
Montage :
- Brancher la lampe aux bornes du générateur (alimentation ajustable).
- Régler la tension sur zéro puis mettre le générateur sous tension.
- Augmenter la tension tout en observant avec le spectroscope la lumière émise par la lampe.
- Attention : ne pas dépasser 6V.
2)- Observations et conclusion.
- Quelle influence a la variation de tension
sur la lampe ?
- Lorsque la tension augmente, l’éclat de la lampe augmente aussi.
- Au départ, la lumière est jaune puis devient blanche.
- Quelle est la conséquence de cette variation
sur les spectres observés ?
- Le spectre devient plus lumineux et il s’étale vers le bleu et le violet.
- De quelle grandeur physique dépend ces changements ?
- Le spectre d’un corps incandescent dépend de la température de ce corps.
- Plus le corps est chaud et plus le spectre s’étend vers le violet.

- La température du filament de la lampe à incandescence est d'autant plus élevée que le spectre de la lumière qu'il émet, s'étale vers le jaune, le vert, le bleu et le violet.
- Le spectre de la lumière émise par un corps chaud dépend de sa température.
III- Spectres d’émission et d’absorption d’une entité chimique. Les messages de la lumière 02.
a)- Expérience :
![]() On analyse à l’aide du spectroscope la lumière émise par une
lampe à vapeur de mercure puis une lampe à vapeur de sodium.
On analyse à l’aide du spectroscope la lumière émise par une
lampe à vapeur de mercure puis une lampe à vapeur de sodium.
- La lampe à vapeur de mercure contient des atomes de mercure (Hg) sous faible pression.
- Ces atomes subissent des décharges électriques et sont excités.
- La lampe à vapeur de sodium contient des atomes de sodium (Na).
- Eux aussi subissent des décharges électriques et sont excités.
- Spectre de la lampe à vapeur de mercure :
- Longueurs d’ondes (les plus visibles) :
615 nm, 580 nm, 579 nm, 577 nm, 546 nm, 492 nm, 436 nm,
405 nm (que l’on devrait voir)
Cliquer sur l'image pour l'agrandir
-
Le doublet du sodium : radiations jaunes
de longueur d’onde voisine de 590 nm (en réalité, il s’agit d’un doublet :
589,0 nm et 589,6 nm)
b)- Conclusion :
- Le spectre d’émission d’une entité chimique est constitué de raies colorées sur fond noir.
- On est en présence d’un spectre de raies.
a)- Visualisation du tableau des spectres de raies d’absorption.
- Un spectre d’absorption est un spectre obtenu en analysant la lumière blanche qui a traversé une substance.
|
- LOI DE KIRCHHOFF : - Un gaz froid, à basse pression, s’il est situé entre l’observateur et une source de rayonnement continu, absorbe certaines longueurs d’onde (ou ‘’couleurs’’), produisant ainsi des raies (ou bandes) sombres dans le spectre continu. - Ces longueurs d’onde sont celles qu’il émettrait s’il était chaud. - Un gaz, à basse pression et à basse température, traversé par une lumière blanche, donne un spectre d’absorption. - Ce spectre est constitué de raies noires se détachant sur le fond coloré du spectre de la lumière blanche. - Ce spectre est caractéristique de la nature chimique d’un atome ou d’un ion. |
- Cas de l’Hydrogène :
- Spectre d’émission :
Cliquer sur l'image pour l'agrandir
- Spectre d’absorption :
Cliquer sur l'image pour l'agrandir
b)- Conclusions :
- Une entité chimique ne peut absorber que les radiations qu’elle est capable d’émettre.
- Les raies d’émission ou d’absorption permettent d’identifier une entité chimique présente dans un gaz.
- Exemples :
- Lampe à vapeur de mercure :
Cliquer sur l'image pour l'agrandir
c)- Quelques spectres d’émission.
https://physique.ostralo.net/spectre_em_abs/
Cliquer sur l'image pour l'agrandir
IV- Applications à l’Astrophysique.
1)- Analyse spectrale de la lumière émise par une étoile.
- Document : Extrait du spectre visible du Soleil :
Cliquer sur l'image pour l'agrandir
- La surface chaude des étoiles émet une lumière dont le spectre est continu.
- Certaines radiations de cette lumière blanche traversant l’atmosphère de l’étoile sont absorbées par les atomes qui y sont présents.
- On obtient le spectre d’absorption de l’étoile.
- La couleur de l’étoile permet de déterminer sa température de surface.
2)- Profil spectral d’une étoile :
- Document : Profil spectral de la lumière émise par le Soleil :
Cliquer sur l'image pour l'agrandir
- Le profil spectral d’une étoile est la courbe qui représente l’intensité lumineuse des radiations émises par cette étoile en fonction de la longueur d’onde.
- Les entités chimiques présentes dans l’atmosphère du Soleil absorbent certaines radiations lumineuses.
- Ceci se traduit par l’apparition de raies sombres dans le spectre de la lumière émise par le Soleil et par des minima d’intensité lumineuse dans le profil spectral.
- Les longueurs d’onde correspondantes permettent d’identifier les entités chimiques présentes dans l’atmosphère du Soleil.
- La température de surface du Soleil a une influence sur l’allure globale du profil spectral.
- La longueur d’onde du maximum d’intensité lumineuse est notée λmax.
- La valeur de λmax diminue lorsque la température de surface de l’étoile augmente.
- Une étoile bleue est plus chaude qu’une étoile rouge.
- Le profil spectral de la lumière émise par le Soleil permet de déterminer la valeur de λmax.
- λmax = 480 nm.
- Cette valeur permet de déterminer la valeur de la température de la surface du Soleil.
- Cette température est voisine de 5700 °C. Loi De Wien 01. Loi De Wien 02. Loi de Wien 03.
-
|
Loi de WIEN : Une étoile de température θ (en °C) émet une lumière dont le spectre présente un maximum d’intensité pour la longueur d’onde λ max (en nm). Ces deux grandeurs sont liées par la relation :
|
- D’autre part, les minima d’absorption montrent que l’atmosphère du Soleil contient essentiellement de l’hydrogène et de l’hélium.
- L’analyse de la lumière provenant d’une étoile permet de connaitre :
- Sa température de surface
- La composition chimique de son atmosphère.
a)- Détermination des longueurs d’onde de certaines raies d’absorption dans une partie du spectre du Soleil
|
« dès 1814, le physicien allemand Fraunhofer remarque la présence de raies noires dans le spectre du Soleil. Kirchhoff mesure la longueur d’onde de plusieurs milliers de ces raies et montre qu’elles coïncident avec celles émises par diverses entités chimiques : hydrogène, calcium, cuivre, fer, zinc, … Il publie, en 1861, le premier atlas du système Solaire. » - Le document fourni, représente : - En noir et blanc, un extrait du spectre visible du Soleil. - Les principales raies d’absorption (repérées par un numéro) sont représentées par un trait noir. - Un extrait du spectre de raies de l’argon obtenu avec le même spectroscope. - Ces raies servent de référence de longueur d’onde. - Le but de l’exercice est de déterminer les longueurs d’onde de certaines raies d’absorption dans une partie du spectre du Soleil. - On va identifier certaines entités chimiques présentes dans la chromosphère, enveloppe gazeuse qui entoure le Soleil. |
- Document en couleur :
Cliquer sur l'image pour l'agrandir
- Les deux spectres ont été obtenus avec le même spectroscope à réseau.
- Dans ce cas, la distance entre deux raies, mesurée sur le spectre, est proportionnelle à la différence entre les longueurs d’onde correspondantes.
b)- Exploitation du document.
- Étude du spectre de l’argon.
![]() Mesurer la distance
L, en mm, entre la raie d’émission
de 390 nm et les autres raies d’émission.
Mesurer la distance
L, en mm, entre la raie d’émission
de 390 nm et les autres raies d’émission.
![]() Compléter le tableau 1 :
Compléter le tableau 1 :
|
Longueur d’onde λ en nm |
390 |
404 |
430 |
451 |
470 |
519 |
545 |
|
Distance L en mm |
0 |
14,5 |
43,5 |
67 |
88,5 |
142,5 |
172,5 |
- Étude du spectre du Soleil.
![]() Mesurer les distances
L, en mm, entre la
raie d’émission de 390 nm et les différentes raies d’absorption du spectre
du Soleil.
Mesurer les distances
L, en mm, entre la
raie d’émission de 390 nm et les différentes raies d’absorption du spectre
du Soleil.
Remplir la ligne correspondante du tableau 2.
|
Numéro |
1
|
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
Distance L
en
mm |
3 |
6,5 |
22 |
35 |
48,5 |
53 |
85 |
106,5 |
|
Longueur
d’onde λ
en
nm |
|
|
|
|
|
|
|
|
|
Numéro |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
|
Distance
L
en
mm |
113 |
117 |
120 |
140,5 |
151,5 |
158,5 |
163 |
|
Longueur
d’onde
λ
en
nm |
|
|
|
|
|
|
|
c)- Questions.
![]() Que représentent les raies noires dans le spectre du Soleil de Fraunhofer ?
Que représentent les raies noires dans le spectre du Soleil de Fraunhofer ?
- L’atmosphère du Soleil contient des éléments chimiques.
- La partie haute de l’atmosphère absorbe une partie de la lumière émise dans la partie basse.
- Il en résulte des raies d’absorption dans le spectre continu.
- Ce sont les raies d’absorption des éléments chimiques présents dans l’atmosphère du Soleil.
- Si le Soleil ne comportait pas d’atmosphère, le spectre de la lumière émise serait continu.
- L’existence des raies d’absorption est due à la présence d’une atmosphère autour du Soleil, appelée chromosphère.
- Le gaz présent est principalement de l’hydrogène.
- On trouve aussi des ions He+, Ca2+, Fe2+, …
- La partie haute de l’atmosphère absorbe une partie de la lumière émise dans la partie basse.
![]() Quel est l’intérêt des travaux de Fraunhofer et de Kirchhoff ?
Quel est l’intérêt des travaux de Fraunhofer et de Kirchhoff ?
- Les travaux de Fraunhofer et Kirchhoff ont permis de connaître la composition de l’atmosphère du Soleil.
- Un spectre d’émission ou d’absorption est caractéristique des atomes ou des ions.
- Un spectre de raies d’émission ou d’absorption permet d’identifier une entité chimique (atome ou ion).
- C’est sa carte d’identité, sa signature.
![]() À quoi sert le spectre de l’argon ?
À quoi sert le spectre de l’argon ?
- Le spectre de l’argon sert de référence.
- Il permet de connaître la relation λ = f (L).
![]() Expliquer la différence de nature qui existe entre les deux
spectres.
Expliquer la différence de nature qui existe entre les deux
spectres.
- Le spectre de l’argon est un spectre de raies d’émission.
- Le spectre de la chromosphère est un spectre d’absorption.
![]() Tracer sur papier millimétré, le graphique donnant la longueur d’onde
λ en fonction de
L
pour les raies d’émission de l’argon.
Tracer sur papier millimétré, le graphique donnant la longueur d’onde
λ en fonction de
L
pour les raies d’émission de l’argon.
En déduire une relation simple entre ces deux grandeurs.
|
Longueur d’onde λ en nm |
390 |
404 |
430 |
451 |
470 |
519 |
545 |
|
Distance L en mm |
0 |
14,5 |
43,5 |
67 |
88,5 |
142,5 |
172,5 |
- λ (nm) ≈ 0,90 L (mm) + 390
![]() Compléter la dernière ligne du tableau 2.
Compléter la dernière ligne du tableau 2.
|
Numéro |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
|
Distance L en mm |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Longueur d’onde λ en nm |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Numéro |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
Distance
L
en
mm |
3 |
6,5 |
22 |
35 |
48,5 |
53 |
85 |
106,5 |
|
Longueur d’onde
λ en
nm |
363,3 |
396,5 |
410,4 |
422,1 |
434,2 |
438,2 |
466,5 |
486,2 |
|
363 |
397 |
410 |
422 |
434 |
438 |
467 |
486 |
|
Numéro |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
|
Distance
L
en
mm |
113 |
117 |
120 |
140,5 |
151,5 |
158,5 |
163 |
|
Longueur d’onde
λ en
nm |
492,1 |
495,7 |
498,4 |
516,8 |
526,6 |
532,9 |
537 ,0 |
|
492 |
496 |
498 |
517 |
527 |
533 |
537 |
![]() À partir des données figurant dans le tableau ci-dessous, associer
à chaque raie d’absorption l’élément chimique présent dans l’atmosphère
du Soleil.
À partir des données figurant dans le tableau ci-dessous, associer
à chaque raie d’absorption l’élément chimique présent dans l’atmosphère
du Soleil.
|
Élément chimique |
Longueurs d’onde λ en nm de certaines raies caractéristiques |
||||||
|
H |
410,3 |
434,2 |
484,1 |
556,3 |
|
|
|
|
Na |
589,0 |
589,6 |
|
|
|
|
|
|
Mg |
470,3 |
516,7 |
|
|
|
|
|
|
Ca |
396,8 |
422,7 |
458,2 |
526,2 |
527,0 |
|
|
|
Fe |
438,3 |
489,1 |
491,9 |
495,7 |
532,8 |
537,1 |
539,7 |
|
Ti |
466,8 |
469,1 |
498,2 |
|
|
|
|
|
Mn |
403,6 |
|
|
|
|
|
|
|
Ni |
508,0 |
|
|
|
|
|
|
Document.
Cliquer sur l'image pour l'agrandir
3)- Exercices : 3, 5, 7, 9, 13, 14, 17. Exercices : énoncé avec correction
a)- Exercice 3 : Associer couleur et longueur d’onde.
b)- Exercice 5 : Du spectre au montage.
c)- Exercice 7 : Spectre du lithium.
d)- Exercice 9 : Profil spectral d’une étoile.
e)- Exercice 13 : Sources lumineuses et spectres.
f)- Exercice 14 : Loi de Wien
g)-
Exercice 17 : Oh,
be a fine girl, kiss me.
|
|