|
|
Les messages de la lumière |
|
|
|
|
|
Objectifs : Réaliser
divers spectres lumineux, les comparer, les classer et en déduire
des informations sur la température
et la composition d’un
objet inaccessible (étoile, nébuleuse,..) |
Matériel :
|
Matériel |
Rétroprojecteur, projecteur de
diapositives, réseaux, spectroscopes de poche, lampes à vapeur
de mercure et de sodium, lampe cadmium, nickel, zinc. Générateurs,
lampes de 12 V (pour 8 groupes), bec bunsen, pulvérisateurs, solution de
permanganate de potassium (0,01 mol / L), solution de
chlorure de sodium, solution de sulfate de cuivre II, solution de
chlorure de calcium, chlorure de baryum, solution de
colorant jaune, solution de colorant bleu, seringues. |
I-
Dispersion de la lumière blanche.
1)- Dispersion de la lumière blanche par un prisme.
![]() Placer un prisme sur le trajet de la
lumière provenant d’une lampe à incandescence.
Placer un prisme sur le trajet de la
lumière provenant d’une lampe à incandescence.
![]() Observer et dessiner le spectre en
indiquant les différentes couleurs.
Observer et dessiner le spectre en
indiquant les différentes couleurs.
-
Le prisme dévie
et décompose la lumière blanche en lumières colorées du rouge au violet.
-
C'est un
phénomène de dispersion.
-
L'ensemble des
couleurs obtenues constitue le spectre de la lumière blanche.
-
Le spectre est continu
du rouge au violet.
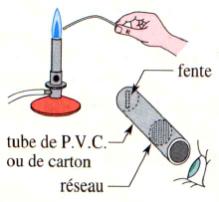
2)- Dispersion de la lumière par un réseau.
-
Un réseau est constitué d'un film
transparent sur lequel on a gravé des traits parallèles, équidistants et très
fins ( exemple le réseau noté : 580 : on a gravé 580 traits par millimètre).
![]() Observer et dessiner le spectre obtenu.
Observer et dessiner le spectre obtenu.
-
Un réseau
décompose la lumière blanche. Il dévie plus le rouge que le violet.
-
Spectres : ils
sont situés de part et d’autre de la fente centrale.
3)- Comparaison.
-
Quels sont les points communs et les
différences entre les deux spectres ?
-
On obtient des
spectres continus constitués des mêmes radiations.
-
Le prisme dévie
plus le violet que le rouge et le réseau dévie plus le rouge que le violet.
-
Un spectre d’émission est un spectre
produit par la lumière directement émise par une source.
1)- Spectre continu d’origine thermique.
a)-
Analyse de la lumière émise par une lampe (6
V)
![]() Montage : brancher la lampe aux bornes
du générateur (alimentation ajustable).
Montage : brancher la lampe aux bornes
du générateur (alimentation ajustable).
-
Régler la tension sur zéro puis mettre
le générateur sous tension.
-
Augmenter la tension tout en observant
avec le spectroscope la lumière émise par la lampe.
-
Attention : ne pas dépasser 6V.
![]() Observations et conclusion.
Observations et conclusion.
-
Quelle influence a la variation de
tension sur la lampe ?
-
Lorsque la
tension augmente, l’éclat de la lampe augmente aussi.
-
Au
départ, la lumière est jaune puis devient blanche.
-
Quelle est la conséquence de cette
variation sur les spectres observés ?
-
Le spectre
devient plus lumineux et il s’étale vers le bleu et le violet.
-
De quelle grandeur physique dépend ces
changements ?
-
Le spectre d’un
corps incandescent dépend de la température de ce corps.
-
Plus le corps
est chaud et plus le spectre s’étend vers le violet.

2)- Spectres de raies.
-
On analyse à l’aide du spectroscope la
lumière émise par une lampe à vapeur de mercure puis une lampe à vapeur de
sodium.
-
La lampe à vapeur de mercure contient
des atomes (Hg)
de mercure sous faible pression.
-
Ces atomes subissent des décharges
électriques et sont excités.
-
La lampe à vapeur de sodium contient
des atomes de sodium (Na).
-
Eux aussi subissent des décharges
électriques et sont excités.
![]() Représenter les différents spectres.
Les comparer. Quelle conclusion peut-on tirer ?
Représenter les différents spectres.
Les comparer. Quelle conclusion peut-on tirer ?
-
Spectre de la lampe à vapeur de
mercure :
-
longueurs d’ondes (les plus visibles) :
-
615 nm, 580 nm, 579 nm, 577 nm, 546 nm,
492 nm, 436 nm, 405 nm (que l’on devrait voir)
-
Spectre de la lampe à vapeur de
sodium :
-
Le doublet du sodium : radiations
jaunes de longueur d’onde voisine de 590 nm
-
(en réalité, il s’agit d’un
doublet :589,0 nm et 589,6 nm)

3)- Les couleurs de flammes.
![]() Pulvériser sur une flamme non
éclairante d’un bec bunsen une solution contenant des ions sodium
Na+.
Pulvériser sur une flamme non
éclairante d’un bec bunsen une solution contenant des ions sodium
Na+.
-
Observer la couleur de flamme.
-
Reproduire l’expérience avec d’autres
solutions ioniques et indiquer chaque fois la couleur de flamme.
-
Représenter les résultats sous forme
d’un tableau.
![]() Conclusion.
Conclusion.
-
Quelques couleurs de flamme :
|
Couleurs émises par quelques composés lors de la combustion |
|||
|
Couleur |
Éléments |
Composés |
Formule |
|
Violet |
Potassium |
Nitrate de potassium |
KNO3 |
|
Bleu |
Cuivre |
Chlorure cuivreux |
CuCℓ |
|
Vert |
Baryum |
Nitrate de baryum |
Ba(NO3)2 |
|
Jaune |
Sodium |
Oxalate de sodium |
Na2C2O4 |
|
Orangé |
Calcium |
Nitrate de calcium |
Ca(NO3)2 |
|
Rouge |
Strontium |
Nitrate de strontium |
Sr(NO3)2 |
|
Baryum |
Calcium |
Cuivre |
Potassium |
Lithium |
Sodium |
Strontium |
-
Un spectre d’absorption est un spectre
obtenu en analysant la lumière blanche qui a traversé une substance.
1)- Spectres de raies d’absorption.
-
Visualisation du tableau des spectres
de raies d’absorption.
-
Spectre d'absorption et d'émission de
l'hydrogène :
-
Spectre d'absorption et d'émission de
l'hélium :
-
Spectre d'absorption et d'émission du
mercure :
-
Spectre d'absorption et d'émission du
néon :
-
Spectre d'absorption de l'argon :
-
Spectre d'absorption du cadmium :
-
Spectre d'absorption du calcium :
-
Un gaz, à basse
pression et à basse température, traversé par une lumière blanche, donne un
spectre d’absorption.
-
Ce spectre est
constitué de raies noires se détachant sur le fond coloré du spectre de la
lumière blanche.
-
Ce spectre est
caractéristique de la nature chimique d’un atome ou d’un ion.
2)- Spectres de bande d’absorption
![]() On analyse à l’aide d’un spectroscope
la lumière transmise à travers différentes solutions colorées.
On analyse à l’aide d’un spectroscope
la lumière transmise à travers différentes solutions colorées.
-
Placer dans l’orifice du spectroscope
les différentes solutions colorées
![]() Représenter les différents spectres et
conclure.
Représenter les différents spectres et
conclure.
-
Spectre
d’absorption de la solution jaune : rouge
– orange – jaune – vert : bande noire qui va du bleu au violet.
-
Spectre de
la solution bleue : jaune – vert – bleu –
violet : bande noire qui va du rouge à l’orange.
-
Spectre
de la solution violette : rouge – orange –
jaune – violet : bande noire qui va du vert au bleu.
IV-
Applications à l’Astrophysique.
-
La surface chaude des étoiles émet une
lumière dont le spectre est continu.
-
Certaines radiations de cette lumière
blanche traversant l’atmosphère de l’étoile sont absorbées par des atomes qui y
sont présents.
-
On obtient le spectre d’absorption de
l’étoile.
-
La couleur de l’étoile permet de
déterminer sa température de surface.
-
Le document suivant représente le
spectre de la lumière solaire.
a)-
Quel type de spectre donne la lumière émise
par le soleil ?
-
Le spectre de
la lumière émise par le soleil est un spectre continu qui va du rouge au violet.
b)-
Pourquoi l’atmosphère du
soleil
empêche-t-elle d’observer un spectre continu ?
-
L’atmosphère du
Soleil contient des éléments chimiques.
-
La partie haute
de l’atmosphère absorbe une partie de la lumière émise dans la partie basse.
-
Il en résulte
des raies d’absorption dans le spectre continu.
c)-
Qu’est-ce que la photosphère ? Quelle est sa
température ?
-
La photosphère est une fine couche de gaz de
-
Sa température
est voisine de 6000 ° C à 5500 ° C.
d)-
Qu’est-ce que la chromosphère ? Quelle est sa
température ?
-
On appelle
chromosphère l’atmosphère située autour du Soleil.
-
Son épaisseur est de l’ordre de
-
Cette atmosphère est constituée de gaz sous faible pression avec
des régions où la température atteint 104
° C.
e)-
Expliquer pourquoi la présence des raies
noires est liée à l’existence de la chromosphère.
-
Si le Soleil ne
comportait pas d’atmosphère, le spectre de la lumière émise serait continu.
-
L’existence des raies d’absorption est dû à la présence d’une atmosphère autour
du Soleil, appelée chromosphère.
-
Le gaz présent
est principalement de l’hydrogène.
-
On trouve aussi
des ions He+,
Ca2+,
Fe2+,
…
-
La partie haute
de l’atmosphère absorbe une partie de la lumière émise dans la partie basse.
f)-
Pourquoi l’étude des longueurs d’onde des
raies noires a-t-elle permis de connaître la composition de la chromosphère ?
-
Un spectre
d’émission ou d’absorption est caractéristique des atomes ou des ions.
-
Un spectre de
raies d’émission ou d’absorption permet d’identifier une entité chimique (atome
ou ion.
-
C’est sa carte
d’identité, sa signature.
g)-
Quels sont les deux éléments les plus
abondants (en fraction de masse) dans la composition chimique du Soleil ?
-
H,
He,
|
Température Moyenne ° C |
3000 |
5500 |
8000 |
10000 |
|
Couleur |
Rouge orangée |
Jaune |
Blanche |
bleutée |
|
Exemple |
Bételgeuse |
Le Soleil |
Sirius |
Rigel |
|
|