|
|
|
Phys. N° 15 |
Ouverture au monde quantique. Cours. |
|
|
Programme 2012 : Transferts quantiques d'énergie et dualité onde-corpuscule. Programme 2012 : Physique et Chimie Programme 2020 : Physique et Chimie |
| Exercices | |
Pour aller plus loin :
|
Mots clés : forces newtoniennes ; mécanique de Newton ; mécanique quantique ; niveaux d'énergie d'un atome ; ... |
I- Les forces newtoniennes.
- Les forces gravitationnelles et les forces électrostatiques ont leurs
valeurs proportionnelles en
![]() .
.
- Ce sont des forces newtoniennes.
2)- La force gravitationnelle.
|
- Deux corps ponctuels A et B de
masses respectives mA et mB exercent l’un sur l’autre des forces
d’attraction, directement opposées, dirigées suivant la droite (AB), de valeur proportionnelle aux masses et inversement proportionnelle au carré de leur
distance r. |
- Schéma :

- Expression vectorielle :
-

|
G est la
constante de gravitation Universelle :
G ≈ 6,67 × 10–11 m3. kg–1 . s–2 . |
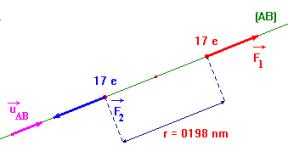
- Dans le vide, deux particules A et B, portant les charges électriques respectives qA et qB, séparées par la distance r sont soumises à deux forces directement opposées :
- ![]()
- Expression :
![]()
- Premier cas : on considère que : qA . qB > 0

- Deuxième cas : on considère que : qA . qB < 0

- Étude de l’expression :
![]()
-
![]() : vecteur unitaire :
direction droite
(AB) et sens de
A
vers B.
: vecteur unitaire :
direction droite
(AB) et sens de
A
vers B.
- k : constante

- r : distance séparant les deux charges électriques en mètre m.
- F : force électrique en Newton N.
- Application : la molécule de dichlore.
- Force d’interaction électrique entre les noyaux :
-
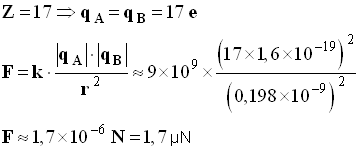
- échelle : 1 cm ↔ 1 N
4)- Analogies et différences avec les forces de gravitation.
- Analogies : les forces électriques et les forces de gravitation, sont :
- Proportionnelles aux grandeurs qui les créent
- Et inversement proportionnelle au carré de la distance.
- Différences :
- Les forces de gravitation sont toujours attractives alors que les forces électriques sont attractives ou répulsives.
- À l’échelle macroscopique les forces électriques sont négligeables devant les forces de gravitation,
- À l’échelle microscopique les forces de gravitation sont négligeables par rapport aux forces électriques.
- Attention : Pour la valeur de la force : les charges sont des grandeurs algébriques.
- Pour ne pas avoir de problème :
- il
faut écrire :
![]() et pour l’expression vectorielle :
et pour l’expression vectorielle :
![]() .
.
5)- Mouvement d’un corps soumis à ce type de forces.
a)- Exemple 1.
- Considérons un corps
T
de masse respectives
mT et un corps S
de masse mS avec : mT >>
mS.
- On étudie le mouvement de S par rapport à T dans le référentiel galiléen lié à T.
- Dans cet exemple T peut représenter la Terre et S un satellite de la Terre.
- Le satellite S est soumis à une force gravitationnelle exercée par la Terre T.
- cette force est orientée vers le centre de la Terre, c’est une force centripète.
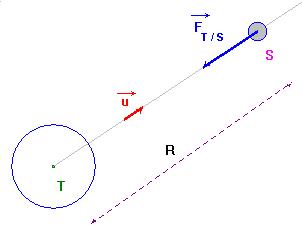
- Le mouvement du corps S est soit circulaire, elliptique ou hyperbolique.
- Cela dépend de la vitesse du satellite dans le référentiel d’étude.
b)- Exemple 2.
- Considérons un proton P (charge e) et un électron E (charge – e).
- On étudie le mouvement de E par rapport à P dans un référentiel galiléen lié à P.
- Cet exemple peut représenter un atome d’hydrogène.
- L’électron E est soumis à une force électrostatique attractive.
- Cette force est orientée vers le centre du proton P, c’est une force centripète.
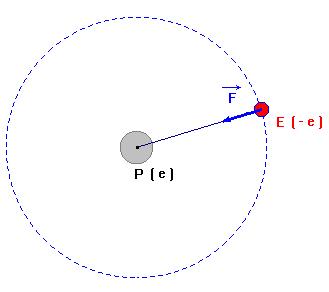
- Le mouvement de E est soit circulaire, elliptique ou hyperbolique.
- Cela dépend de la vitesse de E dans le référentiel d’étude.
c)- Conclusions.
- Les deux types de forces conduisent aux mêmes types de mouvements du centre d’inertie des objets.
- C’est à partir de cette constatation que le modèle planétaire de l’atome d’hydrogène a été élaboré (RUTHERFORD).
- Dans les deux cas, il y a une infinité de trajectoires passant par un point quelconque donné.
- Le mouvement est complètement déterminé si on connaît les conditions initiales.
- Il y a autant de trajectoires que de conditions initiales.
II- Les limites de la mécanique de Newton.
1)- Énergie du système S = {planète + satellite}.
- Un satellite de la Terre évolue sur une orbite bien déterminée.
- Dans le référentiel géocentrique, il possède une vitesse v et une altitude h.
- Le système S possède une énergie E.
- Toutes les altitudes et toutes les vitesses sont possibles.
- L’énergie d’un tel système peut prendre n’importe quelle valeur.
- L’énergie d’un tel système peut varier continûment.
2)- Énergie du système S = {proton + électron} de l’atome d’hydrogène.
- À partir du modèle planétaire de l’atome d’hydrogène, on peut prévoir pour ce système toutes les énergies possibles.
- Ce modèle est-il en accord avec la réalité ?
- Comment peut-on interpréter le spectre de la lampe à hydrogène ?
- Pour obtenir ce spectre, on soumet de l’hydrogène à des décharges électriques dans une ampoule
- Ce dispositif fournit de l’énergie aux atomes d’hydrogène.
- Les atomes gagnent de l’énergie et se retrouvent dans un état excité instable.
- Ils se désexcitent spontanément pour retrouver un état plus stable et une énergie plus basse.
- Au cours de cette désexcitation, ils émettent de l’énergie lumineuse.
- On observe un spectre de raies et non un spectre continu.
- Les fréquences des radiations émises ne peuvent prendre que certaines valeurs particulières.
- On dit que les fréquences sont quantifiées.
- Ce spectre de raies est caractéristique de l’hydrogène, il permet de l’identifier.
- Un atome d’hydrogène ne peut prendre que certains niveaux d’énergie.
- Ceci est en contradictions avec la mécanique de Newton.
3)- Le photon et les hypothèses de BOHR.
- En 1900, Max Planck fut conduit à postuler la quantification de l’énergie transportée par les ondes électromagnétiques.
- Il postule que l’énergie électromagnétique ne peut s’échanger que par « paquets » ou quanta d’énergie.
- En 1905, Albert Einstein émet l’idée que ces quanta d’énergie sont transportés par des photons.
- Les photons sont des particules de masse nulle et de charge nulle se propageant à la vitesse de la lumière.
- Énergie d’un photon : E = h . υ
- Pour une onde électromagnétique de fréquence υ et de longueur d’onde λ dans le vide
- La grandeur h est la constante de Planck : h = 6,62 x 10 – 34 J.s.
- En 1913, BOHR énonce les postulats suivants :
► Les variations d’énergie d’un atome sont quantifiées.
► L’atome ne peut exister que dans certains états d’énergie ou niveaux d’énergie bien définis.
► Un photon de fréquence υ est émis lorsque l’atome effectue une transition d’un niveau d’énergie Ep vers un niveau inférieur En tel que :
► Ep – En = h . υ
► Il résulte de ceci que les énergies d’un atome sont quantifiées.
► Contrairement à l’énergie du système S = {planète + satellite}, l’énergie du système {proton + électron} ne peut prendre que certaines valeurs discrètes.
► Le modèle planétaire de l’atome est à rejeter.
- Ce qui est vrai pour l’atome d’hydrogène est vrai aussi pour les autres atomes.
- Ceci reste valable pour les molécules qui sont des associations d’atomes.
- Il en va de même pour les noyaux des atomes.
- C’est pour cette raison que lors de la désexcitation d’un noyau, il y a émission d’un rayonnement γ.
- L’énergie d‘un atome est quantifiée, l’énergie d’une molécule est quantifiée et l’énergie d’un noyau est quantifiée.
III- Niveaux d’énergie électroniques d’un atome.
1)- Définition des niveaux d’énergie.
|
- Un atome ne peut exister que dans certains étatsd’énergie quantifiés, caractéristiques de l’élément. - La perte d’énergie d’un atome excité passant du niveau d’énergie Ep vers un niveau inférieur En s’accompagne de l’émission d’un photon d’énergie :
- Ep – En = h . υ - L’absorption d’énergie lumineuse par un atome ne peut se faire que si l’énergie du photon permet une transition d’un niveau En à un niveau supérieur Ep tel que :
- Ep - En = h . υ - Un atome ne peut absorber que les radiations qu’il est capable d’émettre. |
- Les échanges d’énergie liés aux transitions atomiques sont de l’ordre de l’électronvolt.
1 eV = 1,6 x 10–19 J
|
l’atome d’hydrogène. L'atome d'hydrogène est constitué d'un proton et d'un électron. Les niveaux d'énergie de l'atome sont donnés par la relation : Le nombre n est un nombre entier positif.L'état de plus basse énergie correspond à n = 1,le premier état excité à n = 2, etc., n = infini correspondant à l'état ionisé : l'atome d'hydrogène a perdu son électron et il se forme l'ion H+. a)- Calculer le rapport des valeurs des forces gravitationnelle etélectrique entre le proton et l'électron, si leur distance est égale à 5,9 x 10 – 11 m. - Commenter le résultat.
b)- Quelle est la valeur de l'énergie de l'état fondamental? c)- Représenter sur un diagramme en énergie les cinq premiers niveaux d'énergie.On prendra une échelle adaptée. d)- L'atome, initialement dans son état fondamental, absorbe un photon de fréquence n = 2,91 x 10 15 Hz. Calculer la valeur du nombre n qui caractérise le niveau dans lequel se trouve l'atome après l'absorption du photon. e)- L'atome peut alors se désexciter par émission spontanée. Quelles sont les différentes transitions possibles a priori? Calculer les longueurs d'onde des photons correspondants. Faire un schéma représentant les diverses transitions. Dans quel domaine du spectre électromagnétique se situent ces radiations? |
|
Solution : - Rapport des valeurs des forces gravitationnelle et électrique :
- Application numérique : - - L’interaction gravitationnelle est très négligeable devant l’interaction électrostatique. - Ce
résultat est indépendant de la distance entre le proton et l’électron.
- Valeur de l’énergie de l‘atome
d’hydrogène dans
l’état fondamental. - Dans l’état fondamental,
n
= 1 :
E1
= – 13,6 eV.
- Diagramme d’énergie des cinq
premiers niveaux d’énergie.
- Valeur du nombre
n.
- L’énergie absorbée par l’électron est donnée par la relation :
-
- Ce qui correspond sensiblement à la transition entre les niveaux 1 et 3 :
-
n
= 3.
-
Longueur d’onde des différents
photons.
- L’atome peut se désexciter directement vers son état fondamental. - L’atome peut se désexciter en passant par le
niveau intermédiaire : - Longueur d’onde associée à la transition
n
= 3 à n
= 1.
-
- Application numérique :
- Seule la radiation rouge λ32 ≈ 657 nm est dans le domaine
du visible, les deux autres sont dans
U.V. |
- Spectre de l'atome d'hydrogène : voir Exercice 38 page 379
Cliquer sur l'image pour l'agrandir.
Obtenu à l'aide du logiciel
Chroma
IV- Niveaux d’énergie des molécules et des noyaux.
- Les molécules sont le plus souvent constituées de plusieurs atomes.
- Dans le calcul de l’énergie d’une molécule il faut tenir compte de l’énergie de vibration, mais aussi de l’énergie de rotation.
- Les vibrations d’une molécules sont dues aux oscillations des atomes autour d’une position d’équilibre.
- Une molécule peut aussi posséder des mouvements de rotation autour de différents axes.
- Cela dépend de la géométrie de la molécule.
- Les molécules présentent des niveaux d’énergie quantifiés.
- Chaque niveau est associé à un état de vibration et de rotation donné.
- Les spectres moléculaires sont plus complexes que les spectres atomiques.
- Le spectre de raies d’absorption typique d’une molécule montre des séries de raies très proches les unes des autres.
- L’énergie correspondante à ces transitions est de l’ordre du meV.
- Avec les spectroscopes usuels dont le pouvoir de résolution est faible, les raies sont très proches les unes des autres, on observe des bandes noires d’absorption.
- L’énergie des noyaux est également quantifiée.
- Un noyau peut effectuer des transitions de niveau d’énergie par émission ou absorption d’un photon.
- Un noyau peut aussi être excité par la collision avec une particule suffisamment énergétique.
- Les transitions nucléaires sont très énergétiques. Les énergies échangées lors des transitions sont de l’ordre du MeV.
- Les photons émis ou absorbés sont du domaine des rayons
γ.
- Exemple : Une désintégration radioactive s’accompagne le plus souvent de l’émission de photons γ.
- Souvent, après la désintégration, le noyau-fils se retrouve dans un état excité.
- Il se désexcite alors pour revenir dans son état fondamental par émission d’un ou plusieurs photons γ.