|
Chim. N° 01 |
Pigments et Colorants. Cours. |
|
|
Mots clés : |
|
|
|
III-
Structure d’une molécule colorée. |
|
|
|
Les molécules ont été réalisées avec le
|
|
Exercices : énoncé et correction a)- Exercice 7 page 74. Distinguer un pigment d’un colorant. b)- Exercice 10 page 74. Interpréter la couleur d’un colorant. c)- Exercice 11 page 74. Interpréter la couleur d’une encre. d)- Exercice 12 page 75. Écrire une formule topologique. e)- Exercice 13 page 75. Interpréter la couleur d’une molécule. f)- Exercice 21 page 76. Le violet de gentiane. |
I-
La matière colorée.
- Une matière colorée est une substance responsable de la couleur.
1)- Un peu d’Histoire.
-
Les matières colorées sont connues depuis la préhistoire.
-
Les Égyptiens furent les premiers à préparer des
colorants pour teindre des tissus ou colorer des poteries et
préparer des fards.
-
L’Indigo fut l’un des colorants bleus les plus importants
avec le pastel.
-
Dans l’Antiquité c’est l’Indicum de Pline.
-
Au Moyen-âge, il est extrait d’une espèce d’indigotier :
l’indigofera tinctoria.
-
Les feuilles et les tiges de cet arbuste sont mises à
macérer puis le colorant est obtenu après oxydation à l’air.
► Jusqu’en 1856 les colorants utilisés étaient d’origine naturelle, extraits du monde végétal, minéral ou animal.
-
À partir de végétaux, on peut obtenir :
-
La garance (plante de la famille des rubiacées
dont les racines sont utilisées pour leur capacité à teindre les
textiles en rouge vif),
-
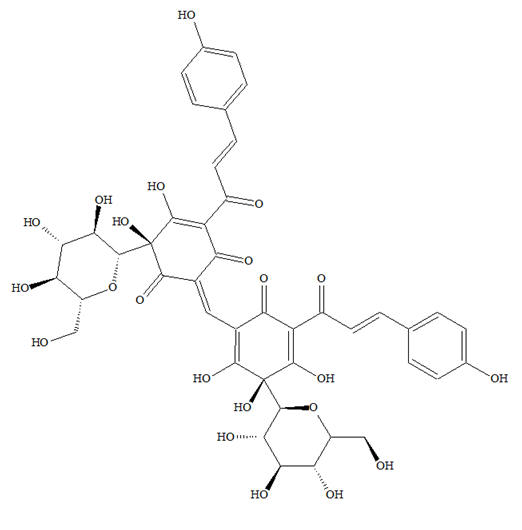
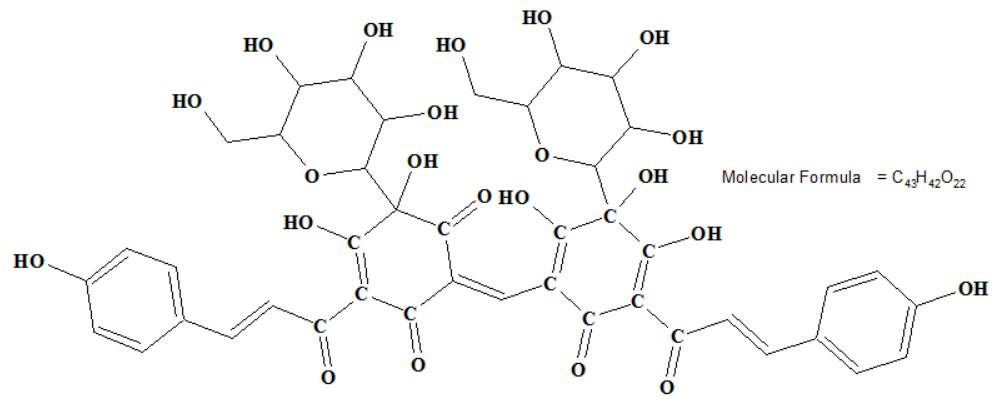
Le carthame (le carthame est réputé pour les propriétés
tinctoriales de ses capitules d’où l’on extrait la carthamine et
la carthamone qui donnent de beaux pigments jaune vif ou rouge
aussi appelé rouge carthame ou rouge végétal).


-
Formule : Carthamine jaune
-
À partir d’animaux, on peut obtenir :
-
Le kermès (le
kermès est fabriqué avec les œufs des cochenilles parasitant un
chêne méditerranéen dit chêne kermès, poussant en Espagne et
dans les îles grecques. On en tire l'acide carminique de couleur
rouge intense.
-
Après la découverte de la mauvéine par Perkin en 1856,
c’est l’essor des colorants synthétiques.
-
Les chimistes parviennent à synthétiser des espèces
chimiques jusqu’alors extraites de végétaux ou d’animaux.
-
Les matières colorants naturelles sont remplacées par des
produits de synthèse dont le coût de revient est moins élevé.
-
En 1880 les travaux de Baeyer aboutissent à la synthèse
en laboratoire de l’Indigo
puis la firme allemande B.A.S.F. développe le procédé industriel
en 1897.
-
C’est à cette époque que le terme organique change de
définition.
► Première définition :
![]() On appelle matières organiques ou espèces
organiques, les substances extraites des organismes vivants.
On appelle matières organiques ou espèces
organiques, les substances extraites des organismes vivants.
► Définition actuelle :
![]() On appelle espèces organiques, naturelle ou
synthétiques, les substances qui ne contiennent que les éléments
carbone C et hydrogène H.
On appelle espèces organiques, naturelle ou
synthétiques, les substances qui ne contiennent que les éléments
carbone C et hydrogène H.
2)- Pigments et colorants.
![]() Les pigments sont des substances finement divisées
et insolubles dans le milieu qui les contient. Les pigments sont
en suspension dans un liquide ou en dispersion dans un solide.
Les pigments sont des substances finement divisées
et insolubles dans le milieu qui les contient. Les pigments sont
en suspension dans un liquide ou en dispersion dans un solide.
![]() Les colorants sont des substances qui sont
solubles dans le milieu qu’ils colorent.
Les colorants sont des substances qui sont
solubles dans le milieu qu’ils colorent.
3)- Paramètres influençant la
couleur.
a)- Influence du pH du milieu.
-
De nombreux colorants, synthétiques ou naturels, ont une
couleur qui dépend du pH du milieu dans lequel ils sont
en solution.
-
Leurs molécules possèdent généralement plusieurs groupes –
OH. C’est le cas des polyphénols.
-
Un grand nombre de ces espèces est utilisé comme indicateurs
colorés de pH.
-
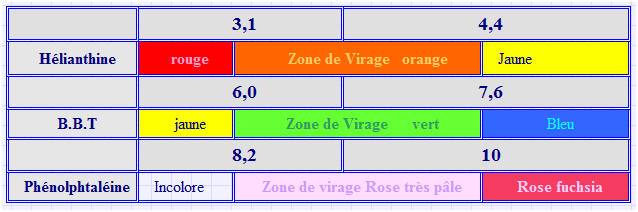
Exemples : le B.B.T, l’hélianthine et la phénolphtaléine.
-
Le B.B.T :
-
Formule :
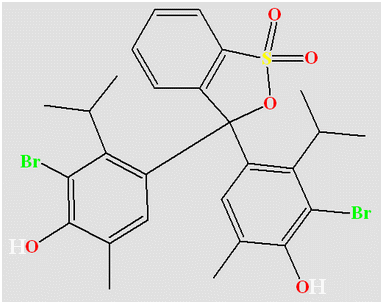
- Les différentes teintes prises par le B.B.T suivant la valeur du pH de la solution :

-
L’hélianthine :
-
Formule :
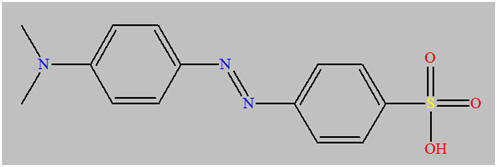
-
La phénolphtaléine :
-
Formule :
► Exemple : La solution de chou rouge
-
Les anthocyanes contenus dans le chou rouge ont la
propriété de changer de couleur en fonction du pH de la
solution.
-
La teinte de la solution de chou rouge dépend du pH
de la solution.
-
On peut l’utiliser comme indicateur coloré.

|
Couleur rouge Cation flavylium |
|
|
Couleur bleu-vert Base quinonique |
|
|
Couleur jaune Chalcone |
|
b)- Influence de la nature du milieu.
-
La couleur d’un colorant dépend de la nature du solvant
dans lequel il est solubilisé.
► Exemple : Cas du diiode
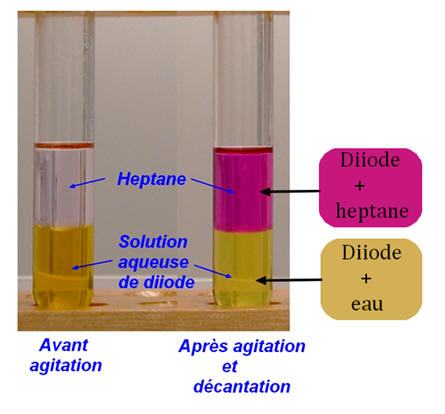
-
Le diiode en solution aqueuse donne une coloration
jaune-orangé.
-
Dans l’heptane, le diiode donne une coloration violette à
la solution obtenue.
-
Dans le cas d’une teinture, la nature du support ou de la
fibre du textile utilisé influence la couleur finale du tissu.
► Exemple : rouge de cochenille

c)- Autres facteurs d’influence.
- Le dioxygène de l’air peut modifier les groupes caractéristiques et changer ainsi la couleur du matériau.
- Une irradiation lumineuse peut modifier la couleur des espèces photochromes utilisées pour certaines lunettes.
- Certaines espèces ont une couleur qui est sensible à une variation de température, à une variation d’humidité.
-
Par chauffage :
-
La couleur d’un pigment
peut changer par chauffage.
-
L’ocre jaune est une
argile (kaolinite) qui est colorée par un pigment la goethite.
- La goethite contient principalement de l’oxyhydroxyde de fer III partiellement hydraté de formule générale : (FeO(OH), n H2O).
- Lorsque l’on chauffe l’ocre jaune, on le déshydrate et les molécules d’eau sont extraites de la matière sous forme de vapeur.
-
L’ocre change ainsi de
couleur. On passe de l’ocre jaune à l’ocre rouge par chauffage.
- De même, si on chauffe du sulfate de cuivre II partiellement hydraté (CuSO4, 6 H2O), il change de couleur.
- Il passe de la couleur bleue à une couleur blanche lorsqu’il est déshydraté.


II-
Mélange soustractif.
1)- Introduction.
- Théoriquement, en synthèse soustractive, trois couleurs suffisent pour reproduire toutes les autres.
- C’est le principe de la trichromie.
(Cours de physique :
Chap. N° 02 Couleur des objets)
- Les couleurs primaires de la synthèse soustractives sont :
- Le cyan : Cyan
- Le magenta : Magenta
- Et le jaune : Jaune
-
Ces couleurs primaires ne peuvent pas s’obtenir par
mélange d’autres couleurs.
-
Les mélanges des couleurs primaires soustraient chacune
un certain nombre de radiations du spectre de la lumière blanche.
-
Il résulte de ceci que de nouvelles couleurs
apparaissent.
-
Ces mélanges sont appelés : mélanges soustractifs.
2)- Définition :
-
Un mélange soustractif résulte de la combinaison des
couleurs primaires de la synthèse soustractive.
-
La couleur d’un mélange résulte d’une synthèse
soustractive des couleurs des matières colorées ayant servi à sa
création.
3)- Cas de la peinture :
-
En peinture, on procède par mélanges de matières colorées
des trois couleurs primaires.
-
Une peinture blanche et une peinture noire sont également
utilisées.
III- Structure d’une molécule colorée.
1)- Les molécules organiques.
-
Les molécules de la chimie organique sont composées
essentiellement des atomes de carbone et d’hydrogène.
-
On peut rencontrer aussi, quelques atomes d’oxygène,
d’azote, de soufre,…
-
L’enchaînement des atomes de carbone constituant une
molécule organique forme une chaîne carbonée.
-
C’est l’une des particularités très importantes de
l’atome de carbone.
-
Dans ce type de molécule,
- L’atome de carbone est lié quatre fois.
- Les
liaisons peuvent être simples ou doubles (quatre simples
liaisons ou deux simples et une double liaison ; …)
-
L’atome d’hydrogène est lié une fois.
-
L’atome d’oxygène est lié deux fois (deux simples
liaisons ou une double liaison)
-
L’atome d’azote est lié trois fois (trois simples
liaisons ou une double liaison et une simple liaison).
-
On représente les simples liaisons par un trait, les
doubles liaisons par deux traits parallèles,…
-
Pour représenter une molécule, on peut utiliser :
-
La formule brute : Elle
indique la nature et le nombre des atomes constituant la
molécule.
-
Elle ne donne aucune
indication sur la structure de la molécule : chaîne carbonée,
groupe fonctionnel,…
-
La formule développée :
Elle indique l’enchaînement des
atomes et la nature des liaisons qui les unissent
-
La formule semi-développée :
Elle dérive de la formule
développée.
-
Elle ne fait pas
apparaître les liaisons entre un atome d’hydrogène et un autre
atome.
-
Et la formule topologique :
-
On fait apparaître la chaîne carbonée
sous forme de ligne brisée,
mais les atomes de carbone et les atomes d'hydrogène qui leur
sont liés ne sont pas représentés.
-
Les liaisons multiples sont mentionnées.
-
Les atomes autres que C et H figurent par
leur symbole, ainsi que les atomes d'hydrogène qu'ils portent
éventuellement.
-
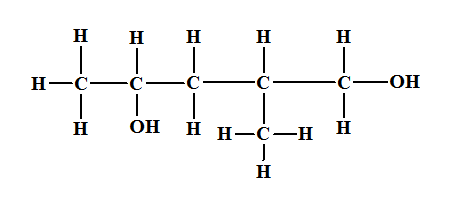
Exemple :
|
Formule brute |
C6H14O2 |
|
Formule
développée |
|
|
Formule
Semi-développée |
|
|
Formule
topologique |
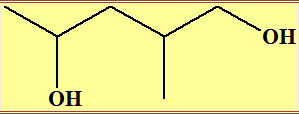 |
|
Nom de la
molécule |
2-méthylpentane-1,4-diol |
► Formule topologique : Elle facilite l’écriture des formules.
► Elle est moins lourde à manipuler surtout pour les molécules possédant une longue chaîne carbonée.
2)- Les molécules à liaisons
conjuguées.
-
Deux doubles liaisons entre atomes sont conjuguées si
elles ne sont séparées que par une simple liaison.
- Exemple : (3E)-penta-1,3-diene
- Formule brute : C5H8
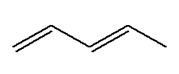
-
Un système de doubles liaisons est conjugué s’il se
présente sous une alternance ininterrompue de simples et de
doubles liaisons.
-
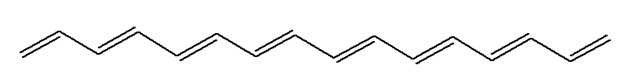
Exemple : (3E,5E,7E,9E,11E,13E)-hexadeca-1,3,5,7,9,11,13,15-octaene
-
Formule brute : C16H18
► Liaisons conjuguées et coloration :
- Une molécule organique possédant un système conjugué d’au moins sept doubles liaisons forme le plus souvent un matériau coloré, ceci en l’absence de groupe caractéristique,
-
La couleur perçue correspond à la couleur
complémentaire de la (ou des) radiation(s) absorbée(s).
-
De façon générale, la longueur d’onde de la lumière
absorbée augmente lorsque le nombre de doubles liaisons
conjuguées augmente.
-
Exemple 1 : (3E, 5E, 7E)-deca-1, 3, 5,
7,9-pentaene
-
Formule brute : C10H12
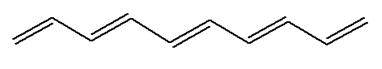
-
Cette molécule possède un système conjugué de 5 doubles
liaisons. Elle n’est pas colorée.
-
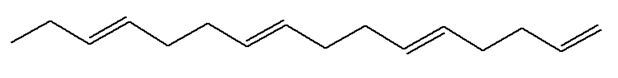
Exemple 2 : (5E, 9E, 13E)-hexadeca-1, 5,
9,13-tetraene
-
Formule brute : C16H26
-
Les doubles liaisons de cette molécule ne sont pas
conjuguées. Elle n’est pas colorée. Elle est incolore.
-
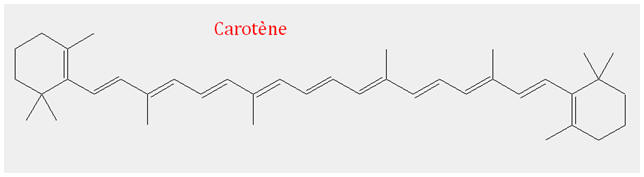
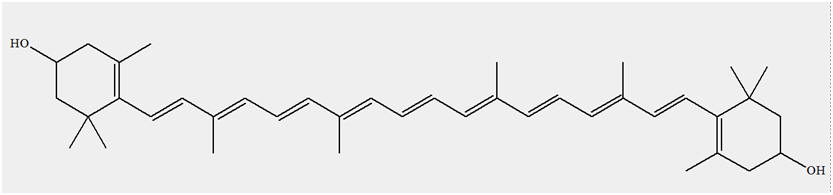
Exemple de molécule colorée : le
carotène (rouge-orangé)
-
Formule brute : C40H56
-
Cette molécule est à l’origine d’une couleur
rouge-orangé.
-
Elle présente une suite ininterrompue de simples et de
doubles liaisons.
-
Le système conjugué comprend 11 doubles liaisons, la
molécule forme un matériau coloré.
-
Éclairé en lumière blanche, le carotène absorbe des
radiations bleues et vertes et apparaît rouge-orangé.

- La couleur prise par les feuilles en automne est due à la présence de carotène.


- Une feuille contient différents groupes de pigments tels que la chlorophylle (couleur verte), les caroténoïdes comme le carotène (couleurs jaunes, brunes, orange et rouge-orangé).
- Au départ, les feuilles sont vertes car la chlorophylle est abondante. Le vert des molécules de chlorophylle domine et masque la couleur des autres pigments présents dans la feuille.
- Quand l’automne approche, la quantité de chlorophylle diminue, elle ne se renouvelle plus suffisamment. L’effet de masque s’atténue progressivement.
- Les autres pigments présents dans la feuille commencent à apparaître.
- Ce sont les caroténoïdes (comme le carotène) qui sont responsable des couleurs jaunes, brunes, orange et rouge-orangé.

- Le carotène C40H56 possède une couleur qui va de l’orange au rouge.
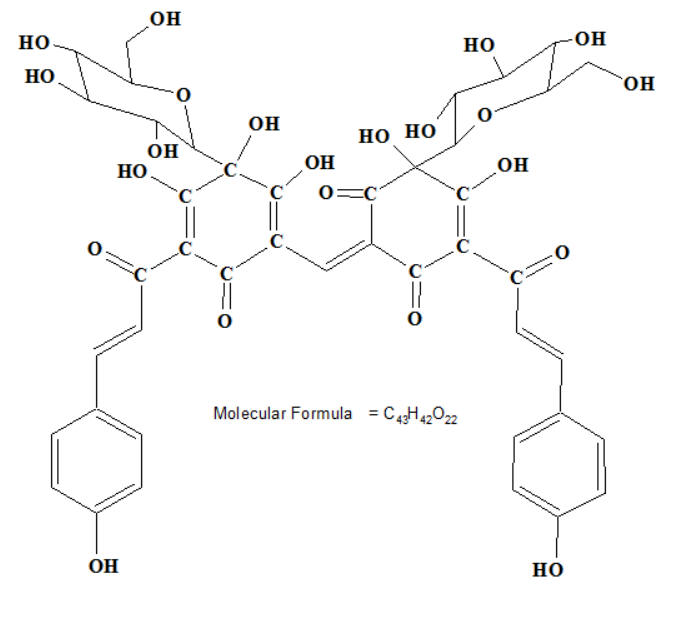
- La zéaxantine C40H56O2 est un pigment de la famille des xanthophylles (caroténoïde) qui a une couleur jaune (présence de groupes auxochromes : ici groupement – OH)
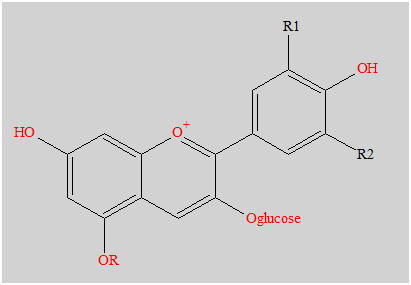
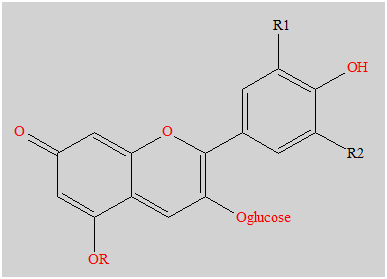
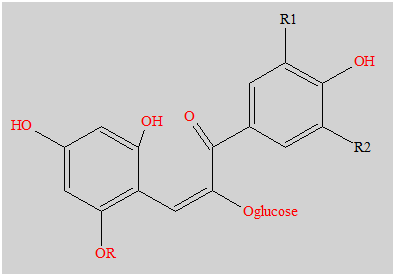
- Les anthocyanes sont des pigments naturels des feuilles, des pétales et des fruits.
- Ci-dessous, on donne la formule de la 3-glucoside de la malvidine, l'anthocyane majoritaire dans le raisin et le vin.
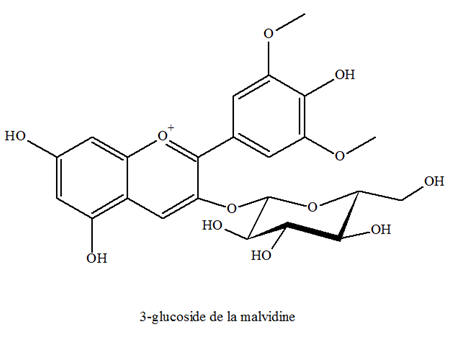
3)- Les groupes chromophores et auxochromes.
a)- Groupe chromophore :
-
On appelle groupe chromophore les doubles liaisons qui
permettent l’absorption de la lumière dans le domaine du visible
ou de l’ultra-violet.
- Exemple de groupes chromophores :
|
– C = C – C = C –
C = C |
– C = N – |
– N = N – |
– C = C – C = O |
b)- Influence des substituants : Groupes auxochromes
- La présence de substituants peut modifier la longueur d’onde d’absorption.
- Ce sont des auxochromes.
- Exemple de groupes auxochromes :
|
– NH2 |
– OH |
– Br |
– O – CH3 |
- Le déplacement de l’absorption vers les plus grandes longueurs d’onde dans le domaine visible est dû notamment à la présence de groupes auxochromes couplés avec des groupes chromophores.
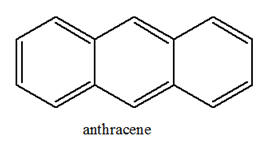
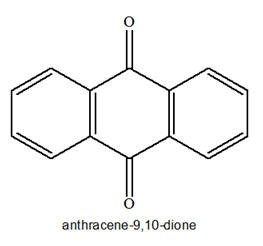
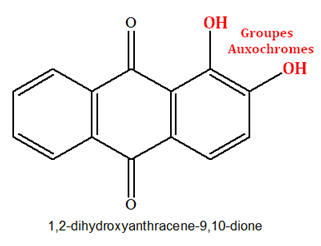
► Exemple : anthracène, l’anthraquinone et l’alizarine.
|
Nom |
Molécule |
Couleur |
|
|
Anthracène |
|
Jaune pâle
|
7 doubles liaisons conjuguées Absorbe dans le bleu
|
|
Anthraquinone |
|
Jaune
|
8 doubles liaisons conjuguées Absorbe dans le bleu
|
|
Alizarine |
Rouge-orangé
|
8 doubles liaisons conjuguées + 2 groupes Auxochromes Absorbe dans le bleu et le vert
|
- L’anthraquinone et l’alizarine possèdent huit doubles liaisons conjuguées et sont colorées.
- Elles différent par la présence de groupes auxochromes – OH dans l’alizarine et sont de couleurs différentes.
c)- Conclusion :
- Dans une molécule organique colorée, les groupes responsables de la couleur sont des groupes chromophores.
- Les groupes pouvant modifier la longueur d’onde d’absorption des chromophores sont appelés les groupes auxochromes.
IV- Applications.
1)- QCM : Pour chaque question, indiquer la (ou les) bonne(s) réponse(s). sous forme de tableau
- Le pentacène : poudre rouge virant au vert à la lumière et à l'air libre.
2)- Exercices : Exercices : énoncé et correction
a)- Exercice 7 page 74. Distinguer un pigment d’un colorant.
b)- Exercice 10 page 74. Interpréter la couleur d’un colorant.
c)- Exercice 11 page 74. Interpréter la couleur d’une encre.
d)- Exercice 12 page 75. Écrire une formule topologique.
e)- Exercice 13 page 75. Interpréter la couleur d’une molécule.
f)- Exercice 21 page 76. Le violet de gentiane.
|
|