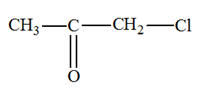|
QCM N° 04 |
Analyse spectrale |
|
|
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
Une solution de couleur verte : |
Absorbe des radiations de couleur verte. |
Peut absorber des radiations de couleur rouge. |
Peut absorber des radiations de couleur violette |
BC |
|
2 |
Un liquide incolore : |
Absorbe toutes les radiations de la lumière blanche. |
N’absorbe pas dans le visible. |
N’absorbe aucune radiation. |
B |
|
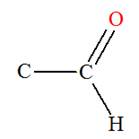
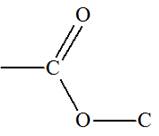
3 |
|
Est un groupe amine |
Est un groupe amide |
Est un groupe ester |
B |
|
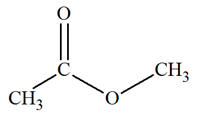
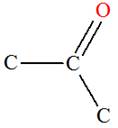
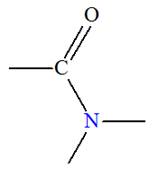
4 |
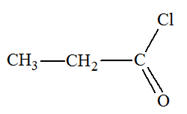
|
Est l’éthanoate de méthyle |
Est une cétone |
Est un ester |
AC |
|
5 |
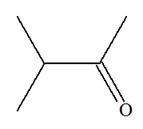
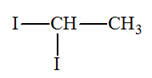
La formule topologique d’une molécule est représentée ci-dessous :
Son nom est : |
2-méthylbutan-3-one |
3-méthylbutan-2-one |
3-méthylbutan-2-ol |
B |
|
6 |
Les aldéhydes et les cétones sont des classes fonctionnelles qui ont en commun le groupe caractéristique : |
Hydroxyle |
Carboxyle |
Carbonyle |
C |
|
7 |
Le butanoate de méthyle appartient à la classe fonctionnelle des : |
Amides |
Esters |
Aldehydes |
B |
|
8 |
L’abscisse d’un spectre IR est généralement : |
Le nombre d’onde |
La longueur d’onde |
La fréquence |
A |
|
9 |
La spectroscopie IR permet : |
D’identifier la présence de certains types de liaisons. |
D’identifier l a nature de toutes les liaisons d’une molécule. |
De connaître le nombre d’atomes de carbone présents dans une molécule. |
A |
|
10 |
Dans un spectre infrarouge, on lit généralement : |
La transmittance en ordonnée |
L’absorbance en ordonnée |
Le nombre d’ondes en abscisse |
AC |
|
11 |
À partir de leur spectre infrarouge, on peut distinguer : |
Un alcane d’un alcène. |
Un aldéhyde d’une cétone. |
Un alcool d’un acide carboxylique. |
AC |
|
12 |
Lorsqu’il peut se former des liaisons hydrogène. La bande d’absorption de la liaison O – H : |
Est fine |
Est déplacée vers les faibles valeurs de nombre d’ondes. |
Est large |
BC |
|
13 |
Dans un spectre RMN, un signal peut être repéré : |
Par son nombre d’ondes. |
Par sa longueur d’onde. |
Par son déplacement chimique. |
C |
|
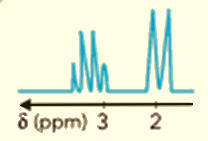
14 |
Le spectre RMN ci-dessous peut être celui :
|
Du 2-chloropropane
|
Du 1,2-diiodoéthane
|
Du 1,1-diiodoéthane
|
C |
|
15 |
Le spectre de RMN du 2-bromopropane CH3 – CHBr – CH3 : |
Présente 3 signaux. |
Présente un doublet. |
Présente un sextuplet. |
B |
|
16 |
Un spectre de RMN qui ne présente qu’un seul triplet peut être celui de : |
CH3 – CH2 – CH3 |
CH3 – CH2 – CH2 – Br |
CH3 – OH |
A |
|
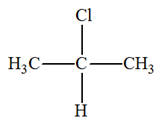
17 |
Le spectre de RMN du chlorure de propanoyle, de formule brute C3H5ClO, est représenté ci-dessous : On rappelle que l’atome d’oxygène et l’atome de chlore sont plus électronégatifs que les atomes de carbone et d’hydrogène. L’observation du spectre de RMN permet de dire que : |
Tous les atomes d’hydrogènes sont équivalents. |
Il y a deux groupes d’atomes d’hydrogène équivalents. |
Il y a sept groupes d’atomes d’hydrogène équivalents |
B |
|
18 |
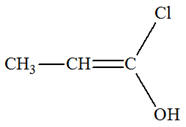
La formule semi-développée de la molécule étudiée précédemment est : |
|
|
|
A |
- Tableau des différentes fonctions chimiques rencontrées
en première S.
|
Fonction |
Alcool |
Aldéhydes |
Cétones |
Acide carboxylique |
|
Groupe caractéristique |
R
–
O
– H |
|
|
|
|
Nom |
Hydroxyde |
Carbonyle |
Carbonyle |
Carboxyle |
-
Tableau des différentes fonctions chimiques rencontrées
en Terminale S.
|
Fonction |
Alcène |
Ester |
Amine |
Amide |
|
Groupe caractéristique |
|
|
|
|
|
Nom |
Alcène |
Ester |
Amine |
Amide |
►
Couleurs et ordre de grandeur des longueurs
d’onde :
Deux couleurs
complémentaires sont diamétralement opposées.
- Une espèce incolore n’absorbe aucune radiation du spectre
visible.
-
Lorsqu’une espèce chimique absorbe que dans un seul
domaine de longueurs d’onde du visible sa couleur est la couleur
complémentaire de celle des radiations absorbées.
-
La solution aqueuse de diiode qui absorbe dans le bleu
donne des solutions de couleur orange.
-
La spectroscopie IR est une spectroscopie
d’absorption.
-
Les composés organiques absorbent aussi dans le domaine
de l’infrarouge.
-
Pour ces spectres, on fait figurer :
-
La transmittance T ou intensité lumineuse
transmise par l’échantillon analysé en ordonnée (elle s’exprime
en pourcentage)
-
Le nombre d’ondes σ en abscisse.
-
Le nombre d’ondes σ est l’inverse de la longueur
d’onde λ.
-
Les spectres IR sont constitués d’une série de
bandes d’absorption.
-
Chaque bande d’absorption est associée à un type de
liaison, principalement caractérisé par les deux atomes liés et
la multiplicité de la liaison.
-
Un spectre infrarouge renseigne sur la nature des
liaisons présentes dans une molécule.
-
L’abscisse d’un spectre de RMN représente une
grandeur liée à la fréquence de résonance des noyaux
d’hydrogène, appelée déplacement chimique, noté δ.
-
Le déplacement chimique δ est exprimé en
ppm (parties par million).
-
L’axe des abscisses est orienté de droite à gauche (de 0
à 14 ppm)
-
La grandeur de l’axe des ordonnées n’est usuellement pas
indiquée, car elle n’apporte pas d’information particulière.
-
Le spectromètre permet de tracer deux courbes qui
utilisent le même axe des abscisses :
-
Une courbe est formée des signaux de résonance des noyaux
d’hydrogène de la molécule,
-
L’autre courbe, appelée
courbe d’intégration
est formée de paliers.
- Protons équivalents :
-
Dans une molécule, les noyaux des atomes d’hydrogène sont
équivalents s’ils ont le même environnement chimique.
-
Des protons équivalents (par abus de langage, on parle
aussi d’atomes d’hydrogène équivalents) ont le même déplacement
chimique δ.
-
Deux protons sont magnétiquement équivalents s’ils ont la
même fréquence de résonance υ.
-
Ils sont représentés par le même signal sur le spectre.
-
Le nombre de signaux dans un spectre RMN est égal
au nombre de groupes de protons équivalents présents dans la
molécule étudiée.
-
Lorsqu’une molécule présente une symétrie, des protons
portés par des atomes de carbone différents peuvent être
équivalents.
-
Un signal de résonance n’est pas toujours un pic fin et
unique. Il peut comporter plusieurs pics et est alors appelé
multiplet.
-
Dans une molécule, les protons portés par un atome de
carbone interagissent avec les protons portés par les atomes de
carbone voisins, on dit qu’il y a couplage entre protons.
-
Des protons équivalents appartenant à un même groupe (à
un même atome de carbone) ne se couplent pas.
-
Dans les cas simples, on peut utiliser la règle des (n+1)-uplets :
- Méthode d’analyse d’un
spectre RMN.
-
Première étape : on compte le nombre de signaux du
spectre. Ceci permet de déterminer le nombre de groupes de
protons équivalents.
-
Deuxième étape : on utilise la courbe
d’intégration. Ainsi, on peut déterminer la proportion de
protons équivalents associés à chaque signal.
-
Troisième étape : on analyse la multiplicité de
chaque signal. On peut ainsi déterminer le nombre de protons
équivalents voisins des protons responsable du signal.
-
Quatrième étape : on utilise une table de valeurs
de déplacement chimique pour vérifier ou confirmer la formule de
la molécule.
|
|