|
Méthodes d'analyse chimique
|
|
|
|
|
|
|
II- Un colorant pour traiter des infections
|

- Lors de l’exploration d’une grotte, un spéléologue
peut rencontrer des nappes de dioxyde de carbone.
-
|
Méthodes d'analyse chimique
|
|
|
|
|
|
|
II- Un colorant pour traiter des infections
|

- Lors de l’exploration d’une grotte, un spéléologue
peut rencontrer des nappes de dioxyde de carbone.
-
À teneur élevée, ce gaz entraîne des évanouissements et même la mort.-
Le dioxyde de carbone est formé par action d’eaux
de ruissellement acides sur le carbonate de calcium CaCO3 présent dans
les roches calcaires.
Données : Système
S1
= {Voiture}
►
Température du laboratoire au moment de
l’expérience : θ = 25 ° C
►
Pression atmosphérique :
Patm
= 1,013 × 105 Pa
►
Le dioxyde de carbone formé se comporte comme un
gaz parfait et vérifie la loi des gaz parfaits :
►
P . V (CO2)
= n (CO2)
. R . T
►
Les unités : P
en Pa ; V (CO2)
en m3 ;
n (CO2)
en mol ; T en K.
►
Constante des gaz parfaits :
R = 8,31 J . mol-1
. K-1
2)- Résultat de l’expérience :
-
Un élève verse dans un ballon, une solution de
volume VS
= 100 mL d’acide chlorhydrique de concentration en quantité d’ions oxonium
CS
= 100 mmol . L-1.
- À la date t = 0 s, il introduit rapidement dans un ballon un échantillon de carbonate de calcium CaCO3 (s) de quantité de matière n0 = 20,0 mmol
- et déclenche simultanément un chronomètre.
-
Puis il relève les valeurs du volume
V (CO2)
de dioxyde de carbone dégagé en fonction du temps t.
-
Ces valeurs sont reportées dans le tableau
ci-dessous.
-
La pression du gaz est égale à la pression
atmosphérique.
|
Date |
Volume |
|
t (en
s) |
V
(CO2)
(en mL) |
|
0 |
0 |
|
20 |
29 |
|
40 |
49 |
|
60 |
63 |
|
80 |
72 |
|
100 |
79 |
|
120 |
84 |
|
140 |
89 |
|
160 |
93 |
|
180 |
97 |
|
200 |
100 |
|
220 |
103 |
|
240 |
106 |
|
260 |
109 |
|
280 |
111 |
|
300 |
113 |
|
320 |
115 |
|
340 |
117 |
|
360 |
118 |
|
380 |
119 |
|
400 |
120 |
|
420 |
120 |
|
440 |
121 |
-
La transformation chimique étudiée est modélisée
par la réaction d’équation :
CaCO3
(s) + 2 H3O+
(aq) → Ca2+
(aq) + CO2
(g) + 3 H2O
(ℓ)
a)-
Construire le tableau d’avancement de la réaction et
déterminer la valeur de l’avancement maximal noté xmax.
|
Équation |
CaCO3
(s) |
+
2
H3O+ (aq) |
→ |
Ca2+
(aq) |
+
CO2
(g) |
+ 3
H2O (ℓ) |
|
|
État du système |
Avanc. |
n
(CaCO3) (mmol) |
n
(H3O+) (mmol) |
|
n
(Ca2+) (mmol) |
n
(CO2) (mmol |
Excès et solvant |
|
État initial (mmol) |
x =
0 |
n0
≈ |
n1
≈ |
0 |
0 |
|
|
|
État intermédiaire |
x |
n0
– x |
n1
– 2
x |
x |
x |
|
|
|
État Final (mmol) |
xf |
n0
– xf |
n1
– 2
xf |
xf |
xf |
|
|
|
|
|
|
|
|
|
||
|
État Maximal (mmol) |
xmax |
n0
– xmax |
n1
– 2
xmax |
xmax |
xmax |
|
|
|
|
|
|
|
|
|
||
-
Détermination de la valeur de l’avancement maximal
xmax :
-
Les réactifs : les ions oxonium présents dans la
solution d’acide chlorhydrique :
-
Formule de la solution d’acide chlorhydrique : (H3O+
(aq) + Cℓ-
(aq))
-
Quantité de matière d’ions oxonium H3O+
: (attention aux unités)
-
n1
= CS
. VS
-
n1
= 100 × 100 × 10-3
-
n1
= 10,0 mmol
-
Quantité de matière de carbonate de calcium
CaCO3
:
-
n0
= 20,0 mmol
-
Valeur de l’avancement maximal :
-
La réaction est supposée totale :
xf =
xmax
-
Hypothèse 1 : On
considère que le réactif limitant est l’ion oxonium H3O+
(aq) :
-
n1
– 2 xmax1
= 0
-
10,0 –
2 xmax1
= 0 => xmax1
= 5,00 mmol
-
Hypothèse 2 : On
considère que le réactif limitant est le carbonate de calcium
CaCO3
(s) :
-
n0
– xmax2 = 0
-
20,0 – xmax2
= 0 => xmax2
= 20,0 mmol
-
xmax
= xmax1
= 5,00 mmol < xmax2
-
Réactif limitant : le réactif limitant est l’ion
oxonium H3O+
(aq).
-
On peut maintenant compléter le tableau
d’avancement :
|
Équation |
CaCO3
(s) |
+
2
H3O+ (aq) |
→ |
Ca2+
(aq) |
+
CO2
(g) |
+ 3
H2O (ℓ) |
|
|
État du système |
Avanc. |
n
(CaCO3) (mmol) |
n
(H3O+) (mmol) |
|
n
(Ca2+) (mmol) |
n
(CO2) (mmol |
Excès et solvant |
|
État initial (mmol) |
x =
0 |
n0
≈ 20 |
n1
≈ 10 |
0 |
0 |
|
|
|
État intermédiaire |
x |
n0
– x |
n1
– 2
x |
x |
x |
|
|
|
État Final (mmol) |
xf |
n0
– xf |
n1
– 2
xf |
xf |
xf |
|
|
|
|
|
|
|
|
|
||
|
État Maximal (mmol) |
xmax |
n0
– xmax |
n1
– 2
xmax |
xmax |
xmax |
|
|
|
5,00 |
15,0 |
0 |
5,00 |
5,00 |
|
||
b)-
Exprimer l’avancement x
de la réaction à une date t
en fonction de V (CO2),
T, Patm
et R.
-
La lecture du tableau d’avancement permet de donner
la relation suivante :
-
n (CO2)
= x
-
On considère que le dioxyde de carbone formé se
comporte comme un gaz parfait et vérifie la loi des gaz parfaits :
-
P . V (CO2)
= n (CO2)
. R . T
-
![]()
-
Au cours de l’expérience :
-
P =
Patm =
1,013 × 105 Pa et
T = θ
+ 273
-
Dans les conditions de l’expérience, on peut
écrire :
-
![]()
c)-
Calculer le volume maximal Vmax
de gaz susceptible d’être recueilli dans les conditions de l’expérience.
Déterminer si la transformation est totale.
-
Volume maximal Vmax
de gaz susceptible d’être recueilli dans les conditions de l’expérience :
-
C’est le volume recueilli lorsque l’avancement de
la réaction est égal à l’avancement maximal.
-
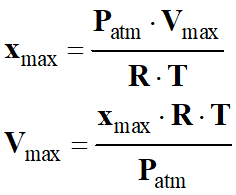
-
Application numérique :
-
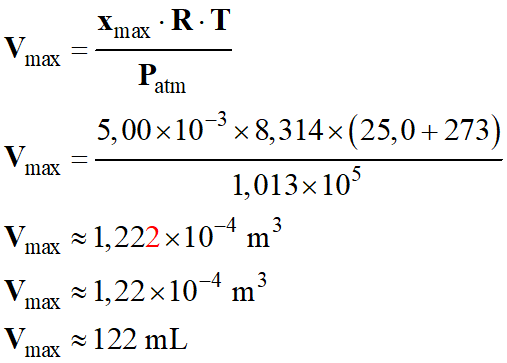
-
Caractéristique de cette transformation :
-
La consultation du tableau permet de noter la
valeur du volume de dioxyde de carbone obtenu en fin de réaction :
-
V (CO2)t
= 440 s = 121 mL
-
On peut considérer que l’état final correspond à
l’état d’avancement maximal de la réaction.
-
La réaction est lente, mais elle est considérée
comme totale.
d)-
Représenter le nuage de points expérimentaux obtenu en
plaçant la date t en abscisse
et l’avancement x en
ordonnée.
-
Représentation graphique de la transformation.
-
Pour le calcul de l’avancement
x en fonction du volume
V (CO2)t
-
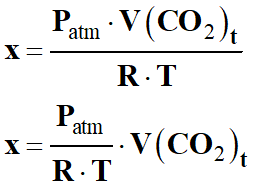
-
Les unités : On veut calculer l’avancement
x en mmol et exprimer le volume en
mL
-
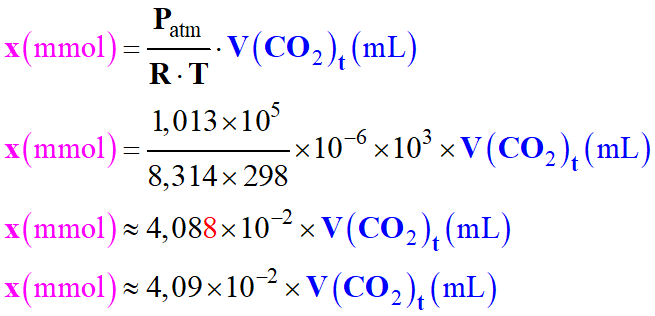
-
Avec le tableur Excel :
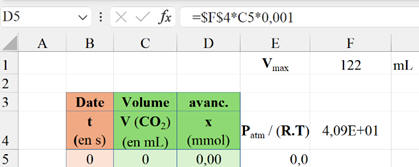
-
Dans la cellule D5, on tape
l’expression suivante : =$F$4*C5*0.001
-
Puis on recopie cette expression vers le bas autant
de fois que nécessaire.
-
Pour ce faire : On sélectionne la cellule concernée
(ici la cellule D5).
-
On se place en bas à droite de cette cellule avec
la souris
-
Lorsque le signe plus (+)
apparaît, on réalise un double clic gauche (souris).
-
Le calcul s’effectue.
- Tableau de valeurs :
|
Date |
Volume |
Avanc. |
|
t (en
s) |
V
(CO2)
(en mL) |
x (mmol) |
|
0 |
0 |
0,00 |
|
20 |
29 |
1,19 |
|
40 |
49 |
2,00 |
|
60 |
63 |
2,58 |
|
80 |
72 |
2,94 |
|
100 |
79 |
3,23 |
|
120 |
84 |
3,43 |
|
140 |
89 |
3,64 |
|
160 |
93 |
3,80 |
|
180 |
97 |
3,97 |
|
200 |
100 |
4,09 |
|
220 |
103 |
4,21 |
|
240 |
106 |
4,33 |
|
260 |
109 |
4,46 |
|
280 |
111 |
4,54 |
|
300 |
113 |
4,62 |
|
320 |
115 |
4,70 |
|
340 |
117 |
4,78 |
|
360 |
118 |
4,82 |
|
380 |
119 |
4,87 |
|
400 |
120 |
4,91 |
|
420 |
120 |
4,91 |
|
440 |
121 |
4,95 |
-
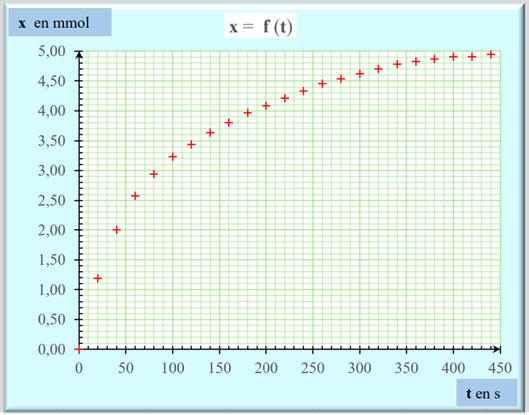
Représentation graphique :
-
L’avancement x
de la réaction est une fonction croissante du temps t.
-
La variation de l’avancement
x de la réaction diminue au cours du
temps pour s’annuler en fin de réaction.
e)-
Décrire l’évolution de la vitesse volumique de formation
de CO2
au cours du temps.
-
Description de l’évolution de la vitesse volumique
de formation de CO2
au cours du temps :
-
Avancement de la réaction :
x = n
(CO2)
-
Vitesse volumique de la réaction : en utilisant
l’avancement x de la réaction
-
Par définition :
-
La vitesse volumique de réaction
v (t)
à la date t, est la dérivée
par rapport au temps,
-
Du rapport entre l’avancement
x de la réaction et le volume
VS
du milieu réactionnel.
-
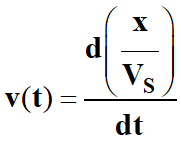
-
Lorsque l’on travaille à volume constant, on
obtient la relation suivante :
-
Relation :
-
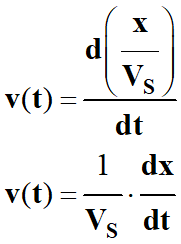
-
Au cours du temps, la vitesse volumique de la
réaction diminue car la variation de l’avancement de la réaction diminue
-
Vitesse d'apparition d'un produit .
-
-
La vitesse vapp
(P) d’apparition du produit
P, à la date
t1
est, par définition, égale à la dérivée de la fonction np
=
f (t)
au temps t1.
-
On écrit :
-
![]()
-
Graphiquement : cette vitesse est numériquement
égale à la valeur du coefficient directeur de la tangente
T à la courbe np =
f (t)
au point M1
d'abscisse t1.
-
Si le mélange
réactionnel a un volume constant V
au cours de la réaction, on peut dans ce cas suivre l'évolution de la réaction
en travaillant avec les concentrations :
-
On peut alors travailler avec la vitesse volumique
d’apparition du produit P :
-
Par définition :
-
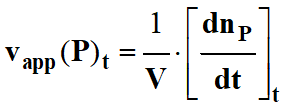
-
Dans le cas du dioxyde de carbone, on peut écrire :
-
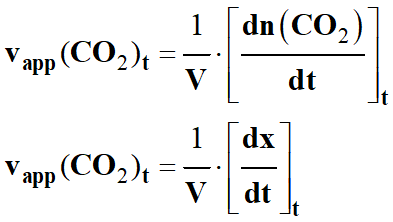
-
À la lecture du graphique, on remarque que la pente
de la tangente à la courbe diminue au cours du temps.
-
La vitesse volumique
d’apparition d’un réactif ou de disparition d’un produit diminue au cours du
temps.
-
La courbe x
= f (t)
tend vers une asymptote horizontale et le coefficient directeur de la tangente à
la courbe tend vers zéro.
-
La vitesse d’une transformation chimique est
maximale à l’instant initial.
-
Elle décroît ensuite et s’annule lorsque la
réaction est terminée.
-
Les réactifs sont consommés au fur et à mesure que
la réaction se poursuit.
-
Comme la concentration des réactifs est un facteur
cinétique, la diminution de la concentration des réactifs entraîne la diminution
de la vitesse.
-
Elle s’annule si le réactif limitant à totalement
disparue.
f)-
Définir le temps de demi-réaction
t1/2 .
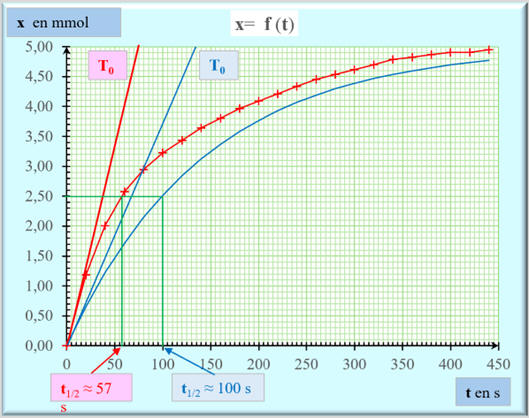
Déterminer graphiquement sa valeur.
-
Le temps de demi-réaction :
-
Le temps de demi-réaction t1/2 d’un système
chimique est la durée au bout de laquelle la moitié du réactif limitant a été
consommé.
-
Réactif limitant : le réactif limitant est l’ion
oxonium H3O+
(aq).
-
On peut déterminer t1/2
à partir de l’évolution de la quantité de matière nP
ou de la concentration d’un produit P
au cours du temps :
-
Le temps de demi-réaction t1/2 est la date pour
laquelle :
-
![]()
-
Dans le cas présent :
-
![]() ou
ou ![]()
-
Exploitation graphique :
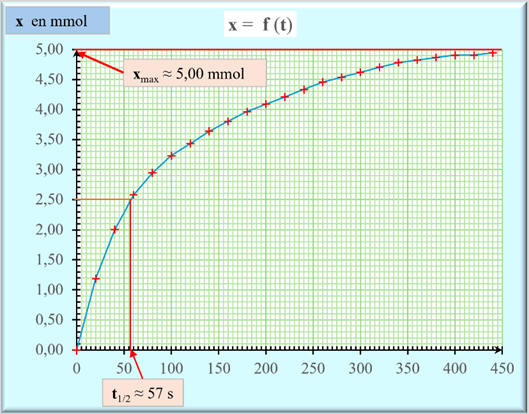
-
t1/2
≈ 57 s
-
Le temps de demi-réaction t1/2 permet d’évaluer
la durée nécessaire à l’achèvement de la transformation chimique étudiée.
-
L’expérience montre qu’un système siège d’une
réaction caractérisée par le temps de réaction t1/2
cesse pratiquement d’évoluer au bout d’une durée de l’ordre de quelques
t1/2
(4 à 7 suivant la précision recherchée).
-
Dans le cas présent, on peut considérer que la
réaction est terminée au bout de 400 s ( 7 ×57) environ.
g)-
La température de la grotte est généralement inférieure à
25 ° C. Préciser l’effet de cet abaissement de la température sur la vitesse
volumique initiale de formation de CO2.
-
Effet de cet abaissement de la température sur la
vitesse volumique initiale de formation de CO2.
-
La température fait partie des facteurs cinétiques.
-
De façon générale, une diminution de la température
a pour effet de ralentir l’évolution temporelle d’une réaction chimique.
-
En conséquence, l’abaissement de la température
entraîne une diminution de la vitesse initiale de formation du dioxyde de
carbone.
h)-
Compléter le graphique réalisé à la question
d)-, en représentant l’allure de
l’évolution de l’avancement en fonction du temps dans ce cas.
-
Allure de l’évolution de l’avancement en fonction
du temps :
-
Temps et évolution chimique : cinétique
et catalyse. . (2012)
Application : Suivi cinétique d'une
réaction chimique - Exploitation des résultats avec Latis-Pro
Modélisation macroscopique de l'évolution
d'un système.
Suivi cinétique par spectrophotométrie.
Vitesse d’une réaction chimique (2000)
Suivi temporel d'une réaction chimique.
Modélisation macroscopique de l'évolution
d'un système.
Vieillissement d'une eau de Javel
II-
Un colorant pour traiter
des infections.
-
Le vert de malachite est un composé de formule
C23H25ClN2
utilisé comme colorant.
-
En solution aqueuse, il forme les ions chlorure
Cl-
(aq) et les ions carbénium C23H25N2+
(aq), noté M+
(aq).
-
Toxique, le vert de malachite a pu aussi être
utilisé pour traiter les infections fongiques et bactériennes.
-
En milieu basique, l’ion M+
(aq) réagit avec l’ion hydroxyde HO-
(aq) entraînant la décoloration de la solution suivant une transformation totale
dont l’équation de réaction s’écrit :
M+
(aq) +
HO-
(aq) → MOH (aq)
-
La vitesse de consommation de l’ion
M+
(aq) peut s’écrire :
-
Vc
(M+)
= k . [HO-]α
. [M+]β
-
Les grandeurs α
et β sont des entiers.
-
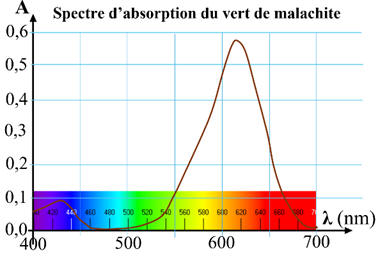
Seule l’espèce M+
absorbe dans le domaine du visible.
-
Solution de soude : Na+
(aq) + HO-
(aq)
-
Spectre d’absorption du vert de malachite :
-
Disque chromatique :
-
Couleur d’une solution de vert de malachite :

a)-
Protocole :
![]() Une
solution est préparée en introduisant :
Une
solution est préparée en introduisant :
-
20,0 mL d’une solution aqueuse de vert de malachite
-
De concentration en quantité d’ion carbénium
C (M+)
= 75,0 μmol . L-1 ;
-
75, 0 mL d’eau distillée.
![]() En
déclenchant simultanément le chronomètre, on ajoute :
En
déclenchant simultanément le chronomètre, on ajoute :
-
Un volume V
=5,00 mL d’une solution de soude
-
De concentration en quantité de matière d’ion
hydroxyde C (B)
= 100 mmol . L-1.
b)-
Résultats expérimentaux.
-
Les concentrations en quantité initiales
respectives des espèces M+
(aq) et HO-
(aq) après mélange sont notées :
-
[HO-]0
et [M+]0
-
L’absorbance A
(t) à une longueur d’onde
λ judicieusement choisie est
mesurée à différentes dates.
-
Tableau de valeurs :
|
Date |
Absorbance |
Dérivée |
|
t (en
min) |
A |
- dA / dt en min-1 |
|
0,00 |
0,858 |
0,0292 |
|
2,00 |
0,801 |
0,0273 |
|
4,00 |
0,749 |
0,0255 |
|
6,00 |
0,698 |
0,0238 |
|
8,00 |
0,652 |
0,0222 |
|
10,0 |
0,612 |
0,0208 |
|
12,0 |
0,571 |
0,0194 |
|
14,0 |
0,532 |
0,0181 |
|
16,0 |
0,498 |
0,0169 |
a)-
Protocole :
-
L’expérience précédente est renouvelée en modifiant
la concentration, C (B)
de la solution de soude.
-
Les volumes de solutions utilisées et la
concentration en quantité d’ion M+
restent identiques.
-
Une analyse des résultats permet de construire le
tableau ci-dessous, fournissant la valeur de :
-
k
. [HO-]α
pour les différentes valeurs de C
(B).
b)-
Résultats expérimentaux :
|
C
(B) (en mmol . L-1 |
200 |
300 |
400 |
|
k
. [HO-]α
( en min-1) |
6,70 × 10-2 |
10,3 × 10-2 |
13 ,6 × 10-2 |
a)-
En considérant l’expérience 1,
calculer les concentrations en quantité de matière initiales des espèces
M+
et HO-
après le mélange.
-
Concentrations en quantité de matière initiales des
espèces M+
et HO-
après le mélange :
-
Le mélange :
-
Solution aqueuse de vert de malachite :
V1 =
20,0 mL et C (M+)
= 75,0 μmol . L-1
-
Eau distillée : V
= 75,0 mL
-
Solution de soude : V2
= 5,00 mL et C (B)
= 100 mmol . L-1
-
Concentration des différentes espèces présentes à
l’instant initial (avec réaction) :
-
La concentration molaire volumique d’une espèce
chimique en solution est la quantité de matière n
de soluté présente dans un litre de solution.
|
Cas d’une espèce chimique
A |
|
|
|
► C (A)
: concentration molaire en soluté apporté en mol . L-1. ► n (A) : quantité de
matière de soluté apporté en mol. ► V = Vsol :
volume de la solution aqueuse obtenue en L. |
-
Espèces présentes dans la solution :
-
M+
(majoritaire) et HO-
(majoritaire), le solvant,
l’eau
(ultra-majoritaire) et les ions sodium
Na+
(majoritaire) présents
dans la soude.
-
Volume de la solution :
-
VS
= V +
V1 +
V2
-
VS
= 75,0 + 20,0 + 5,00
-
VS
≈ 100 mL
-
Concentration initiale en ions carbénium
M+
(aq) :
-
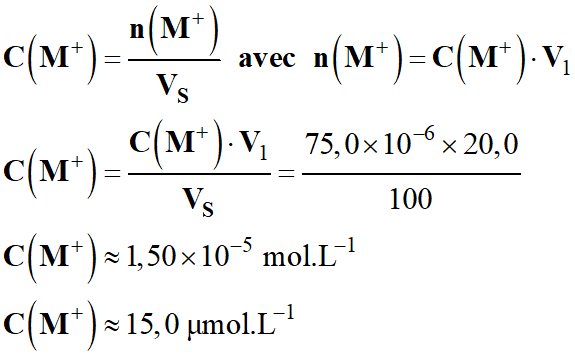
-
En conséquence :
-
[M+]0
≈ 15,0 μmol . L-1
-
Concentration initiale en ions hydroxyde
HO-
(aq) :
-
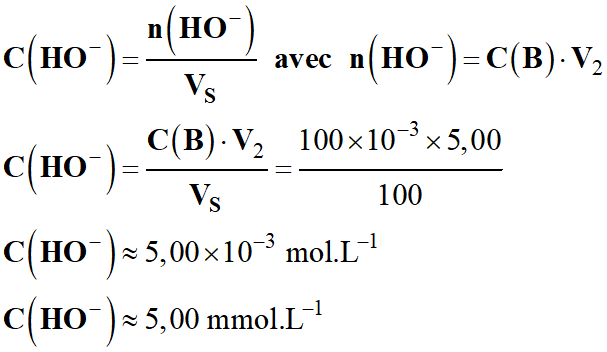
-
[HO-]0
≈ 5,00 mmol . L-1
-
On remarque que [HO-]0
>>
[M+]0
b)-
Montrer que la grandeur
k . [HO-]α
est presque constante au cours de la transformation. Par la suite, elle est
notée kapp.
-
Évolution de la grandeur k
. [HO-]α
au cours du temps t.
-
Lors du mélange, il se produit la réaction
suivante :
M+
(aq) +
HO-
(aq) → MOH (aq)
-
Cette réaction est considérée comme totale et
l’espèce HO-
(aq) est en large excès par rapport à l’espèce M+
(aq).
-
Tableau d’avancement de la réaction :
-
Quantité de matière initiale en ions carbénium
M+ :
-
n1 = n
(M+)
= C (M+)
. V1
-
n1 = n
(M+)
= 75,0 × 10-6
× 20,0 × 10-3
-
n1 = n
(M+)
= 1,50 μmol
-
Quantité de matière initiale en ions hydroxyde
HO-
(aq) :
-
n2 = n
(HO-)
= C (B)
. V2
-
n2 = n
(HO-)
= 100 × 10-3
× 5,00 × 10-3
-
n2 = n
(HO-)
= 1,50 μmol
-
L’ion carbénium est le réactif limitant. La
réaction s’arrête lorsqu’il est totalement consommé.
-
xmax
= n2
= n (HO-)
= 1,50 μmol
|
Équation |
M+
(aq) |
+ HO-
(aq) |
→ |
MOH
(aq) |
|
|
État du système |
Avanc. |
n
(M+) (μmol) |
n
(HO-) (μmol) |
|
n
(MOH) (mmol) |
|
État initial (mmol) |
x =
0 |
n1
≈ 1,5 |
n2
≈ 500 |
0 |
|
|
État intermédiaire |
x |
n1
– x |
n2
– x |
x |
|
|
État Maximal (μmol) |
xmax
= 1,5 |
n0
– xmax |
n2
– xmax |
xmax |
|
|
1,5 |
0,0 |
498,5 ≈ 499 |
1,5 |
||
-
Dans le mélange réactionnel, la quantité de matière
ions hydroxyde varie 1,5 pour 500, c’est-à-dire de 3 pour mille.
À l’instant initial : [HO-]0
≈ 5,00 mmol . L-1
-
En fin de réaction :
-
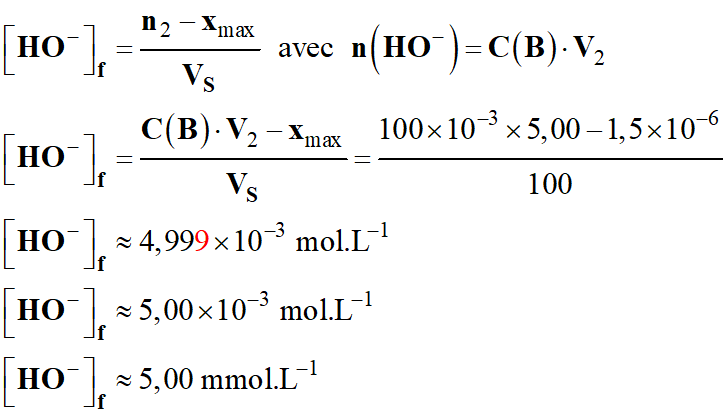
-
[HO-]f
≈ 5,00 mmol . L-1
-
On peut revenir à la relation suivante :;
-
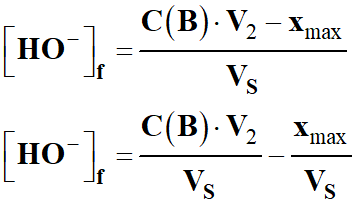
-
On divise l’expression par [HO-]0
- 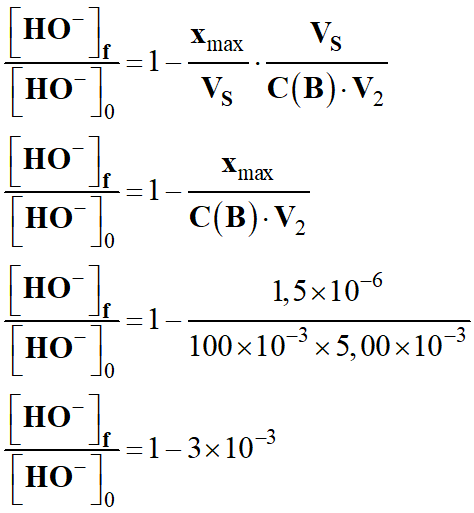
-
On peut considérer que :
-
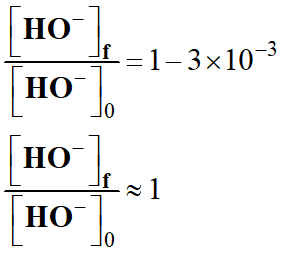
-
La grandeur k
. [HO-]α
est pratiquement constante au cours de la transformation.
c)-
Déterminer alors l’expression de la vitesse de
consommation de M+
en fonction de kapp,
[M+]
et β.
-
Expression de la vitesse de consommation de
M+
en fonction de kapp,
[M+]
et β :
-
La vitesse de consommation de l’ion
M+
(aq) peut s’écrire :
-
Vc
(M+)
= k . [HO-]α
. [M+]β
avec kapp
= k . [HO-]α
= cte
-
Vc
(M+)
= kapp
. [M+]β
d)-
Exprimer
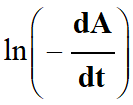 en fonction de A,
β,
kapp,
ainsi que le coefficient d’absorption molaire de M+,
noté ε et la longueur
ℓ de la solution traversée par le
faisceau de lumière.
en fonction de A,
β,
kapp,
ainsi que le coefficient d’absorption molaire de M+,
noté ε et la longueur
ℓ de la solution traversée par le
faisceau de lumière.
-
-
Pour les solutions suffisamment
diluées, l’absorbance A
est proportionnelle à la concentration C
de l’espèce colorée.
►
Définition :
|
L’absorbance d’une solution diluée contenant une espèce colorée
est proportionnelle à la
concentration (effective) C de cette espèce et à l’épaisseur ℓ (cm) de la
solution traversée par le faisceau lumineux. |
|
A
(λ) = ε (λ) . ℓ . C |
|
A :
absorbance : grandeur sans unité |
|
ℓ :
largeur de la cuve (épaisseur de la solution traversée) (cm) |
|
ε
(λ) : coefficient d’extinction molaire (mol– 1. L.
cm– 1) |
|
C :
concentration de l’espèce absorbante (mol . L– 1) |
-
ε (λ)
est appelé coefficient d’extinction molaire ou coefficient d’absorption molaire
-
Il dépend de la nature de l’espèce
dissoute et de la longueur d’onde de la radiation utilisée.
-
La courbe A
= f (C)
constitue la courbe d’étalonnage de la substance étudiée.
-
Elle permet de déterminer la
concentration d’une solution de la substance étudiée.
-
Elle permet donc de doser une espèce
chimique colorée.
-
Afin d’augmenter la sensibilité de la
méthode, on utilise la longueur d’onde qui correspond au maximum d’absorption de
la substance étudiée.
-
Cette méthode est alors beaucoup plus
précise que la méthode colorimétrique utilisant une échelle des teintes.
-
Remarque : la solution colorée doit
être suffisamment diluée,
-
C ≤ 1,0 × 10–2
mol . L–1, et le
spectrophotomètre ne doit pas saturer.
-
Plus simplement, on peut donner la relation de
Beer-Lambert suivante :
-
A =
ε . ℓ
. C
-
Comme la seule espèce colorée est l’ion carbénium
M+ :
-
A =
ε . ℓ
. [M+]
►
Vitesse volumique de disparition
d’un réactif R :
-
La vitesse vdisp
(R)t
de disparition, d’un réactif R,
est égale à l’opposé de la dérivée par rapport au temps de sa concentration :
-
![]()
-
Vitesse volumique de disparition de l’ion carbénium
M+ :
-
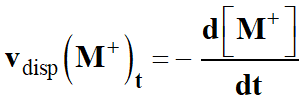
-
Avec les notations de l’énoncé :
-
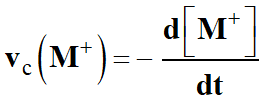
-
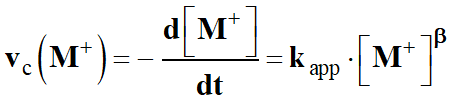
-
On utilise maintenant les propriétés de la fonction
logarithme népérien.
-
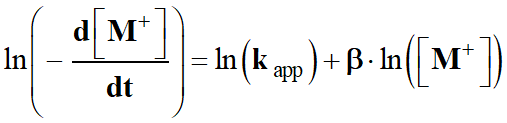
-
À partir de la loi de Beer-Lambert, on obtient
l’expression suivante :
-
A =
ε . ℓ
. [M+]
-
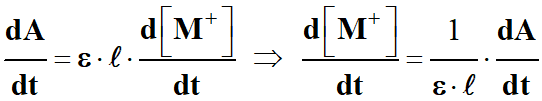
-
On remplace
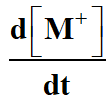 par son expression :
par son expression :
-
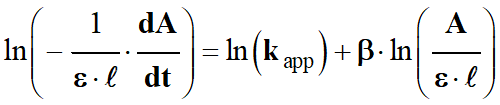
- 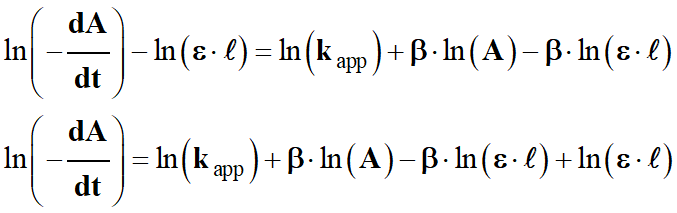
-
On regroupe les constantes
ε, ℓ
et kapp dans
un même terme :
-
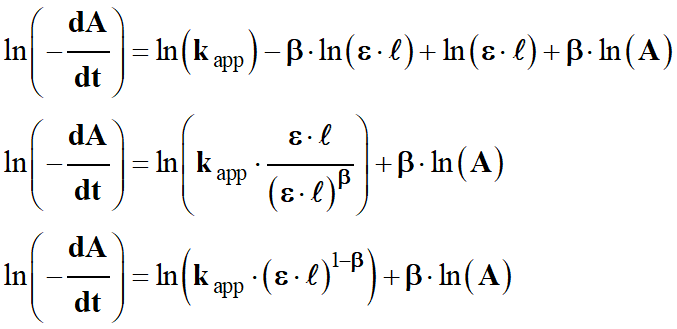
-
On est en présence d’une équation du type :
-
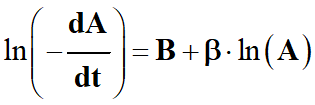 avec
avec ![]()
e)-
Déterminer la valeur de β
par l’analyse des résultats expérimentaux.
-
Tableau de valeurs :
|
Date |
Absorb. |
dérivée |
|
|
|
t (en
min) |
A |
- dA / dt en min-1 |
ln A |
ln(- dA/dt) |
|
0,00 |
0,858 |
0,0292 |
-0,1532 |
-3,534 |
|
2,00 |
0,801 |
0,0273 |
-0,2219 |
-3,601 |
|
4,00 |
0,749 |
0,0255 |
-0,2890 |
-3,669 |
|
6,00 |
0,698 |
0,0238 |
-0,3595 |
-3,738 |
|
8,00 |
0,652 |
0,0222 |
-0,4277 |
-3,808 |
|
10,0 |
0,612 |
0,0208 |
-0,4910 |
-3,873 |
|
12,0 |
0,571 |
0,0194 |
-0,5604 |
-3,942 |
|
14,0 |
0,532 |
0,0181 |
-0,6311 |
-4,012 |
|
16,0 |
0,498 |
0,0169 |
-0,6972 |
-4,080 |
-
On effectue une régression linéaire de
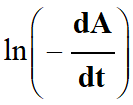 en fonction de ln
A.
en fonction de ln
A.
-
Droite de régression.
-
Graphique :
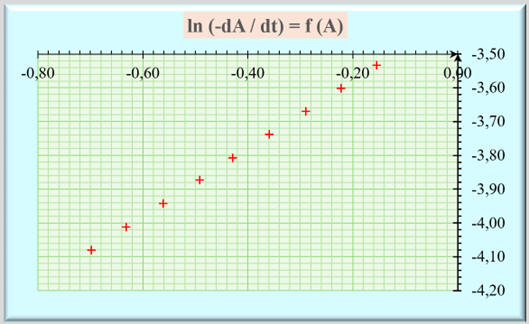
-
Les points sont sensiblement alignés.
-
On effectue une étude statistique avec le tableur
Excel :
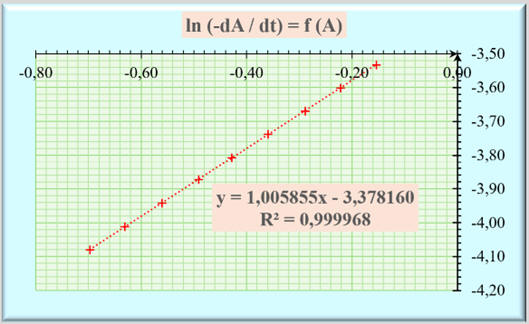
-
Traduction physique de l’équation donnée par le
tableur Excel :
-
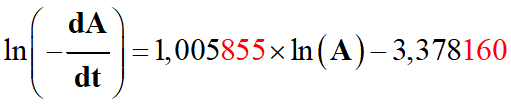
-
En gardant un nombre raisonnable de chiffres
significatifs :
-
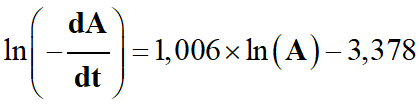
-
Valeur de la constante béta :
-
β ≈ 1,006 avec un
coefficient de détermination R2
≈ 0,999968 ≈ 1,000
-
La corrélation est excellente entre
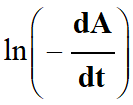 et
ln
(A).
et
ln
(A).
-
Comme β
est un entier : β = 1
f)-
À partir des résultats expérimentaux de
l’expérience 2, déterminer les valeurs
de α et de
k.
M+
(aq) +
HO-
(aq) → MOH (aq)
-
La vitesse de consommation de l’ion
M+
(aq) peut s’écrire :
-
Vc
(M+)
= k . [HO-]α
. [M+]β
-
De l’expérience 1, on tire :
-
Vc
(M+)
= k . [HO-]α
. [M+]
-
D’autre part :
-
Vc
(M+)
= Vc
(HO-)
= k . [HO-]α
. [M+]
-
Avec :
- 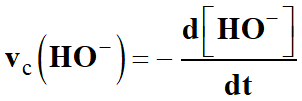
-
Les grandeurs α
et β sont des entiers.
-
Résultats expérimentaux :
|
C
(B) (en mmol . L-1 |
200 |
300 |
400 |
|
k
. [HO-]α
( en min-1) |
6,70 × 10-2 |
10,3 × 10-2 |
13 ,6 × 10-2 |
-
Quantité de matière initiale en ions hydroxyde
HO-
(aq) :
-
ni
(HO-)
= C (B)
. V2
-
Concentration initiale en ions hydroxyde
HO-
(aq) :
-
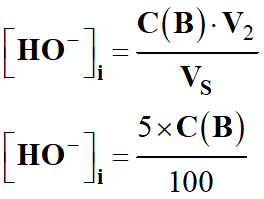
-
On va vérifier si une corrélation existe entre les
grandeurs ln ([HO-])
et ln (k . [HO-]α)
-
Pour simplifier la relation, on utilise la fonction
logarithme népérien :
-
ln (k
. [HO-]α)
= k +
α × ln ([HO-])
-
Tableau de valeurs :
|
C (B) |
k
. [HO-]α |
[HO-] |
ln ([HO-]) |
ln (k
. [HO-]α) |
|
(en mmol . L-1) |
( en min-1) |
(en mol . L-1) |
|
|
|
200 |
6,70E-02 |
0,010 |
-4,605 |
-2,703 |
|
300 |
1,03E-01 |
0,015 |
-4,200 |
-2,273 |
|
400 |
1,36E-01 |
0,020 |
-3,912 |
-1,995 |
-
Pour faire une régression linéaire, le nombre de
valeurs est dans ce cas très limité (3 valeurs).
-
Représentation graphique :
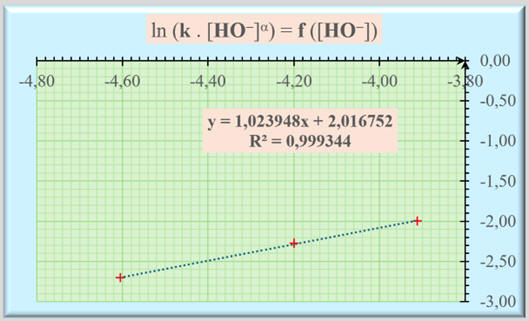
-
L’exploitation statistique permet d’écrire la
relation suivante :
-
ln (k
. [HO-]α)
≈ 2,016752
+ 1,023948
× ln ([HO-])
-
ln (k
. [HO-]α)
≈ 2,01 +
1,02 × ln ([HO-])
-
Comme la grandeur α
est un nombre entier : α = 1
-
k ≈ 2,01
-
On peut donner l’expression de la vitesse de
consommation de l’ion M+
(aq) :
-
Vc
(M+)
= k . [HO-]
. [M+]
-
Si la quantité de matière d’ions hydroxyde est en
large excès par rapport à la quantité de matière d’ions carbénium, alors :
-
Vc
(M+)
= kapp
. [M+]
-
-
Considérons la réaction chimique suivante :
a A
+ b B
→ c C +
d D
-
Une réaction chimique est d’ordre 1 par rapport au
réactif A, si lorsque le
réactif B est en large excès,
les vitesses volumiques de disparition des réactifs ou d’apparition des produits
sont proportionnelles à la concentration [A]t
de l’espèce A au cours du
temps :
-
Ainsi, on peut écrire :
-
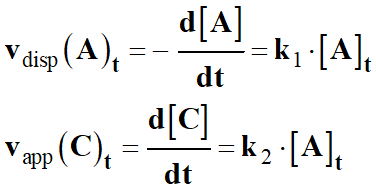
-
Pour la réaction étudiée :
M+
(aq) +
HO-
(aq) → MOH (aq)
-
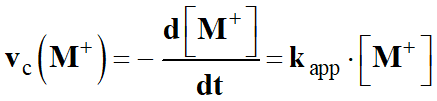
-
La réaction étudiée est ordre 1 par rapport à l’ion
carbénium.