|
|
Modélisation macroscopique de l'évolution d'un système |
|
|
|
|
|
2)- Influence de
la température.
3)- Influence de
la concentration des réactifs.
b)-
Expérience : La dismutation de l’eau oxygénée |
|
III- Loi de vitesse
d’ordre 1. 2)- Reconnaître
une loi de vitesse d’ordre 1. |
|
1)- Suivi cinétique d’une réaction chimique.
QCM r
Les facteurs cinétiques
|
|
Exercices : énoncé et corrcetion
Préparation à l’ECE : Étude d’un solvant : l’éthanoate d’éthyle
1)- Exercice 02
page 84 : Justifier une méthode expérimentale. 2)- Exercice 04
page 84 : Étudier l’influence d’un catalyseur. 3)- Exercice 05
page 85 : Exploiter des informations sur la catalyse. 4)- Exercice 06
page 85 : Déterminer un temps de demi-réaction. 5)- Exercice 08
page 85 : Déterminer une vitesse d’apparition. 6)- Exercice 10
page 86 : Vérifier un ordre de
réaction. 7)- Exercice 12
page 86 : Déterminer la valeur d’une dérivée. 8)- Exercice 14
page 87 : Modélisation d’une courbe. 9)- Exercice 15
page 87 : L’eau de Javel. 10)- Exercice 19
page 87 : Analyse médicale. 11)- DS N° 01 :
Le parfum de poire (30 min) : exercice 22 page 90. 12)- DS N° 02 :
Ordre d’une réaction (30 min) : Exercice 23 page 87. 13)- DS N° 03 :
Vitesse d’une réaction (30 min) : Exercice 24 page 91. |
-
L’étude de l’évolution
temporelle de systèmes chimiques constitue la cinétique chimique.
-
Certains paramètres
agissent sur la rapidité d’évolution d’un système chimique.
-
Ces paramètres sont
appelés : les facteurs cinétiques de la réaction.
►
Classification
cinétique :
-
À l’échelle humaine,
on distingue trois catégories de transformations chimiques :
|
Les
transformations quasi instantanées.
-
On dit que
la réaction est rapide.
-
Sa durée
est inférieure à la seconde.
-
On ne peut
pas observer l’évolution de la réaction à l’œil.
-
C’est le
cas de certaines réactions de précipitation.
-
La
formation du précipité se fait instantanément. |
|
Les transformations lentes.
-
Une
réaction est lente si sa durée est de l'ordre de quelques secondes à
plusieurs minutes.
-
On
peut observer l'évolution de la réaction. |
|
Les transformations extrêmement lentes
ou infiniment lentes.
-
Une
réaction est infiniment lente si sa durée est de l'ordre de
plusieurs jours à plusieurs semaines.
-
On ne peut
pas observer l’évolution de la réaction à l’œil. |
2)-
Influence de la température.
a)-
Oxydation des ions iodure par
de peroxyde d’hydrogène en milieu acide.
►
Expérience :
![]() A l’instant t =
0, 0
s,
A l’instant t =
0, 0
s,
|
Dans un
bécher de
250 mL, on verse :
-
Un volume V3 = 100 mL d’une solution
d’iodure de potassium, C3 = 0,20 mol . L–1
-
Un
volume V1 = 100 mL d’une solution d’eau
oxygénée, C1 = 5,6 × 10–2 mol . L–1.
-
On ajoute quelques gouttes
d’acide sulfurique concentré. |
-
Remarque :
-
Le peroxyde
d’oxygène
H2O2 (aq) (eau oxygénée) est l’oxydant du couple :
-
H2O2 (aq) /
H2O (ℓ)
-
Observations :
-
Au cours du temps,
la solution contenue dans le bécher prend une teinte brun-orangé de plus en plus
intense.

-
On peut observer
l’évolution de la transformation grâce au changement de teinte de la solution.
-
Le changement de
teinte est dû à la formation de diiode en milieu aqueux (pour simplifier).
- Autre couple qui intervient : I2 (aq) / I– (aq)
- L'ion iodure I– (aq) est le réducteur du couple I2 (aq) / I– (aq)
►
Interprétation.
-
Il se produit une
réaction d’oxydoréduction entre les ions iodure et l’eau oxygénée en milieu
acide.
-
Cette
transformation est lente par rapport à l’échelle humaine. On peut suivre son
évolution.
![]() Écrire l’équation de
la réaction chimique.
Écrire l’équation de
la réaction chimique.
|
H2O2
(aq) |
+ 2 e– |
+ 2 H+
(aq) |
|
2 H2O
(ℓ) |
|
|
|
|
2 I–
(aq) |
|
I2
(aq) |
+ 2 e– |
|
H2O2
(aq) |
+ 2 H+
(aq) |
+ 2 I–
(aq) |
→ |
2 H2O
(ℓ) |
+ I2
(aq) |
b)-
Mise en évidence du rôle de
la température des réactifs :
►
Expérience 1 :
Oxydation des ions iodure par de peroxyde d’hydrogène en milieu acide.
-
On observe
l’évolution de la coloration de la solution au cours du temps à différentes
températures.
-
Tableau :
|
Becher 1 |
Becher 2 |
Becher 3 |
|
5 mL d’iodure
de potassium 0,10 mol . L–1
L |
5 mL d’iodure
de potassium 0,10 mol . L–1 |
5 mL d’iodure
de potassium 0,10 mol . L–1 |
|
5 mL d’acide
sulfurique
1 mol . L–1 |
5 mL d’acide
sulfurique
1 mol . L–1 |
5 mL d’acide
sulfurique
1 mol . L–1 |
|
9 mL d’eau |
9 mL d’eau |
9 mL d’eau |
|
+ glace
θ = 0 ° C |
θ
= 20 ° C |
θ
= 40 ° C |
|
Un certain
temps !!! |
1 min 45 s |
40 s |
►
Conclusion.
-
La température d’un
mélange réactionnel est un facteur cinétique.
-
L’avancement
temporel d’une réaction augmente généralement avec la température.
-
La vitesse de
formation ou de disparition d'un corps augmente généralement avec la
température.
c)-
Utilisation de ce facteur
cinétique.
►
Accélération et
déclenchement d’une réaction chimique.
-
Certaines réactions,
trop lentes à température ambiante, sont réalisées à température plus élevée,
ainsi elles deviennent plus rapides.
-
Pour accélérer la
cuisson des aliments, on utilise des autocuiseurs.
-
En augmentant la
température, on diminue le temps de cuisson des aliments.
-
Les mélanges
comburant-combustible sont en général cinétiquement inertes à température
ambiante :
-
Pour initier la
réaction, on utilise une allumette ou une étincelle entre les deux électrodes
d’une bougie de moteur.
-
C’est le point chaud
qui déclenche la combustion.
►
Ralentissement ou
arrêt d’une réaction chimique.
-
La trempe
:
-
Elle désigne le
refroidissement brutal d’un milieu réactionnel pour le rendre cinétiquement
inerte.
-
On
utilise ce procédé lors de dosages en séances de travaux pratiques pour arrêter
la réaction à un instant donné
t.
-
Si le refroidissement
est assez rapide, le système n’évolue plus et conserve la composition qu’il
avait juste avant le refroidissement.
-
D’autre part, pour
ralentir les réactions indésirables, on place les aliments au réfrigérateur ou
au congélateur.
3)- Influence de la concentration des réactifs.
a)-
Expérience 2 : Dismutation de
l’ion thiosulfate en milieu acide.
![]() Dans un bécher de 100
mL, on verse :
Dans un bécher de 100
mL, on verse :
-
45 mL de thiosulfate
de sodium de concentration C1
= 0,13 mol / L,
-
5 mL de solution
d’acide chlorhydrique de concentration C2
= 0,10 mol / L.
-
on
observe la formation d’un précipité qui trouble peu à peu la solution.
-
La transformation est
lente, on peut observer son évolution.
►
Interprétation :
-
Le précipité obtenu
est un précipité jaune de soufre.
-
Couples mis en jeu :
S2O32–
(aq)
/ S
(s) et SO2
(aq) / S2O32–
(aq)
![]() Écrire
l’équation de la réaction de dismutation.
Écrire
l’équation de la réaction de dismutation.
-
On dit que l’ion
thiosulfate se dismute car il apparaît dans deux couples différents en tant que
réducteur dans un couple et oxydant dans l’autre couple.
|
( S2O32– (aq) + 6
H
+(aq)
+ 4
e
–
|
|
(
S
2O32
– (aq) + H
2O
(ℓ)
|
|
2
S2O32– (aq) + 4
H
+(aq)
→ 2
S (s) + 2 SO2 (aq) + 2
H2O
(ℓ) |
-
La réaction de
dismutation de l’ion thiosulfate en milieu acide est une transformation lente.
b)-
Influence de la concentration
des réactifs.
►
Principe :
-
On utilise la réaction
précédente.
-
En milieu acide, l’ion
thiosulfate réagit lentement avec les ions hydrogène et donne un précipité de
soufre qui reste en suspension.
-
La solution devient
peu à peu opaque. On utilise ce phénomène pour évaluer la vitesse moyenne de
formation de soufre.
- On place, avant le début de l’expérience, sous le bécher, une feuille de papier portant une croix à l’encre noire.
- On déclenche le chronomètre au moment où l’on mélange la solution
de thiosulfate de sodium et l’acide chlorhydrique.
-
On note la durée
nécessaire
Δt
pour que la croix ne soit plus visible.
-
Pour que l’épaisseur à
travers laquelle on observe la croix soit toujours la même, on utilise des
béchers identiques et des volumes de solutions identiques.
-
On admet que la
quantité de matière
nd
de soufre nécessaire à la disparition du motif
est la même dans toutes les expériences.
![]() Influence de la
concentration de la solution en ions thiosulfate.
Influence de la
concentration de la solution en ions thiosulfate.
-
Dans un bécher de 100
mL, on verse :
-
45 mL de thiosulfate
de sodium de concentration
C1.
-
5 mL de solution
d’acide chlorhydrique de concentration
C2
= 0,10 mol / L.
-
tableau :
|
C1
(mol / L) |
0,13 |
0,26 |
0,39 |
|
Δt
(s) |
108 |
72 |
35 |
![]() Influence de la
concentration de la solution d’acide chlorhydrique.
Influence de la
concentration de la solution d’acide chlorhydrique.
-
Dans un bécher de 100
mL, on verse :
-
45 mL de thiosulfate
de sodium de concentration
C1
= 0,13 mol / L,
-
5 mL de solution
d’acide chlorhydrique de concentration
C2
.
-
tableau :
|
C1
(mol
/ L) |
0,10 |
0,20 |
0,30 |
|
Δt
(s) |
1
min 30 s |
45 s |
22
s |
►
Conclusion :
-
De façon générale,
-
L’évolution d’un
système chimique est d’autant plus rapide que les concentrations des réactifs
sont élevées.
|
Un catalyseur est une espèce chimique qui
accélère une réaction chimique.
Au cours de la
transformation, il est consommé puis régénéré.
En conséquence,
sa formule n’apparaît pas dans l’équation de la réaction. |
b)-
Expérience : La dismutation de l’eau oxygénée
►
Étude de la solution
d’eau oxygénée.
![]() Eau oxygénée à 20
volumes :
Eau oxygénée à 20
volumes :
-
Le peroxyde
d’hydrogène présent dans l’eau oxygénée n’est pas stable.
-
Il est impliqué dans
deux couples oxydant / réducteur :
-
Couple 1 :
H2O2
(aq) / H2O
(ℓ)
-
Couple 2 :
O2
(g) / H2O2
(aq)
-
On peut envisager une
réaction entre H2O2
(aq)
, oxydant du couple 1 et
H2O2
(aq) , réducteur du couple 2 :
-
Cette
réaction est appelée réaction de
dismutation.
-
La transformation
associée est spontanée mais très lente à la température ordinaire.
|
2
H2O2
(aq) → O2
(g) + 2
H2O
(ℓ) |
-
Cette réaction est
très lente.
-
Si l’on verse de l’eau
oxygénée dans un bécher, il n’est pas possible d’observer un dégagement de
dioxygène.
►
Étude de la solution
d’eau oxygénée en présence, d’ions fer II, ions fer III et de platine.
![]() Bécher
A : eau oxygénée
seule.
Bécher
A : eau oxygénée
seule.
![]() Bécher
B : eau oxygénée +
solution aqueuse de sulfate de fer II
Bécher
B : eau oxygénée +
solution aqueuse de sulfate de fer II
![]() Bécher
C : eau oxygénée +
solution de chlorure de fer III
Bécher
C : eau oxygénée +
solution de chlorure de fer III
![]() Bécher
D : eau oxygénée +
fil de platine
Bécher
D : eau oxygénée +
fil de platine
►
Observations :
-
Dans le bécher
A, pas d’évolution
visible.
-
Dans les autres
béchers, on observe un dégagement intense de dioxygène.
On observe un dégagement gazeux de dioxygène
Apparition de bulles de dioxygène à la surface du fil de platine
ZOOM
►
Conclusion
-
Les ions fer II, les
ions fer III et le platine accélèrent la réaction de dismutation du peroxyde
d’hydrogène.
- Ce sont des catalyseurs de la réaction de dismutation du peroxyde d’hydrogène.
►
La dismutation de
l’eau oxygénée en présence d’ions fer III.
-
Grâce à la présence du
catalyseur, on remplace une étape lente par deux étapes rapides.
-
Étape 1 : réaction
entre l’eau oxygénée est les ions fer III. Réaction rapide :
|
|
H2O2
(aq) |
|
O2
(g) + 2 H+ (aq) + 2 e– |
|
|
2 ( |
Fe3+
(aq) + e– |
|
Fe
2+
(aq) |
) |
|
|
H2O2
(aq) + 2 Fe3+ (aq) |
→ |
2
Fe2+ (aq) + O2 (g) +
2 H+ (aq) |
(1) |
-
étape
2 : réaction entre l’eau oxygénée et les ions fer II.
|
|
H2O2
(aq) + 2 H + (aq) + 2 e– |
|
2 H2O
(ℓ) |
|
|
2 ( |
Fe2+
(aq) |
|
Fe
3+ (aq) + e – |
) |
|
|
H2O2
(aq) + 2 Fe2+ (aq) + 2 H+ (aq) |
→ |
2 Fe3+
(aq) + 2 H2O (ℓ) |
(2) |
-
Bilan global de la
réaction : Il faut combiner (1) et (2).
|
|
H2O2
(aq) + 2 Fe3+ (aq) |
→ |
2 Fe2+
(aq) + O2 (g) + 2 H+
(aq) |
(1) |
|
|
H2O2
(aq) + 2 Fe2+ (aq) + 2 H+ (aq) |
→ |
2 Fe3+
(aq) + 2 H2O (ℓ) |
(2) |
|
|
H2O2
(aq) + H2O2
(aq) |
→ |
O2
(g) + 2 H2O (ℓ) |
|
-
Le catalyseur
d’apparaît pas dans le bilan de la réaction.
c)-
Caractéristiques d’un
catalyseur.
-
Un catalyseur est une
espèce chimique qui accélère une réaction chimique.
-
La formule du
catalyseur n’apparaît pas dans l’équation de la réaction.
-
Un catalyseur modifie
la nature des étapes permettant de passer des réactifs aux produits.
-
La réaction globale
lente est remplacée par plusieurs réactions rapides.
►
Catalyse homogène :
- La catalyse est dite homogène lorsque le catalyseur et le mélange réactionnel constituent une seule phase (forment un mélange homogène).
- C’est le cas des gaz et des liquides
miscibles.
- Exemples : dismutation de l’eau oxygénée en présence d’ions fer II ou d’ions fer III.
►
Catalyse hétérogène :
-
La catalyse est dite
hétérogène lorsque le catalyseur et le milieu réactionnel se trouvent dans des
phases différentes.
-
Exemples :
-
Expérience de la lampe
sans flamme (on utilise un fil de cuivre chauffé comme catalyseur)
|
|
|
Cu |
|
|
|
C2H5OH
|
+ O2 |
→ |
CH3CHO |
+ 2 H2O |
|
On utilise un fil de cuivre chauffé comme catalyseur Vapeur d'éthanol en présence de cuivre. Le fil de cuivre reste rouge orangé incandescent pendant l'expérience. |
-
Dismutation de l’eau
oxygénée catalysée par un fil de platine.
|
|
|
Pt |
|
|
|
H2O2 (aq)
|
+
H2O2
(aq) |
→ |
O2 (g) |
+ 2 H2O (ℓ) |
►
Catalyse enzymatique :
-
La catalyse est
enzymatique lorsque le catalyseur est une enzyme.
-
Les enzymes sont des
catalyseurs biologiques qui permettent aux transformations chimiques nécessaires
à la vie de s’effectuer à vitesse élevée.
-
Les enzymes sont des
protéines.
-
Le nom d’une enzyme
indique souvent la transformation mise en jeu :
-
L’amylase transforme
l’amidon en maltose.
-
La saccharase catalyse
l’hydrolyse du saccharose en glucose et fructose.
-
Les réductases
catalysent les réductions des groupes carbonyles, acides et esters.
-
Les enzymes sont très
utilisées dans l’industrie agroalimentaire :
-
Fabrication du pain,
préparation de boissons fermentées, conservation des aliments, …
-
Exemple : l’hydrolyse
de l’amidon au laboratoire : il faut travailler à température élevée et en
milieu fortement acide.
5)- Autres facteurs cinétiques.
►
L’éclairement :
-
Pour accélérer
certaines réactions, on peut utiliser l’énergie lumineuse.
-
L’éclairement d’un
milieu réactionnel avec une radiation de longueur d’onde appropriée peut
accélérer une réaction chimique.
-
Exemple : la synthèse
chlorophyllienne
-
Les végétaux, grâce à
leur chlorophylle et grâce à l’énergie solaire transforment le dioxyde de
carbone CO2
atmosphérique en molécules organiques, le glucose :
|
|
Lux E |
|
|
6 CO2 (g) + 6 H2O
(ℓ) |
→ |
C6
H12O6 (aq) + 2 O2
(g) |
|
|
|
Glucose
|
-
E
= h .
υ
-
C’est la synthèse
chlorophyllienne.
►
Le solvant :
-
Le solvant peut être
un facteur cinétique.
-
Ainsi, certaines
réactions chimiques sont plus rapides dans l’eau que dans l’éthanol.
-
Exemple :
|
(CH3)3
COH |
+
Cl– |
→ |
(CH3)3
CCl |
+
HO– |
|
2-méthylpropan-2-ol |
Ion
chlorure |
|
2-chloro-2-méthylpropane |
Ion
hydroxyde |
II-
La vitesse d’évolution d’un système.
-
Considérons la
réaction naturelle suivante :
a . A
+ b . B
→
c . C
+
d . D
-
A
et B sont
les réactifs,
C et
D sont les produits
et a,
b,
c et
d sont les
coefficients stœchiométriques.
-
Pour connaître
l'évolution d'une réaction chimique, il suffit de connaître à chaque instant la
quantité de matière présente de l'une des espèces chimiques.
-
Exemple : Considérons
la réaction chimique suivante.
-
Au
temps t
= 0 s
|
On mélange :
-
V1 = 100 mL d'une
solution de peroxodisulfate de potassium C1
= 0,05 mol . L–1
-
V2 = 100 mL d'une
solution de d'iodure de potassium C1
= 0,5 mol . L–1 |
-
Il se produit la
réaction suivante :
|
S2O82–
(aq) + 2 I– (aq) → 2 SO42–
(aq) + I2 (aq) |
-
Tableau d’avancement :
|
Équation
|
S2O82–
(aq) |
+ 2
I– (aq) |
→
|
2
SO42–
(aq) |
+ I2 (aq) |
|
|
État du
système
|
Avancement
|
n
(S2O82–)
|
n
(I–)
|
|
n
(SO42–)
|
n
(I2) |
|
État initial
(mol) |
x =
0
|
n1
|
n2
|
0,0 |
0,0 |
|
|
Au cours
de la
transformation
|
x |
n1
- x |
n2
– 2
x |
2 x
|
x |
|
|
État final
(mol) |
x = xmax
|
n1
– xmax
|
n2
–
2
xmax |
2 xmax
|
xmax |
|
-
x
est lié à « l’avancement de la réaction » :
-
x
≤ n1 et 2
x ≤
n2
-
Si par dosage, on
détermine la quantité de matière x
en diiode au temps t,
on peut en déduire les quantités de matière des autres espèces présentes dans le
milieu réactionnel.
-
Si le
mélange réactionnel a un volume constant
V
au cours de la réaction, on peut dans ce cas suivre l'évolution de la réaction
en travaillant avec les concentrations.
-
Au cours de la
réaction, les produits se forment et les réactifs disparaissent.
►
Vitesse d’apparition
d’un produit ou de disparition d’un réactif :
-
On suit l'évolution de
la quantité de matière d'un produit au cours du temps :
np = f
(t).
-
Ou on suit l’évolution
de la quantité de matière d’un réactif au cours du temps : :
nR = g
(t)
►
Vitesse
moyenne d’apparition d'un produit P.
|
-
Par définition, la vitesse
moyenne d'apparition du produit P :
-
-
Cette
vitesse est un nombre positif et l'unité S.I : mol / s. - Elle est numériquement égale au coefficient directeur de la droite passant
par les points M1 et M2
d'abscisses t1 et t2.
|
|
►
Vitesse
moyenne de disparition d'un réactif R.
|
-
Par
définition, la vitesse moyenne de disparition du réactif R :
-
-
Cette
vitesse est un nombre positif et l'unité S.I : mol / s. - Elle est numériquement égale à l'opposé du coefficient directeur de la droite passant par les points M1 et M2
d'abscisses t1 et t2.
|
|
►
Vitesse
d'apparition d'un produit P.
|
- La vitesse va(P) d’apparition du produit P à la date t1 est, par définition, la limite de la vitesse moyenne d'apparition de ce même produit entre t1 et t2 quand
t2
tend vers t1.
-
On écrit :
-
- Cette limite est égale à la valeur prise par la dérivée de la fonction np = f (t)
au temps t1.
-
On écrit :
-
- Graphiquement : cette vitesse est numériquement égale à la valeur du coefficient directeur de la tangente T à la courbe
np = f
(t) au point M1
d'abscisse t1.
|
 |
►
Vitesse
de disparition d'un réactif R.
|
- La vitesse vd (R) de disparition du réactif R à la date t1 est, par définition, la limite de la vitesse moyenne de disparition de ce même réactif entre t1
et t2
quand t2
tend vers t1.
-
On écrit :
-
- Cette limite est égale à l'opposé de la valeur prise par la dérivée de la fonction nR = g (t)
au temps t1.
-
On écrit :
- - Graphiquement : cette vitesse est numériquement égale à l'opposé de la valeur du coefficient directeur de la tangente T à la
courbe
nR = g
(t) au
point M1
d'abscisse t1.
|
|
- Si le
mélange réactionnel a un volume constant
V
au cours de la réaction, on peut dans ce cas suivre l'évolution de la réaction
en travaillant avec les concentrations :
- Dans
le cas d’un produit de la réaction :
-
nP
= [P]
. V avec
V
=cte.
-
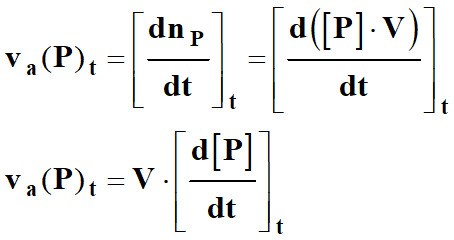
-
On
définit alors la vitesse volumique d’apparition du produit
P
en faisant intervenir la concentration :
-
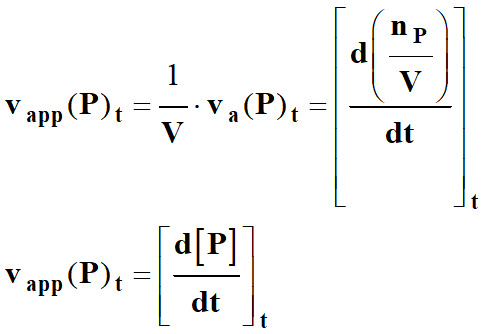
-
Dans ce
cas l’unité de vitesse volumique : mol .L–1
. min–1
►
Vitesse volumique
d’apparition d’un produit P :
-
La
vitesse volumique d’apparition
vapp (P)ti d’un
produit P
à l’instant ti
est assimilée au taux de variation de sa concentration [P]
entre les instants proches
ti et
ti+1 :
-
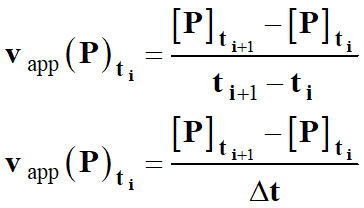
-
Lorsque
l’on fait tendre Δt → 0,
-
Le taux
de variation de la concentration [P]
tend vers le nombre dérivé de [P]
à l’instant considéré.
►
Vitesse volumique
d’apparition d’un produit P :
|
- La vitesse vapp (P)t d’apparition ,d’un produit P, est égale
à la dérivée par rapport au temps de sa concentration :
-
|
►
Remarque :
-
À
l’instant t1,
la vitesse vapp
(P)t1 est
aussi égale au coefficient directeur de la tangente à la courbe [P]
= f (t)
donnant l’évolution de la concentration du produit
P
en fonction du temps
t.
-
Représentation
graphique :
-
On peut aussi définir
la vitesse de disparition d’un réactif dans un volume constant.
-
Comme
on veut que cette grandeur soit positive, on la définit comme l’opposé du taux
de variation de la concentration [R].
►
Vitesse volumique de
disparition d’un réactif R :
-
La
vitesse volumique de disparition
vdisp
(R)ti d’un
réactif R
à l’instant ti
est assimilée à l’opposé du taux de variation de sa concentration [R]
entre les instants proches
ti et
ti+1 :
-
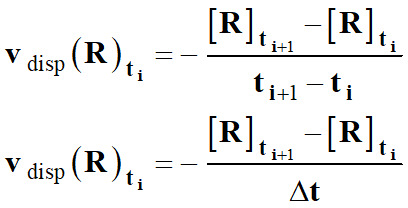
-
Lorsque
l’on fait tendre Δt → 0,
-
Le taux
de variation de la concentration [R]
tend vers l’opposé du
nombre dérivé de [R] à l’instant considéré.
►
Vitesse volumique de
disparition d’un réactif R :
|
- La vitesse vdisp (R)t de disparition, d’un réactif R, est égale
à l’opposé de la dérivée par rapport au temps de sa concentration :
-
|
►
Remarque :
-
À
l’instant t1,
la vitesse vdisp
(R)t1 est
aussi égale à l’opposé du coefficient directeur de la tangente à la courbe [R]
= f (t)
donnant l’évolution de la concentration du réactif
R
en fonction du temps
t.
-
Représentation
graphique :
►
Vitesse volumique et
unités :
-
La
vitesse volumique peut s’exprimer en mol . L–1
. s–1
-
On peut
utiliser aussi : mol . L–1
. min–1
|
- Le temps de demi-réaction t1/2 d’un système chimique
est la durée au bout de
laquelle la moitié du réactif limitant a été consommé. |
-
À la
date t
= 0, la concentration initiale du réactif
A
est [A]0.
-
Le
temps de demi-réaction t1/2
est la date pour laquelle :
-
![]()
-
Détermination
graphique :
►
Remarque 1 :
-
Le
temps de demi-réaction t1/2
dépend
en général de la concentration initiale du réactif
A.
-
Le
temps de demi-réaction t1/2
n'est pas caractéristique de la substance
A.
-
Le
temps de demi-réaction t1/2
permet d’évaluer la durée nécessaire à l’achèvement de la transformation
chimique étudiée.
|
-
L’expérience montre qu’un système siège d’une réaction caractérisée |
►
Remarque 2 :
-
On peut
déterminer t1/2
à partir de l’évolution de la concentration d’un produit
P
au cours du temps :
-
Le
temps de demi-réaction t1/2
est la date pour laquelle :
-
![]()
-
Détermination
graphique :
3)- Méthode de suivi cinétique.
-
Le
suivi cinétique d’une réaction consiste à déterminer expérimentalement la
relation existant entre la quantité de matière (ou la concentration) d’un
réactif R
ou d’un produit P
et le temps t.
-
Le but
est la détermination expérimentale de :
nR
= f
( t) ou [R]
= g
(t).
-
Pour ce faire :
-
On peut mesurer une
grandeur physique comme :
-
l’absorbance, la
conductivité, la pression ou le volume,…
-
grâce à un capteur.
-
On peut réaliser des
titrages successifs de l’une des espèces, en prélevant toujours le même volume
du mélange réactionnel à différentes dates.
-
Dans ce cas :
-
On
prélève un échantillon de volume
V du mélange réactionnel ;
-
On
réalise la trempe avec dilution à différentes dates
t,
pour stopper la réaction ;
-
On détermine la
concentration d’une espèce chimique présente par titrage.
III-
Loi de vitesse d’ordre 1.
-
Considérons la
réaction chimique suivante :
a A
+ b B
→ c C +
d D
|
Une réaction chimique est d’ordre 1 par rapport au réactif
A,
si lorsque le
réactif B est en large excès, les vitesses
volumiques de disparition des réactifs ou
d’apparition des produits sont proportionnelles à la concentration
[A]t de
l’espèce A au cours du temps : Ainsi, on peut
écrire :
|
►
Exemple : La
dismutation de l’eau oxygénée :
-
Équation de la
réaction :
|
2
H2O2
(aq) → O2
(g) + 2
H2O
(ℓ) |
-
Cette réaction est
d’ordre 1 par rapport au peroxyde d’hydrogène.
-
On peut donc écrire :
-
Cas
d’un réactif R :
-
![]()
-
Cas
d’un produit P :
-
![]()
-
Remarque :
k1 et
k2
sont des constantes positives.
2)- Reconnaître une loi de vitesse d’ordre 1.
-
Considérons la
réaction chimique suivante :
a A
+ b B
→ c C +
d D
-
Lorsque
le réactif B est en large excès, il existe
plusieurs méthodes pour vérifier que cette réaction est d’ordre 1 par rapport au
réactif A :
►
Méthode 1 :
-
Il faut
vérifier que le temps de demi-réaction
t1/2
est indépendant de la concentration initiale [A]0
de l’espèce A.
►
Méthode 2 :
-
Il faut vérifier que
les vitesses volumiques de disparition des réactifs ou d’apparition des produits
sont proportionnelles à la
concentration [A]t
de l’espèce A
au cours du temps.
►
Méthode 3 :
-
Il faut
vérifier que l’évolution de la concentration [A]t
de l’espèce A
au cours du temps obéit à une loi exponentielle du type :
-
[A]t
= [A]0
. exp
(- k .
t)
-
[A]t
= [A]0
.
e
-
k
.
t
►
La fonction
exponentielle :
-
C’est
la fonction f (x),
notée
ex telle
que :
-
f
(0) = 1 et f’
(x) =
f (x)
-
C’est
la fonction réciproque de la fonction logarithme népérien, notée
ln
x,
-
Relation : ln (ex) =
x
-
Représentation
graphique de ex :
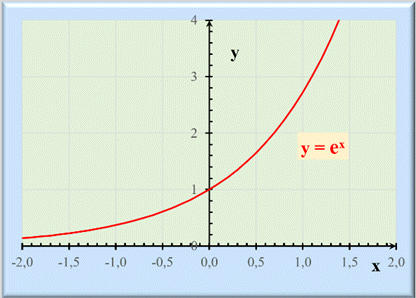
►
Remarques :
-
Influence de la concentration initiale [A]0
de l’espèce
A :
-
[A1]0
> [A2]0
> [A3]0
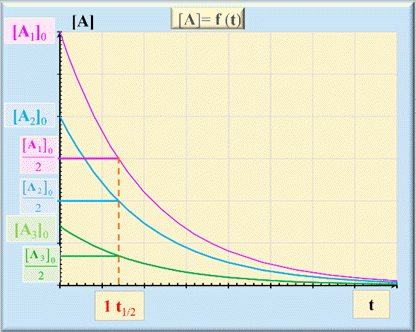
-
On
remarque que le temps de demi-réaction
t1/2
est le même.
|
-
Lorsque
la réaction suit la loi de vitesse d’ordre 1 par rapport au réactif
A,
|
►
Autre caractéristique
du temps de demi-réaction t1/2 :
-
Représentation graphique de [A]t
= f (t)
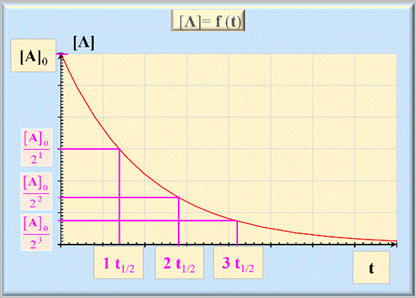
-
On remarque que, au
bout du temps :
-
1
t1/2,
la concentration de l’espèce
A a été divisée par 21.
-
2
t1/2,
la concentration de l’espèce
A a été divisée par 22.
-
3
t1/2,
la concentration de l’espèce
A a été divisée par 23.
-
n
t1/2,
la concentration de l’espèce
A a été divisée par 2n.
-
Ceci
est caractéristique d’une réaction qui suit une loi de vitesse d’ordre 1 par
rapport au réactif A.
-
Cas d’un produit :
-
Représentation graphique de [P]t
= g
(t)
-
On remarque que :
-
Entre
0
et
1
t1/2,
la concentration de l’espèce P a augmenté de [P]max
/ 21.
-
Entre
1
t1/2
et
2
t1/2,
la concentration de l’espèce
P a augmenté de [P]max
/ 22.
-
Entre
2
t1/2
et
3
t1/2,
la concentration de l’espèce
P a augmenté de [P]max
/ 23.
-
Ceci est
caractéristique d’une réaction qui suit une loi de vitesse d’ordre 1 par rapport
au produit P.
►
Conclusion :
|
- Au cours d’une réaction qui suit une loi de vitesse d’ordre 1 par rapport au réactif A, la concentration [A] du réactif limitant est divisée par 2n pour une durée écoulée égale à n t1/2,
car elle obéit à une loi exponentielle du type |
3)- Évolution de la vitesse volumique au cours du temps.
-
La vitesse volumique
d’apparition d’un réactif ou de disparition d’un produit diminue au cours du
temps.
-
Exemple de graphe :
- Les courbes [P]
= f (t)
et [R]
= g (t)
tendent vers une asymptote horizontale et le
coefficient directeur de la tangente à la courbe tend vers zéro.
-
La vitesse d’une
transformation chimique est maximale à l’instant initial.
-
Elle décroît ensuite
et s’annule lorsque la réaction est terminée.
-
Les réactifs sont
consommés au fur et à mesure que la réaction se poursuit.
-
Comme la concentration
des réactifs est un facteur cinétique, la diminution de la concentration des
réactifs entraîne la diminution de la vitesse.
-
Elle
s’annule si le réactif limitant à totalement disparue.
-
Soit la réaction suivante :
a A +
b B →
c C +
d D
-
On considère que la réaction chimique est d’ordre
1 par rapport au réactif A et que le réactif
B est en large excès.
- En conséquence, on peut écrire la relation suivante
pour le réactif A :
-
![]()
- La grandeur k représente la
constante de la vitesse.
-
On en déduit la relation :
-
[A]t
= [A]0 .
exp (-
k .
t)
-
ou
-
[A]t
= [A]0 .
e
-
k
.
t
-
On peut utiliser la relation liant à la fonction
logarithme népérien et la fonction exponentielle :
-
La fonction exponentielle est la fonction inverse
de la fonction logarithme népérien :
|
y = ex |
<=> |
x
= ln y |
|
x
€ R |
|
y € R*+ |
-
e0
= 1 et ln (ex)
= x
-
ln ([A]t
= [A]0 .
e
-
k
.
t) = ln ([A]0)
+ ln (e
-
k
.
t)
-
ln ([A]t
= ln ([A]0) –
k .
t
-
La fonction ln ([A]) =
f (t)
est une fonction affine du type :
- f (ln ([A])
= a .
t +
b
-
La grandeur
a, coefficient directeur la droite
obtenue, représente l’opposée de la constante de la vitesse
k.
- k = –
a
-
La grandeur
b , ordonnée à l’origine, représente
le logarithme népérien de la valeur de la concentration de l’espèce
A à l’instant initial.
- [A]0 =
b
-
Exploitation d’une représentation graphique :
►
Exemple : ln (C)
= f (t)
|
-
On considère une réaction chimique qui est
d’ordre 1 par rapport à l’espèce chimique de concentration
C. - On détermine, au cours du temps la concentration
C de cette espèce chimique.
-
On obtient la représentation graphique suivante. - À partir de cette représentation graphique, on peut déterminer :
-
La constante
k de la réaction, - La concentration initiale de l’espèce chimique
C0,
-
Le temps de demi-réaction
t1/2. |
- Tableau de valeurs :
|
t
(h) |
C mmol,L-1 |
ln (C) |
|
0 |
100 |
4,61 |
|
1 |
85 |
4,44 |
|
2 |
75 |
4,32 |
|
3 |
66 |
4,19 |
|
4 |
57 |
4,04 |
|
5 |
48 |
3,87 |
|
6 |
42 |
3,74 |
|
7 |
36 |
3,58 |
-
Exploitation de la courbe : ln (C)
= f (t) :
-
Détermination de la valeur de la constante de la
vitesse k :
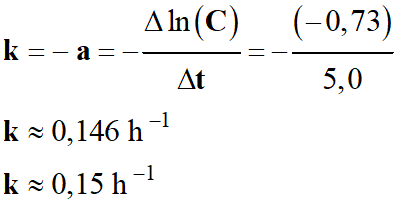
-
Détermination de la valeur de la concentration
initiale C0 :
- ln (C0) =
b ≈ 4,61
-
C0
(mmol . L–1) = exp (b) ≈
exp (4,61)
- C0 (mmol . L–1) ≈ 1,00 × 102
- Cette valeur est bien en accord avec celle donnée dans le tableau.
-
Temps de demi-réaction :
- On peut écrire la relation suivante :
-

- À la date t = 0, la concentration initiale du réactif est
C0.
-
Le temps de demi-réaction
t1/2
est la date pour laquelle :
![]()
-

- Application numérique :
-
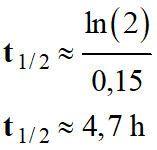 (ceci en
gardant en mémoire les résultats intermédiaires)
(ceci en
gardant en mémoire les résultats intermédiaires)
- Relation à retenir :
-
Pour une réaction d’ordre 1 par rapport au
réactif A :
![]()
-
![]()
1)- Suivi cinétique d’une réaction chimique (Expoitation avec Latis-Pro).
|
QCM r
Les facteurs cinétiques
|
|
Préparation à l’ECE : Étude d’un solvant : l’éthanoate d’éthyle
1)- Exercice 02
page 84 : Justifier une méthode expérimentale. 2)- Exercice 04
page 84 : Étudier l’influence d’un catalyseur. 3)- Exercice 05
page 85 : Exploiter des informations sur la catalyse. 4)- Exercice 06
page 85 : Déterminer un temps de demi-réaction. 5)- Exercice 08
page 85 : Déterminer une vitesse d’apparition. 6)- Exercice 10
page 86 : Vérifier un ordre de
réaction. 7)- Exercice 12
page 86 : Déterminer la valeur d’une dérivée. 8)- Exercice 14
page 87 : Modélisation d’une courbe. 9)- Exercice 15
page 87 : L’eau de Javel. 10)- Exercice 19
page 87 : Analyse médicale. 11)- DS N° 01 :
Le parfum de poire (30 min) : exercice 22 page 90. 12)- DS N° 02 :
Ordre d’une réaction (30 min) : Exercice 23 page 87. 13)- DS N° 03 :
Vitesse d’une réaction (30 min) : Exercice 24 page 91. |
|
|