|
Méthodes d'analyse chimique Exercices 2
|
|
|
|
|
|
|
II- Un colorant pour traiter des infections
|

- Lors de l’exploration d’une grotte, un spéléologue
peut rencontrer des nappes de dioxyde de carbone.
-
|
Méthodes d'analyse chimique Exercices 2
|
|
|
|
|
|
|
II- Un colorant pour traiter des infections
|

- Lors de l’exploration d’une grotte, un spéléologue
peut rencontrer des nappes de dioxyde de carbone.
-
À teneur élevée, ce gaz entraîne des évanouissements et même la mort.-
Le dioxyde de carbone est formé par action d’eaux
de ruissellement acides sur le carbonate de calcium CaCO3 présent dans
les roches calcaires.
Données : Système
S1
= {Voiture}
►
Température du laboratoire au moment de
l’expérience : θ = 25 ° C
►
Pression atmosphérique :
Patm
= 1,013 × 105 Pa
►
Le dioxyde de carbone formé se comporte comme un
gaz parfait et vérifie la loi des gaz parfaits :
►
P . V (CO2)
= n (CO2)
. R . T
►
Les unités : P
en Pa ; V (CO2)
en m3 ;
n (CO2)
en mol ; T en K.
►
Constante des gaz parfaits :
R = 8,31 J . mol-1
. K-1
2)- Résultat de l’expérience :
-
Un élève verse dans un ballon, une solution de
volume VS
= 100 mL d’acide chlorhydrique de concentration en quantité d’ions oxonium
CS
= 100 mmol . L-1.
- À la date t = 0 s, il introduit rapidement dans un ballon un échantillon de carbonate de calcium CaCO3 (s) de quantité de matière n0 = 20,0 mmol
- et déclenche simultanément un chronomètre.
-
Puis il relève les valeurs du volume
V (CO2)
de dioxyde de carbone dégagé en fonction du temps t.
-
Ces valeurs sont reportées dans le tableau
ci-dessous.
-
La pression du gaz est égale à la pression
atmosphérique.
|
Date |
Volume |
|
t (en
s) |
V
(CO2)
(en mL) |
|
0 |
0 |
|
20 |
29 |
|
40 |
49 |
|
60 |
63 |
|
80 |
72 |
|
100 |
79 |
|
120 |
84 |
|
140 |
89 |
|
160 |
93 |
|
180 |
97 |
|
200 |
100 |
|
220 |
103 |
|
240 |
106 |
|
260 |
109 |
|
280 |
111 |
|
300 |
113 |
|
320 |
115 |
|
340 |
117 |
|
360 |
118 |
|
380 |
119 |
|
400 |
120 |
|
420 |
120 |
|
440 |
121 |
-
La transformation chimique étudiée est modélisée
par la réaction d’équation :
CaCO3
(s) + 2 H3O+
(aq) → Ca2+
(aq) + CO2
(g) + 3 H2O
(ℓ)
a)-
Construire le tableau d’avancement de la réaction et
déterminer la valeur de l’avancement maximal noté xmax.
b)-
Exprimer l’avancement x
de la réaction à une date t
en fonction de V (CO2),
T, Patm
et R.
c)-
Calculer le volume maximal Vmax
de gaz susceptible d’être recueilli dans les conditions de l’expérience.
Déterminer si la transformation est totale.
d)-
Représenter le nuage de points expérimentaux obtenu en
plaçant la date t en abscisse
et l’avancement x en
ordonnée.
e)-
Décrire l’évolution de la vitesse volumique de formation
de CO2
au cours du temps.
f)-
Définir le temps de demi-réaction
t1/2 .
Déterminer graphiquement sa valeur.
g)-
La température de la grotte est généralement inférieure à
25 ° C. Préciser l’effet de cet abaissement de la température sur la vitesse
volumique initiale de formation de CO2.
h)-
Compléter le graphique réalisé à la question
d)-, en représentant l’allure de
l’évolution de l’avancement en fonction du temps dans ce cas.
Temps et évolution chimique : cinétique
et catalyse. . (2012)
Application : Suivi cinétique d'une
réaction chimique - Exploitation des résultats avec Latis-Pro
Modélisation macroscopique de l'évolution
d'un système.
Suivi cinétique par spectrophotométrie.
Vitesse d’une réaction chimique (2000)
Suivi temporel d'une réaction chimique.
Modélisation macroscopique de l'évolution
d'un système.
Vieillissement d'une eau de Javel
II-
Un colorant pour traiter
des infections.
-
Le vert de malachite est un composé de formule
C23H25ClN2
utilisé comme colorant.
-
En solution aqueuse, il forme les ions chlorure
Cl-
(aq) et les ions carbénium C23H25N2+
(aq), noté M+
(aq).
-
Toxique, le vert de malachite a pu aussi être
utilisé pour traiter les infections fongiques et bactériennes.
-
En milieu basique, l’ion M+
(aq) réagit avec l’ion hydroxyde HO-
(aq) entraînant la décoloration de la solution suivant une transformation totale
dont l’équation de réaction s’écrit :
M+
(aq) +
HO-
(aq) → MOH (aq)
-
La vitesse de consommation de l’ion
M+
(aq) peut s’écrire :
-
Vc
(M+)
= k . [HO-]α
. [M+]β
-
Les grandeurs α
et β sont des entiers.
-
Seule l’espèce M+
absorbe dans le domaine du visible.
-
Solution de soude : Na+
(aq) + HO-
(aq)
-
Spectre d’absorption du vert de malachite :
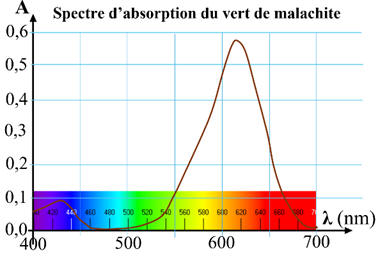
-
Disque chromatique :
-
Couleur d’une solution de vert de malachite :

a)-
Protocole :
![]() Une
solution est préparée en introduisant :
Une
solution est préparée en introduisant :
-
20,0 mL d’une solution aqueuse de vert de malachite
-
De concentration en quantité d’ion carbénium
C (M+)
= 75,0 μmol . L-1 ;
-
75, 0 mL d’eau distillée.
![]() En
déclenchant simultanément le chronomètre, on ajoute :
En
déclenchant simultanément le chronomètre, on ajoute :
-
Un volume V
=5,00 mL d’une solution de soude
-
De concentration en quantité de matière d’ion
hydroxyde C (B)
= 100 mmol . L-1.
b)-
Résultats expérimentaux.
-
Les concentrations en quantité initiales
respectives des espèces M+
(aq) et HO-
(aq) après mélange sont notées :
-
[HO-]0
et [M+]0
-
L’absorbance A
(t) à une longueur d’onde
λ judicieusement choisie est
mesurée à différentes dates.
-
Tableau de valeurs :
|
Date |
Absorbance |
Dérivée |
|
t (en
min) |
A |
- dA / dt en min-1 |
|
0,00 |
0,858 |
0,0292 |
|
2,00 |
0,801 |
0,0273 |
|
4,00 |
0,749 |
0,0255 |
|
6,00 |
0,698 |
0,0238 |
|
8,00 |
0,652 |
0,0222 |
|
10,0 |
0,612 |
0,0208 |
|
12,0 |
0,571 |
0,0194 |
|
14,0 |
0,532 |
0,0181 |
|
16,0 |
0,498 |
0,0169 |
a)-
Protocole :
-
L’expérience précédente est renouvelée en modifiant
la concentration, C (B)
de la solution de soude.
-
Les volumes de solutions utilisées et la
concentration en quantité d’ion M+
restent identiques.
-
Une analyse des résultats permet de construire le
tableau ci-dessous, fournissant la valeur de :
-
k
. [HO-]α
pour les différentes valeurs de C
(B).
a)-
Résultats expérimentaux :
|
C
(B) (en mmol . L-1 |
200 |
300 |
400 |
|
k
. [HO-]α
( en min-1) |
6,70 × 10-2 |
10,3 × 10-2 |
13 ,6 × 10-2 |
a)-
En considérant l’expérience 1,
calculer les concentrations en quantité de matière initiales des espèces
M+
et HO-
après le mélange.
b)-
Montrer que la grandeur
k . [HO-]α
est presque constante au cours de la transformation. Par la suite, elle est
notée kapp.
c)-
Déterminer alors l’expression de la vitesse de
consommation de M+
en fonction de kapp,
[M+]
et β.
d)-
Exprimer en fonction de A,
β,
kapp,
ainsi que le coefficient d’absorption molaire de M+,
noté ε et la longueur
ℓ de la solution traversée par le
faisceau de lumière.
e)-
Déterminer la valeur de β
par l’analyse des résultats expérimentaux.
f)-
À partir des résultats expérimentaux de
l’expérience 2, déterminer les valeurs
de α et de
k.