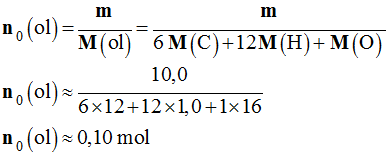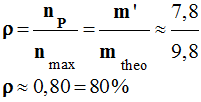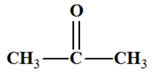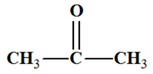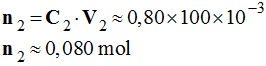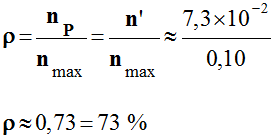|
Synthèses organiques. Exercices. |
|
|
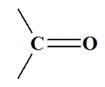
Mots clés : Tests des aldéhydes, tests des cétones, tests des composés carbonylés, DNPH, Liqueur de Fehling, oxydation ménagée des alcools, alcool primaire, alcool secondaire, alcool tertiaire, synthèse de la propanone, acétone, propan-2-one, synthèse de l'acide benzoïque, acide benzoïque, distillation fractionnée, montage à reflux, tableau d'avancement, réactif limitant, avancement maximal, caractère réducteur des aldéhydes, le glucose, réactif de Tollens, nitrate d'argent ammoniacal, miroir d'argent, réactif de SCHIFF, QCM, oxydation d'un alcool, équation d'oxydoréduction, rendement, oxydation du cyclohexanol, identification de composés oxygénés, la menthone, ... |
|
|
I- Exercice 6 page 328. Caractériser des aldéhydes et des
cétones.
|
Recopier et compléter le tableau
ci-dessous en précisant si le test proposé donne un
résultat positif ou non.
|
|
Dérivés
carbonylés |
Liqueur
de Fehling |
DNPH |
|
Propan-2-one C’est
une cétone |
Test
négatif |
Test
positif |
|
Éthanal Aldéhyde |
Test
positif |
Test
positif |
|
Butan-2-one Cétone
|
Test
négatif |
Test
positif |
|
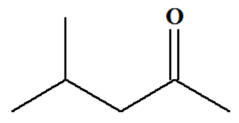
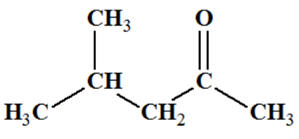
4-méthylpentan-2-one Cétone
|
Test
négatif |
Test
positif |
|
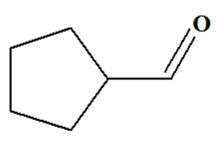
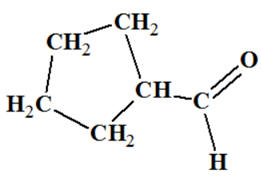
Cyclopentanecarbaldehyde Aldéhyde
|
Test
positif |
Test
positif |
II- Exercice 8 page 328. Prévoir le produit d’oxydation d’un
alcool.
|
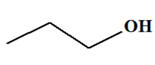
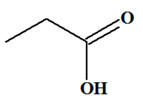
Écrire les formules semi-développées de tous les produits pouvant être obtenus lors de l’oxydation en milieu acide des alcools ci-dessous par l’ion permanganate en excès ou en défaut lorsque cette oxydation est possible : a)-
Méthanol : CH3
– OH b)-
Propan-2-ol : CH3
– CH(OH) – CH3 c)-
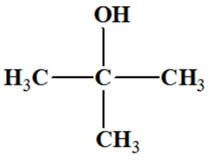
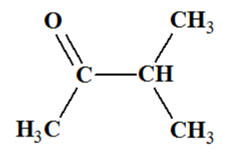
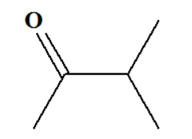
Méthylpropan-2-ol : d)-
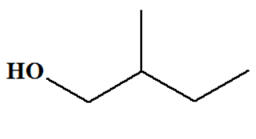
2-méthylbutan-1-ol :
e)-
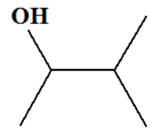
3-méthylbutan-2-ol : |
|
a)-
Méthanol : CH3
– OH :
-
On est en présence
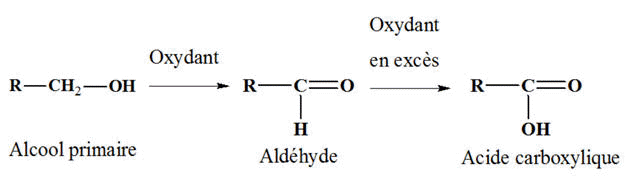
d’un alcool primaire. - L’oxydation ménagée d’un alcool primaire donne la formation d’un aldéhyde,
puis d’un acide carboxylique si l’oxydant
est introduit en excès.
-
Dans le cas du
méthanol, on obtient :
-
Lorsque l’oxydant est
introduit par défaut : le méthanal : HCHO
-
Lorsque l’oxydant est
introduit en excès : l’acide méthanoïque : HCOOH b)-
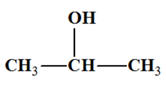
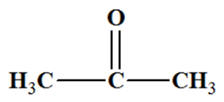
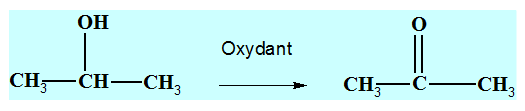
Propan-2-ol : CH3
– CH(OH) – CH3
-
On est en présence
d’un alcool secondaire.
-
L’oxydation d’un
alcool secondaire conduit à la formation d’une
cétone.
-
L’oxydation ménagée
du propan-2-ol conduit à la formation de la
propan-2-one
que l’oxydant soit introduit par défaut
ou en excès.
-
Propan-2-one : c)-
Méthylpropan-2-ol :
-
On est en présence
d’un alcool
tertiaire :
-
L’oxydation ménagée
d’un alcool tertiaire n’est pas possible. d)-
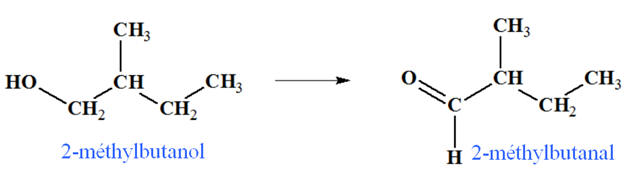
2-méthylbutan-1-ol :
-
On est en présence
d’un alcool primaire :
-
Si l’oxydant est
introduit en défaut, on obtient un aldéhyde :
-
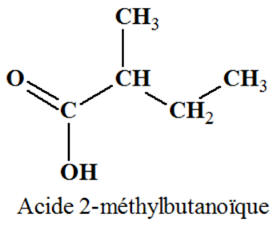
Si l’oxydant est
introduit en excès, on obtient l’acide
2-méthylbutanoïque :
e)-
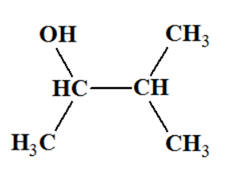
3-méthylbutan-2-ol :
-
On est en présence
d’un alcool secondaire :
-
L’oxydation d’un
alcool secondaire conduit à la formation d’une
cétone.
-
Dans le cas présent,
on obtient la 3-méthylbutan-2-one que l’oxydant
soit
en excès ou en défaut :
|
III- Exercice 10 page 328. Écrire des équations
d’oxydoréduction.
|
Établir l’équation de la réaction
qui a lieu, en milieu acide,
entre les ions
permanganate
MnO4– (aq) et : 1)-
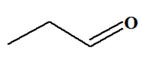
Le butan-1-ol : C3H7
– CH2 – OH pour donner : a)-
Du butanal : C3H7
– CHO b)-
De l’acide butanoïque : C3H7
– COOH. 2)-
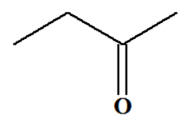
Le butan-2-ol pour donner la butanone. Donnée : couple oxydant /
réducteur MnO4– (aq) / Mn 2+ (aq) |
|
1)-
Le butan-1-ol : C3H7
– CH2 – OH pour donner : a)-
Du butanal : C3H7
– CHO :
b)-
De l’acide butanoïque : C3H7
– COOH.
2)-
Le butan-2-ol pour donner la butanone.
|
IV- Exercice 12 page 329. Déterminer un rendement.
|
La butanone est utilisée comme solvant dans les peintures, encres d’imprimerie, colles, etc. Une quantité
n’ = 0,151 mol de butanone, C4H8O, a été obtenue lors de la réaction, en milieu acide, mettant en
jeu des quantités :
-
n1
= 0,177 mol de butan-2-ol, C4H10O;
-
n2
= 0,177 mol d’ions permanganate, MnO4–,
selon :
5 C4H10O
(ℓ) + 2
MnO4–
(aq) + 6 H + (aq) → 5
C4H8O
(ℓ) + 2 Mn 2+ (aq) + 8
H2O
(ℓ) 1)-
Quel est le réactif limitant ? 2)-
Déterminer le rendement de la synthèse. |
|
1)-
Réactif limitant de la synthèse :
-
Tableau
d’avancement :
-
Réactif limitant et
avancement maximal :
-
Hypothèse 1 : le
butan-2-ol est le réactif limitant
-
Alors : n1
– 5xmax1 = 0
-
xmax1
= n1 / 5
-
xmax1
≈ 3,54
x 10
– 2 mol
-
xmax1
≈ 35,4 mmol
-
Hypothèse 2 : le
réactif limitant est l’ion permanganate :
-
n1
– 2 xmax2 = 0
-
xmax2
= n1 / 2
-
xmax2
≈ 8,85
x 10
– 2 mol
-
xmax2
≈ 88,5 mmol
-
Valeur de
l’avancement maximal xmax :
-
Il est égal à la plus
petite des deux valeurs :
-
xmax =
xmax1 ≈ 26,2 mmol < xmax2
≈ 88,5 mmol
-
Le réactif limitant
est le butan-2-ol.
-
Maintenant, on peut
compléter le tableau d’avancement.
2)-
Rendement de la synthèse :
-
On appelle rendement,
noté ρ, de la synthèse, le quotient de la
quantité de produit P
effectivement obtenue
nP par la quantité maximale
attendue nmax :
-
-
Si la synthèse du
produit demande plusieurs étapes, le rendement de la
synthèse est égal
au produit des rendements de
chaque étape.
-
On a obtenu une
quantité
n’ = 0,151 mol de butanone
(expérimentalement).
-
La quantité maximale
de butanone que l’on peut espérer obtenir : nmax
≈ 0,177 mol
-
|
V-
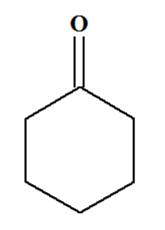
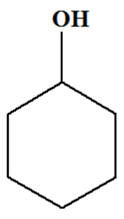
Exercice 14 page 329. Oxydation du cyclohexanol.
|
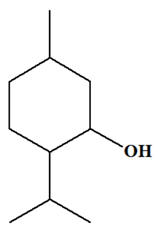
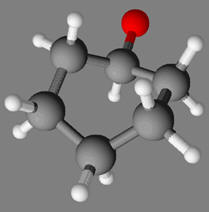
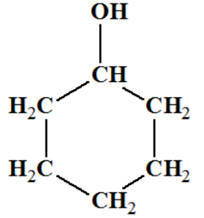
Une masse
m = 10,0 g
de cyclohexanol,
C6H12O(ℓ),
modélisé ci-dessous, est oxydé par une quantité
n = 0,12
mol d’acide hypochloreux
HClO
(aq).
1)-
La réaction qui se produit libère de l’énergie
thermique. a)-
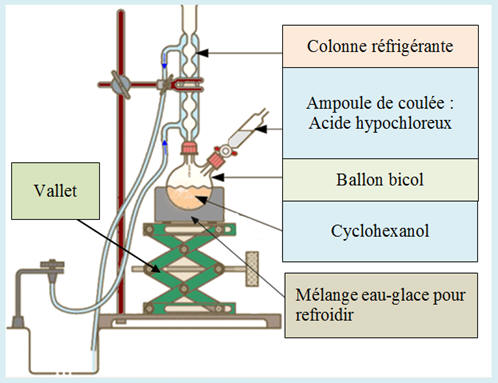
Justifier l’emploi d’un
montage à reflux, sans dispositif de chauffage, lors
de la synthèse. b)-
Faire un schéma légendé de
ce montage. 2)-
Oxydation du cyclohexanol : a)-
Quel est le produit
d’oxydation du cyclohexanol ? b)-
L’acide hypochloreux est
réduit en ions chlorure Cl– (aq).
Établir l’équation de la réaction. c)-
Vérifier que la quantité
d’acide hypochloreux est suffisante pour oxyder la
totalité du cyclohexanol. 3)-
En fin de synthèse, une masse m’ =
7,8 g de liquide est obtenue. Déterminer le
rendement de la synthèse. 4)-
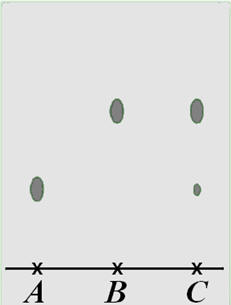
C.C.M : a)- On réalise une chromatographie sur couche mince en déposant une goutte de solution de cyclohexanol en A, une
goutte de cyclohexanone en B et une goutte de
solution du liquide obtenu en C.
-
Le chromatogramme
obtenu est donné ci-dessous. Conclure.
b)-
Quels tests simples
permettraient de vérifier à quelle famille
appartient le produit obtenu ? |
|
1)-
Étude de la réaction : a)-
Choix du montage à reflux,
sans dispositif de chauffage, lors de la synthèse :
-
La réaction libère de
l’énergie. Il n’est pas nécessaire de chauffer.
On
peut supprimer le chauffe-ballon pour cette
oxydation.
-
Le chauffage à reflux
permet d’éviter les pertes de réactifs et de
produits.
-
Les réactifs et les
produits qui se vaporisent retombent dans le mélange
réactionnel lorsqu’ils se condensent. b)-
Schéma légendé de ce
montage :
- Comme la réaction dégage de la chaleur, il faut une ampoule de coulée pour verser goutte à goutte l’acide hypochloreux dans le milieu réactionnel.
-
Ainsi, on peut limiter
l’augmentation de température du mélange
réactionnel.
-
On peut utiliser un
mélange eau-glace pour refroidir le cas échéant. 2)-
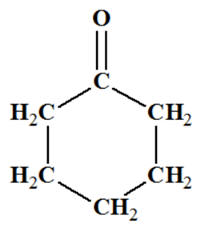
Oxydation du cyclohexanol : a)-
Produit d’oxydation du
cyclohexanol :
-
Le cyclohexanol :
-
C’est un alcool
secondaire. - L’oxydation ménagée d’un alcool secondaire donne une cétone.
- Dans le cas
présent : le cyclohexanone :
b)-
Équation de la réaction.
c)-
Comparaison de la quantité
d’acide hypochloreux utilisée et quantité de
cyclohexanol :
-
Quantité de
cyclohexanol :
-
-
La quantité de
matière d’acide hypochloreux utilisée est :
-
n = 0,12 mol.
-
Tableau d’avancement
de la réaction :
-
Comme la réaction se
fait mole à mole, l’acide hypochloreux a été
introduit en excès
et le cyclohexanol limite la
réaction.
-
En conséquence, la
quantité d’acide hypochloreux est suffisante pour
oxyder tout
le cyclohexanol introduit.
-
xmax
≈ 0,10 mol 3)-
Rendement de la synthèse :
-
En fin de synthèse,
une masse m’ = 7,8 g de cyclohexanone est
obtenue.
-
La masse de
cyclohexanone que l’on peut espérer obtenir est :
-
mthéo
= xmax . M (one) ≈ 0,10
x (6
x 12 + 10
x 1,0 + 1
x 16)
-
mthéo
≈ 9,8 g
-
Rendement de la
synthèse :
-
On appelle rendement,
noté ρ, de la synthèse, le quotient de la
quantité de
produit P effectivement obtenue
nP
par la quantité maximale
attendue nmax :
-
4)-
C.C.M : a)-
Étude du chromatogramme :
-
Le produit obtenu
lors de la synthèse est un mélange car il présente
deux taches sur le chromatogramme.
-
C’est un mélange de
cyclohexanone et de traces de cyclohexanol
(la tache
correspondant au cyclohexanol est plus petite). b)-
Test(s) simple(s) permettant
de vérifier à quelle famille appartient le produit
obtenu :
-
Comme le produit
obtenu est une cétone, on peut faire le test à la
DNPH.
-
Les aldéhydes et les
cétones donnent un précipité jaune-orangé avec la
2,4 D.N.P.H.
-
Ce test est négatif
pour les acides carboxyliques.
|
VI- Exercice 16 page 329. Identification de composés
oxygénés.
|
On dispose de
cinq flacons contenant des liquides inconnus
A,
B,
C,
D et E, tous différents
mais de même formule
C3HxOy. Chaque composé ne présente
qu’un seul groupe caractéristique oxygéné. Les chaînes carbonées de ces
composés ne contiennent ni double liaison
C = C,
ni cycle. Parmi les cinq composés, deux
sont des alcools. L’oxydation de
A conduit
à C ou à
D ; celle
de B conduit à
E. 1)-
Ces données sont-elles suffisantes pour identifier
les cinq composés ? 2)- Le composé C réagit avec la liqueur de Fehling, contrairement à D. En déduire la formule
topologique et le nom de ces cinq composés.
|
|
1)-
Identification des cinq composés :
-
L’oxydation de A
conduit à C ou à D :
-
Le composé A
est un alcool primaire. - La molécule est constituée d’une chaîne carbonée qui comprend 3 atomes de carbone,
elle ne présente que seul groupe
caractéristique
et ne possède pas de double liaison
C = C.
-
Propanol : CH3
– CH2 – CH2 –
OH
-
L’oxydation du
propanol donne C ou D :
-
L’oxydation du
propanol peut donner :
-
Le propanal :
CH3
– CH2 – CHO
-
L’acide propanoïque :
CH3 – CH2 –
COOH.
-
Il faut un test
supplémentaire pour pouvoir attribuer
les bonnes
formules à C et D.
-
L’oxydation de B
ne conduit qu’à un seul produit E.
-
On en déduit que B
est un alcool secondaire :
-
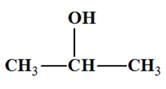
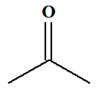
Le propan-2-ol :
-
L’oxydation de cet
alcool conduit à la propanone :
-
Le produit E : 2)-
Formule topologique et le nom de ces cinq composés :
-
Le composé C
réagit avec la liqueur de Fehling,
le composé C
est un aldéhyde : le propanal.
-
Le composé D
est l’acide propanoïque :
-
Tableau :
|
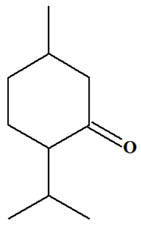
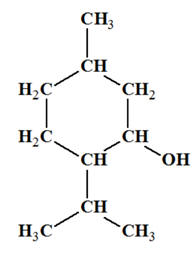
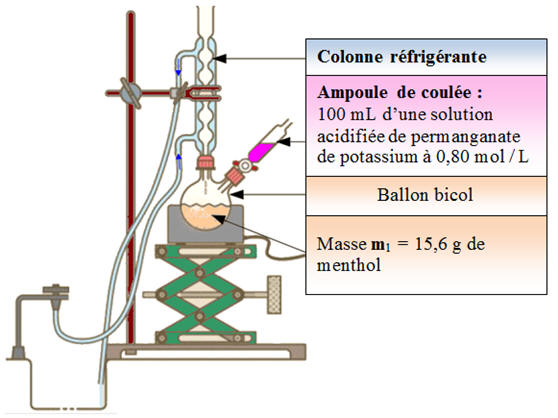
VII- Exercice 19 page 330. Un arôme : la menthone.
|
La menthone est
un des constituants de certaines espèces de menthe. Son odeur et sa saveur,
analogues à celles de la menthe, en font un arôme
très utilisé dans les produits alimentaires. Elle peut être synthétisée à
partir du menthol.
1)-
Menthol et menthone : a)-
Quelle est la classe du
menthol ? b)-
Quel est le groupe
caractéristique de la menthone ? 2)-
Sous quel état physique se présente, à 20 ° C : a)-
Le menthol ? b)-
La menthone ? 3)-
L’oxydation du menthol est réalisée en milieu acide
par l’ion permanganate MnO4–
(aq).
-
Couple oxydant /
réducteur : MnO4–
(aq) / Mn 2+
(aq)
-
Cette réaction se
traduit par l’équation :
5 C9H18CHOH
(ℓ) + 2
MnO4–
(aq) + 6
H
+
(aq) → 5
C9H18CO
(ℓ) +
2
Mn
2+
(aq) + 8 H2O
(ℓ) - On traite une masse m1 = 15,6 g de menthol par un volume V2 = 100 mL
de solution
oxydante de concentration C2 =
0,80 mol . L–1
acidifiée avec de l’acide
sulfurique concentré.
-
Le dispositif
expérimental utilisé est celui du chauffage à
reflux. a)-
Quel est l’intérêt du
chauffage à reflux ? b)-
Quel est le réactif en
excès ? c)- L’oxydation du menthol se déroule à une température voisine de 55 ° C. Justifier la nécessité d’atteindre cette
température. 4)- Le cyclohexane est un solvant organique de densité d = 0,78 et de température d’ébullition 81 ° C. - Parmi les espèces chimiques présentes dans le
ballon, seule la menthone est soluble dans le
cyclohexane.
-
Le contenu du ballon
est transvasé dans une ampoule à décanter
et du
cyclohexane y est ajouté.
-
Après agitation et
décantation deux phases se séparent. a)-
Quelle est la phase qui
surnage dans l’ampoule à décanter ? Justifier. b)-
Quel est l’intérêt de cette
opération ? 5)-
La séparation de la menthone du cyclohexane se fait
par distillation.
-
On obtient une masse
m’ = 11,2 g de menthone. a)-
Le procédé de séparation
est-il adapté ? b)-
Calculer le rendement de la
synthèse. |
|
1)-
Menthol et menthone : a)-
La classe du menthol :
-
Le menthol est un
alcool secondaire.
b)-
Groupe caractéristique de la
menthone :
-
La menthone est une
cétone. Elle possède le groupe carbonyle comme
groupe caractéristique. - Les aldéhydes et les cétones sont des composés carbonylés.
-
Ils possèdent
le groupe caractéristique :
-
L’atome de carbone
fonctionnel est l’atome de carbone du groupe
carbonyle.
2)-
État physique à 20 ° C : a)-
Le menthol : État solide (θf
= 43 ° C) b)-
La menthone : État liquide (θf
= – 6,5 ° C) 3)-
L’oxydation du menthol : a)-
Intérêt du chauffage à
reflux :
-
Ce montage permet de
maintenir le milieu réactionnel à une température
constante, en l'occurrence pratiquement
la
température d'ébullition du solvant.
-
Les vapeurs sont
condensées dans le réfrigérant et retournent à
l'état liquide dans le ballon.
-
Les réactifs et les
produits restent dans le milieu réactionnel.
-
La présence du Vallet
est obligatoire. Elle permet d’enlever le
chauffe-ballon sans toucher au reste du montage
(ballon et réfrigérant).
-
Ainsi, on peut
rapidement refroidir le mélange réactionnel si un
problème survient et (ou) lorsque la réaction est
terminée.
-
Dans le réfrigérant,
l’eau circule du bas vers le haut. b)-
Réactif en excès :
-
Tableau
d’avancement :
-
Quantité de matière
de menthol :
-
-
Quantité de matière
d’ions permanganate :
-
-
Hypothèse 1 : le
menthol est le réactif limitant
-
Alors : n1
– 5xmax1 = 0
-
xmax1
= n1 / 5
-
xmax1
≈ 2,0
x 10
– 2 mol
-
xmax1
≈ 20 mmol
-
Hypothèse 2 : le
réactif limitant est l’ion permanganate :
-
n1
– 2 xmax2 = 0
-
xmax2
= n1 / 2
-
xmax2
≈ 4,0
x 10
– 2 mol
-
xmax2
≈ 40 mmol
-
Valeur de
l’avancement maximal xmax :
-
Il est égal à la plus
petite des deux valeurs :
-
xmax =
xmax1 ≈ 20 mmol < xmax2
≈ 40 mmol
-
Le réactif limitant
est le menthol.
-
L’ion permanganate
est le réactif en excès.
-
On peut compléter le
tableau d’avancement de la réaction :
c)-
L’oxydation du menthol se
déroule à une température voisine de 55 ° C.
-
Justification : La
température de fusion du menthol est θf
= 43 ° C.
-
À la température de
55 ° C, le menthol se trouve à l’état liquide comme
la solution de permanganate de potassium acidifiée.
-
Les deux solutions
peuvent être en contact et peuvent se mélanger.
-
On augmente ainsi la
surface de contact entre les deux réactifs. 4)-
Extraction de la menthone : a)-
Ampoule à décanter : - Dans l’ampoule à décanter, on trouve une phase aqueuse dont la densité est voisine de 1 et une phase organique (le cyclohexane et la menthone)
dont la densité est
voisine de 0,87.
-
La menthone est plus
soluble dans le cyclohexane que dans l’eau.
-
La phase qui surnage
est la phase organique (cyclohexane + menthone) b)-
Intérêt de cette opération :
-
Cette opération :
Extraction par un solvant : extraction liquide /
liquide.
-
La menthone est plus
soluble dans le cyclohexane que dans l’eau.
-
Elle se retrouve
principalement dans le cyclohexane. 5)-
La séparation de la menthone du cyclohexane. a)-
Le procédé de séparation
est-il adapté :
-
Il faut comparer les
températures d’ébullition de la menthone et du
cyclohexane.
-
Température
d’ébullition du cyclohexane : 81 ° C
-
Température
d’ébullition de la menthone : 209 ° C
-
Le procédé de
séparation par distillation est adapté car la
température d’ébullition
de la menthone est
nettement supérieure à celle du cyclohexane. b)-
Rendement de la synthèse.
-
On obtient une masse
m’ = 11,2 g de menthone.
-
Quantité de matière
de menthone correspondante :
-
-
Rendement de la
synthèse :
-
On appelle rendement,
noté ρ, de la synthèse, le quotient de la
quantité
de produit P effectivement obtenue
nP par la quantité maximale
attendue nmax :
-
D’après le tableau
d’avancement : nmax ≈ 0,10 mol
-
|
|
|



 ou
ou

 ou
ou
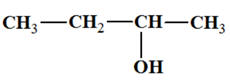 =
= 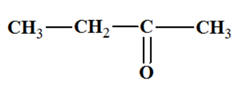
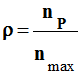
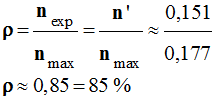
 ou
ou