|
Chim. N° 06 |
Les espèces chimiques naturelles ou synthétiques. Cours |
|
|
Mots clés : Cours de chimie seconde Espèces chimiques, naturelles, synthétiques, artificielles, température, changement d'état, groupes caractéristiques, chromatographie et séparation, chromatographie et analyse, chromatogramme, rélévation d'un chromatogramme, rapport frontal, vitesse de déplacement qcm , médicaments, formulation d'un médicament, forme galénique, absorption, principe actif, excipients, activité thérapeutique, princeps, génériques, ... |
|
|
|
|
|
a)- Exercice 1 : Identifier le caractère naturel ou synthétique d’une espèce chimique. b)- Exercice 4 : Repérer des groupes caractéristiques. c)- Exercice 5 : Étudier la solubilité de l’acide benzoïque. d)- Exercice 6 : Utiliser les caractéristiques physiques. e)- Exercice 14 : Bains de bouche. f)- Exercice 16 : Clous de girofle. |
I- Caractère naturel ou synthétique d’une espèce chimique.
- Certaines espèces chimiques peuvent être naturelles :
- Comme :
► L’acide citrique (que l’on trouve dans les citrons)
► La caféine que l’on trouve dans les grains de café)
► Le caoutchouc naturel provient du latex qui est la sève de l’hévéa.
► Le sucre (saccharose) est présent dans la betterave et la canne à sucre.
► Le sel de cuisine est une espèce chimique que l’on extrait de l’eau de mer (marais salant)
► La salicine contenue dans le saule,
► L‘acide salicylique présent dans la fleur appelée reine-des-prés.
- D’autres sont dites synthétiques, comme :
► L’acide salicylique,
► L’acide acétylsalicylique,
► Le paracétamol,
► L’acide citrique,
- Et enfin, on rencontre des espèces chimiques artificielles, comme :
► L’acide acétylsalicylique,
► Le paracétamol,
► L’aspartame.
► L’acide benzoïque.
![]() Les espèces chimiques
naturelles sont celles qui existent dans la nature.
Les espèces chimiques
naturelles sont celles qui existent dans la nature.
![]() Les espèces chimiques
synthétiques sont préparées par l’Homme à l’aide de transformations chimiques.
Les espèces chimiques
synthétiques sont préparées par l’Homme à l’aide de transformations chimiques.
![]() Les espèces chimiques
artificielles sont des espèces chimiques synthétiques qui n’existent pas dans la
nature.
Les espèces chimiques
artificielles sont des espèces chimiques synthétiques qui n’existent pas dans la
nature.
- Remarque :
- Les espèces chimiques synthétiques qui sont identiques aux espèces chimiques naturelles ont exactement les mêmes propriétés.
- On parle aussi de substances naturelles, synthétiques ou artificielles.
- Une substance est constituée d’espèces chimiques différentes.
- Pour répondre aux besoins de l'homme, l’industrie chimique synthétise un nombre considérable de produits.
- On distingue : la chimie lourde et la chimie fine.
- La chimie lourde synthétise, à partir de matières premières simples des produits en grande quantité :
- Synthèse de matières plastiques (polyéthylène,…)
- Synthèse de l’ammoniac (NH3,…).
- Synthèse de l’aluminium (bauxite è alumine)
- La chimie fine synthétise des substances plus complexes :
- Synthèse de la vanilline (arôme de vanille).
- Synthèse de l’aspirine (acide acétylsalicylique).
- Elle permet de synthétiser en grande quantité des espèces chimiques d’origine naturelle sans épuiser dans les ressources naturelles.
- Elle permet aussi de diminuer le coût de certaines espèces chimiques :
|
|
Origine naturelle |
Origine synthétique |
|
Frambinone |
53 000 € |
54 € |
|
Décalactone |
9000 € |
120 € |
|
Vanilline |
3800 € |
15 € |
II- Principaux groupes caractéristiques rencontrés dans les médicaments.
![]() Un groupe caractéristique
est un groupement d’atomes, autres que les seuls atomes de carbone et
d’hydrogène, présent dans la formule d’une espèce chimique.
Un groupe caractéristique
est un groupement d’atomes, autres que les seuls atomes de carbone et
d’hydrogène, présent dans la formule d’une espèce chimique.
![]() Ce groupe caractéristique
confère des propriétés chimiques et physiques particulières aux molécules qui le
possèdent.
Ce groupe caractéristique
confère des propriétés chimiques et physiques particulières aux molécules qui le
possèdent.
- Remarque : une espèce chimique peut posséder plusieurs groupes caractéristiques.
2)- Quelques groupes caractéristiques :
|
Nom |
Alcool |
Carbonyle |
Carboxyle |
Étheroxyde |
|
Formule |
|
|
|
|
|
Exemple |
CH3
―CH2―OH
Alcool éthylique
(Éthanol) Phénol |
Acétone
(Propan-2-one) |
Acide acétique
(Acide éthanoïque) |
Éther méthylique
(méthoxyméthane) |
|
Nom |
Ester |
Amine |
Amide |
Hydroxyle |
|
Formule |
|
|
|
―OH |
|
Exemple |
Acétate de
méthyle
Éthanoate de
méthyle |
Méthanamine |
Acétamide
Éthanamide
|
Phénol
|
- Remarque : certaines molécules peuvent renfermer plusieurs groupes :
|
Acide salicylique : groupe acide et groupe hydroxyle (phénol) |
|
|
Acide acétylsalicylique groupe acide et groupe ester |
|
|
Paracétamol : groupe amide et groupe hydroxyle |
|
3)-
Formulation d’un médicament : (cours chimie N° 03 Les molécules. Cours)
-
La formulation d’un médicament correspond :
-
À sa préparation
-
Au choix de sa forme d’administration, dite
forme
galénique (Comprimé, gélule, suppositoire, solution buvable, …)
-
À l’élaboration de sa composition.
-
La
forme galénique d’un médicament correspond
-
À l’aspect sous lequel il est présenté :
comprimé, gélule, suppositoire, solution buvable
-
Mais aussi au mode d’absorption : libération
prolongée, gastrorésistant, voie orale, …
-
La galénique est l’étude des modes
d’administration d’un médicament.
-
Le but de la
galénique est d’assurer
la stabilité du
principe actif, faciliter son administration, optimiser son
efficacité thérapeutique, améliorer sa conservation,
diminuer sa toxicité, favoriser le suivi correct du
traitement (observance).
- Un médicament est un mélange.
- Il est constitué de
nombreuses espèces chimiques.
-
On entend par médicament toute composition
présentée comme possédant des propriétés curatives ou préventives à l’égard des
maladies humaines ou animales.
-
Il contient :
-
Un ou plusieurs principes actifs
-
Des excipients.
-
Un principe actif possède un effet thérapeutique
qui permet de prévenir ou guérir une maladie.
- Le principe actif est désigné par sa dénomination commune internationale (DCI) :
- C’est le plus souvent le nom scientifique que l’on
utilise dans tous les pays du monde.
-
Exemple : l’ibuprofène, le paracétamol, l’acide
acétylsalicylique sont des principes actifs.
- Les excipients sont souvent dépourvus d’activité thérapeutique.
- Ils permettent de rendre le principe actif plus efficace.
-
Les excipients permettent aussi de présenter le
médicament sous une forme donnée.
-
Exemple : sur la notice, on peut lire souvent
excipient q.s.p un comprimé (q.s.p : quantité suffisante pour)
- Il est important de lire la notice car la présence de certains excipients (saccharose, lactose,..) peut avoir un impact sur des patients allergiques.
- Dans ce cas, on parle d’excipients à effets
notoires.
-
La formulation consiste à déterminer la nature et
les proportions des différents ingrédients qui le composent
►
Elle permet :
-
De présenter le médicament sous une forme adaptée
pour la voie d’administration souhaitée
-
De modifier le goût ou l’odeur du médicament
-
De moduler la vitesse de libération du principe
actif dans l’organisme
-
D’améliorer la conservation du médicament.
-
Ce sont les excipients qui permettent cette mise
en forme.
-
Exemples :
-
Les comprimés secs contiennent souvent de la
cellulose, de l’amidon qui permettent au cacher de se déliter
- L’hydrogénocarbonate de sodium est présent dans les comprimés effervescents.
- En présence d’eau, il se dégage du dioxyde de
carbone et permet ainsi une meilleure dispersion du principe actif avant
administration.
-
Remarque : un même principe actif peut être
associé à différents excipients.
-
Le médicament original est appelé
princeps.
-
Les laboratoires pharmaceutiques effectuent des
recherches pour mettre au point des médicaments.
-
Lorsqu’une espèce chimique qui possède un
principe actif susceptible d’aboutir à un médicament est découverte ou
synthétisée, un brevet est déposé.
-
Des recherches sont ensuite menées pour étudier
les effets de l’espèce chimique sur des organismes vivants (cellules animaux).
- Puis des études cliniques doivent être réalisées afin d’obtenir une autorisation de mise sur le marché (AMM) délivré par un organisme d’état :
- Agence française de sécurité sanitaire des produits de santé
(Afssaps).
-
Jusqu’à expiration du brevet le laboratoire garde
l’exclusivité de la commercialisation du médicament original, appelé princeps
(environ 10 ans d’exploitation).
- Après cette date, d’autres laboratoires peuvent commercialiser une copie du produit original :
- C’est le
médicament générique.
-
Un médicament générique contient le même
principe actif que celui d’une marque.
-
Il contient la même masse du même principe actif
que le médicament princeps correspondant et des excipients différents ou non.
-
Il porte souvent le nom de son principe actif.
-
Le médicament générique est souvent commercialisé
sous sa dénomination commune internationale (DCI).
-
Son aspect ou sa présentation peuvent changer et
les excipients peuvent être différents.
-
Il faut faire attention à la présence
d’excipients à effets notoires.
-
Un médicament générique est moins cher qu’un
princeps car les coûts de recherche et de développement n’entrent pas dans le
prix.
III- Caractéristiques physiques permettant d’identifier une espèce chimique.
1)-
Température de changement d’état.
a)- La température d’ébullition : θeb.
-
On appelle température
d’ébullition d’une espèce chimique, notée θeb, la température
de passage de l’état liquide à l’état gazeux de cette espèce chimique.
-
L’unité : le degré
Celsius : ° C
-
Instrument de mesure :
le thermomètre.
-
Tableau :
température d’ébullition de
l’eau.
|
θeb ° C |
p pression Pa |
Altitude
h m |
|
100 |
1013 |
0 |
|
90 |
986 |
3000 |
- Remarque 1 : la température d’ébullition dépend de la pression.
- On peut faire bouillir de l’eau
pratiquement à zéro degré Celsius.
- Remarque 2 : Un mélange ne se comporte pas comme un corps pur.
- La température d’ébullition d’un corps pur ne varie pas au cours de l’ébullition.
- Si l’on fait bouillir de l’eau salée, la température d’ébullition du mélange varie au cours de l’ébullition.
- La température d’ébullition de l’eau salée est supérieure à la température d'ébullition de l’eau.
-
De même, l’eau salée gèle à une température inférieure à 0 ° C.
-
La température
d’ébullition est une grandeur caractéristique d’une espèce chimique à une
pression donnée.
-
La détermination
expérimentale d’une température d’ébullition d’une substance, à une pression
donnée, permet d’identifier cette substance par comparaison avec les valeurs
répertoriées dans des tables de données.
b)- La température de fusion : θf.
-
On appelle température
de fusion d’une espèce chimique, notée θf, la température de
passage de l’état solide à l’état liquide de cette espèce chimique.
-
L’unité : le degré
Celsius : ° C
-
Instrument de mesure :
le thermomètre, le banc Kofler.
-
Remarque : cette
température dépend très faiblement de la pression.
- Remarque 2 : Un mélange ne se comporte pas comme un corps pur.
-
l’eau
salée gèle à une température inférieure à 0 ° C.
- La détermination expérimentale d’une température de fusion d’une substance permet d’identifier cette substance par comparaison avec les valeurs répertoriées dans des tables de données.
-
Elle permet aussi de vérifier si la substance est pure.
- L’indice de réfraction n est caractéristique d’une espèce chimique.
- Elle se détermine à l’aide de mesures d’angle ou directement à l’aide d’un réfractomètre.
- La solubilité s (E) d’une espèce chimique E dans un solvant donné est égale à sa concentration massique dans une solution saturée à la température considérée.
|
|
s (E) solubilité en g / L |
|
m masse du soluté en g |
|
|
V volume de la solution saturée obtenue en L |
- La masse volumique d’une espèce chimique est égale au quotient de sa masse par son volume.
- On écrit :
-
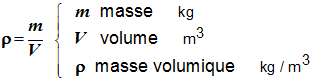
- Autres unités : kg / L ou kg / dm3 ; g / cm3 ou g / mL.
- La densité des liquides et des solides se mesure par rapport à l’eau.
- La densité des gaz se mesure par rapport à l’air.
-
![]() .
.
-
Conséquence :
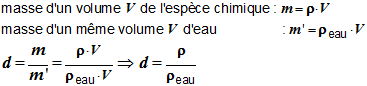
-
La densité est un
nombre qui n’a pas d’unité.
- Exemples : dans un même récipient, on verse d’eau, du mercure et de l’huile.
- Ces liquides sont non miscibles.
- Faire un
schéma du récipient à l’équilibre.
-
On donne : densité du
mercure : d = 13,6 et
densité de l’huile : d = 0,90.
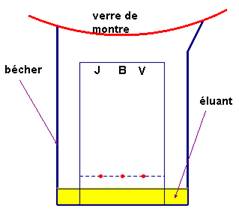
IV- Chromatographie sur
couche mince(C.C.M).
-
La chromatographie
permet de séparer les espèces chimiques présentes dans un mélange homogène.
-
Elle est basée sur la
différence de solubilité d’une substance dans deux phases non miscibles :
-
Pour effectuer une
C.C.M, on utilise :
- Une phase fixe sur laquelle une goutte de mélange à séparer est déposée.
-
La phase fixe est
constituée d’une mince couche de gel de silice déposée sur une plaque
d’aluminium.

- Une phase mobile ou éluant.
- C’est le solvant dans lequel les constituants du mélange sont plus ou
moins solubles.
- L’éluant migre le long de la phase fixe grâce au phénomène de capillarité.
- Il entraîne les constituants du mélange qui se déplacent à des vitesses différentes.
- On peut ainsi les
séparer.
2)- Chromatographie et
séparation.
- La chromatographie permet la séparation des constituants d’un mélange.
- Pour un éluant et un support
donnés, une espèce chimique migre de la même façon qu’elle soit pure ou dans un
mélange.
-
Une espèce chimique
très soluble dans l’éluant migre beaucoup plus vite qu’une substance peu
soluble.
-
Les espèces chimiques,
étant entraînées à des vitesses différentes, peuvent être séparées.
3)- Chromatographie et
analyse.
- La chromatographie est aussi une technique d’analyse.
- Elle permet d’identifier les espèces chimiques
présentes dans un mélange.
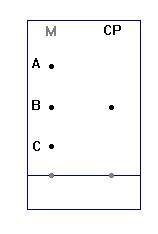
-
Des espèces chimiques
identiques migrent à des hauteurs identiques sur une même plaque de
chromatographie.
4)-
Vitesse de déplacement ou rapport frontal
Rf.
-
La séparation des
composants, entraînés par la phase mobile, résulte de leur différence de
solubilité entre les deux phases.
-
Les composés dissous
déposés se fixent sur la phase fixe pour s’en arracher et monter avec la phase
mobile.
-
Chaque constituant du
mélange se déplace avec sa propre vitesse derrière le front du solvant.
-
Une fois la migration
terminée, on détermine pour chaque constituant, la vitesse de déplacement ou le
rapport frontal Rf.
-
![]() .
.
5)- Révélation d’un chromatogramme.
- Les chromatogrammes d’espèces chimiques incolores doivent être révélés afin de les exploiter.
- En peut éclairer le chromatogramme avec une lampe (U.V) pour les substances qui absorbent ces radiations comme l’acide acétylsalicylique.
- On peut utiliser des révélateurs chimiques tels que le diiode ou le permanganate de potassium qui permettent de révéler la présence de nombreuses espèces chimiques.
1)- QCM : pour chaque question, indiquer la (ou les) bonne(s) réponse(s).
|
|
2)- Exercices :
a)- Exercice 1 : Identifier le caractère naturel ou synthétique d’une espèce chimique.
b)- Exercice 4 : Repérer des groupes caractéristiques.
c)- Exercice 5 : Étudier la solubilité de l’acide benzoïque.
d)- Exercice 6 : Utiliser les caractéristiques physiques.
e)- Exercice 14 : Bains de bouche.
f)- Exercice 16 : Clous de girofle.
|
|