I- Extraction d’espèces chimiques.(En relation avec le TP Chimie N° 2)
(En relation avec le TP Chimie N° 03)
III- Caractéristiques physiques
|
Chim. N° 02 |
Extraction et caractérisation d'espèces chimiques. Cours. |
|
|
Programme 2010 : Extraction d'espèces chimiques. Programme 2010 : Physique et Chimie Prograzmme 2020 : Physique et Chimie |
I- Extraction d’espèces chimiques.(En relation avec le TP Chimie N° 2) |
|
(En relation avec le TP Chimie N° 03)
|
|
III- Caractéristiques physiques |
|
QCM : Extraction d'espèces chimiques 1 (Questy) Extraction d'espèces chimiques 1 (Tableau) |
Exercices (énoncé et correction)
|
Exercices 2005-2006 |
|
|
Physique et Chimie seconde Collection DURANDEAU HaCHETTE |
|
|
1) Exercice 4 page 210. |
2) Exercice 5 page 210. |
|
3) Exercice 7 page 210. |
4) Exercice 14 page 212. |
|
5) Exercice 1 page 224 |
6) Exercice 4 page 224 |
|
Physique et Chimie seconde Collection Microméga Hatier Ancienne édition |
|
|
1)- Exercice 12 page 39. |
2)- Exercice 16 page 40. |
|
3)- Exercice 17 page 40. |
4)- Exercice 18 page 40. |
|
5)- exercice 20 page 40. |
|
Pour aller plus loin :
|
Mots clés : Extraction des espèces chimiques ; les méthodes d'extraction ; chromatographie ; chromatographie en phase gazeuse ; la distillation ; l'entraînement à la vapeur ; la distillation fractionnée ; l'ampoule à décanter ; ... |
|
|
I- Extraction d’espèces chimiques. (En
relation avec le TP Chimie N° 2)![]()
- Le plus souvent, l’Homme se trouve confronté à des substances qui sont des mélanges d’espèces chimiques.
- Il faut parfois les séparer pour les utiliser.
- Pour ce faire, il utilise différentes techniques d’extraction :
- Exemples :
- L’expression qui consiste à extraire le jus d’un fruit.
- La décantation (solide / liquide) et (liquide / liquide).
- Exemple : eau boueuse et cas des liquides non miscibles.


- La décoction ou l’infusion.
- L’extraction par un solvant ou la macération.
- La distillation.
- L’hydrodistillation ou entraînement à la vapeur (Essence de Lavande)
|
(1)‑
Chauffe-ballon. (2)‑ Mélange. (3)‑ Thermomètre. (4)‑ Réfrigérant
oblique. (5)‑Arrivée et
Sortie de l’eau. (6)‑ Éprouvette. (7)‑ Fleur de
lavande. (8)‑ Huile
essentielle. (9)- Support
élévateur (Vallet) |
2)- L’extraction par un solvant.
|
Définition : - L’extraction par un solvant consiste à dissoudre l’espèce chimique recherchée dans un solvant non miscible avec l’eau et à séparer les deux phases obtenues. |
- L’extraction par un solvant se réalise dans une ampoule à décanter.
- Le choix du solvant dépend de l’espèce chimique recherchée.
- L’espèce chimique doit être plus soluble dans le solvant que dans l’eau.
![]() Expérience :
extraction
du diiode présent dans une solution.
Expérience :
extraction
du diiode présent dans une solution.

![]() Protocole expérimental :
Protocole expérimental :
- Introduire le mélange (solution aqueuse d’iodure de potassium et de diiode) dans l’ampoule à décanter
- Puis ajouter délicatement le solvant
- (hexane ou pentane : solvant organique : liquide incolore moins dense que la solution aqueuse et non miscible)
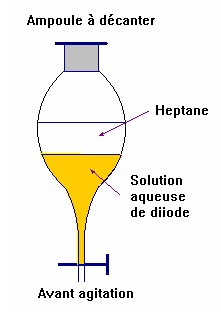
- Agiter, laisser décanter et dégazer.
- On observe alors deux phases :
- La phase inférieure qui est pratiquement décolorée et la phase supérieure ,qui contient le diiode dans le solvant, qui est violette.
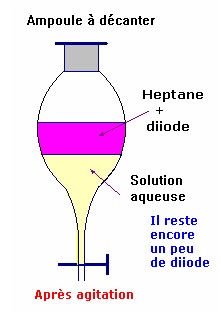
- On dit que le diiode a été extrait par le solvant.
- On récupère la phase contenant le diiode et le solvant.
- Après évaporation du solvant, on recueille le diiode (solide).
3)- L’entraînement à la vapeur ou hydrodistillation ou distillation simple.
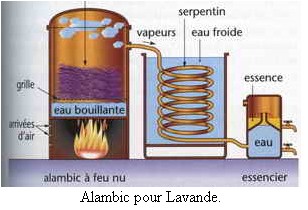
Montage utilisé au laboratoire : voir
|
- Dans l’entraînement à la vapeur, l’ébullition du mélange d’eau et du produit crée un courant de vapeurs. - Ce courant de vapeurs est constitué de vapeurs d’eau et de vapeurs des huiles essentielles du produit. - On condense ce mélange gazeux pour obtenir un distillat. - Ce distillat est constitué d’eau à l’état liquide et des huiles essentielles à l’état liquide. - Les huiles essentielles, étant peu miscibles avec l’eau et moins dense que l’eau, surnagent. |
- Exemple :
- On extrait par entraînement à la vapeur, l’huile essentielle des fleurs de lavande.
- Cette huile essentielle est un mélange dont le principal constituant est l’acétate de linalyle (ester peu soluble dans l’eau).
Fiche technique de l’essence de lavande produite par
la GAEC LES Grandes marges Valensole (exploitation avec Excel)
4)- La distillation fractionnée.
|
(1)‑Chauffe-ballon. (2)‑Mélange. (3)‑Colonne de Vigreux. (4)‑Thermomètre. (5)‑Arrivée et Sortie de l’eau. (6)‑Condenseur. (7)‑Éprouvette. (8)‑Distillat. (9)- Support élévateur (Vallet) |
|
La distillation fractionnée : - Elle permet de séparer les espèces chimiques constituant un mélange liquide. - Le mélange à distiller est placé dans un ballon surmonté d’une colonne à distiller : colonne de Vigreux. - On chauffe le ballon jusqu’à ébullition du mélange. - Les vapeurs des différentes espèces chimiques montent dans la colonne à distiller. - La colonne à distiller permet de séparer les différentes espèces chimiques. - En tête de colonne à distiller, on trouve l’espèce chimique la plus volatile. - Les autres se condensent et retombent dans le ballon. - L’espèce chimique la plus volatile est condensée grâce au réfrigérant. - On recueille le distillat. |
II- La chromatographie. (En relation avec le TP Chimie N° 03)
1)- Chromatographie sur couche mince (C.C.M).
- Cette technique permet de séparer les espèces chimiques présentes dans un mélange homogène.
- Pour effectuer une C.C.M, on utilise :
- Une phase fixe sur laquelle une goutte de mélange à séparer est déposée.
- La phase fixe est constituée d’une mince couche de gel de silice déposée sur une plaque d’aluminium.
- Une phase mobile ou éluant.
- C’est le solvant dans lequel les constituants du mélange sont plus ou moins solubles.
- L’éluant migre le long de la phase fixe grâce au phénomène de capillarité.
- Il entraîne les constituants du mélange qui se déplacent à des vitesses différentes.
- On peut ainsi les séparer.

2)- Chromatographie et séparation.
|
- La chromatographie permet la séparation des constituants d’un mélange. - Pour un éluant et un support donnés, une espèce chimique migre de la même façon qu’elle soit pure ou dans un mélange. - Une espèce chimique très soluble dans l’éluant migre beaucoup plus vite qu’une substance peu soluble. - Les espèces chimiques étant entraînées à des vitesses différentes peuvent être séparées. |
3)- Chromatographie et analyse.
|
- La chromatographie est aussi une technique d’analyse. - Elle permet d’identifier les espèces chimiques présentes dans un mélange. - Des espèces chimiques identiques migrent à des hauteurs identiques sur une même plaque de chromatographie. |
- Préparation de la plaque ;
|
Étape 1 :
|
Étape 2
|
Étape 3
|
|
1. Placer la plaque dans le bécher et recouvrir du verre
de
montre. 2. Laisser évoluer l’ensemble jusqu’à ce que l’éluant arrive
à
de la plaque environ. 3. Sortir la plaque et
laisser sécher.
|
|
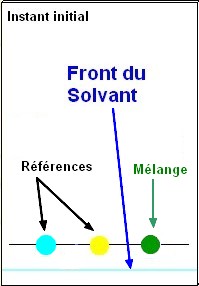

Animation : réalisation d'une C.C.M
III-
Caractéristiques physiques d’une espèce chimique.![]()
1)-
La température d’ébullition :
θeb.
- On appelle température d’ébullition d’une espèce chimique, notée
θeb,
-
la température de passage de l’état liquide à l’état gazeux de cette espèce
chimique. -
L’unité : le degré Celsius : ° C - Instrument de mesure : le thermomètre. - Tableau :
température
d’ébullition de l’eau.
θ
eb ° C
p pression
Pa
Altitude h
m 100 1013 0 90 986 3000 - Remarque 1 : la température d’ébullition dépend de la
pression. - On peut faire bouillir de l’eau pratiquement à zéro degré
Celsius. - Remarque 2 : Un mélange ne se comporte pas comme un corps pur.
- La température d’ébullition d’un corps pur ne varie pas au cours de l’ébullition.
- Si l’on fait bouillir de l’eau salée, la température d’ébullition du
mélange varie au cours de l’ébullition. - La température d’ébullition de l’eau salée est supérieure à la température
de l’eau. -
De même, l’eau salée gèle à une température inférieure à 0 ° C. -
La température d’ébullition est une grandeur caractéristique
d’une espèce chimique à une pression donnée.
2)-
La température de fusion :
θfus.
- On appelle température de fusion d’une espèce chimique, notée
θfus,
-
la température de passage de l’état solide à l’état liquide de cette espèce
chimique. - L’unité : le degré Celsius : ° C - Instrument de mesure : le thermomètre, le banc Kofler. - Remarque : cette température dépend
très faiblement de la pression. - Remarque 2 : Un mélange ne se comporte pas comme un corps pur.
- l’eau
salée gèle à une température inférieure à 0 ° C.
3)-
La masse volumique. - La masse volumique d’une espèce chimique est égale au quotient de
sa masse par son volume. - On écrit :
ρ = m V
- Autres unités : kg / L ou kg / dm - La densité des liquides et des solides se mesure par rapport à
l’eau. - La densité des gaz se mesure par rapport à l’air. d = Masse d'un volume V de l'espèce chimique Masse d'un même volume
V d'eau d = m m' - Conséquence :
- Masse d'un volume V de
l'espèce chimique :
m =
ρ
. V - Masse du même volume V
d'eau :
m' =
ρ
eau .
V - Densité : -
- - Exemples :
-
dans un même
récipient, on verse de l’eau, du mercure et de l’huile. - Ces liquides sont
non miscibles.
- On donne :
densité du mercure : d
= 13,6
et densité de l’huile : d
= 0,90. -
L’indice de réfraction est caractéristique d’une espèce chimique.
- Elle se détermine à l’aide de mesures d’angle ou directement à l’aide
d’un réfractomètre.
6)-
Utilisation des caractéristiques physiques. - Les caractéristiques physiques des espèces chimiques permettent de les
distinguer les unes des autres. - Une liste des caractéristiques physiques d’une espèce chimique constitue
(en quelque sorte) sa carte d’identité. - Pour identifier une espèce chimique ou vérifier sa pureté. - On
utilise ses caractéristiques physiques : température de changement d’état,
masse volumique, ….. - On peut identifier une espèce chimique obtenue en déterminant ses
caractéristiques physiques et en les comparant à celles d’espèces
chimiques connues. QCM :
Extraction d'espèces chimiques 1 (Questy)
Extraction d'espèces chimiques 1 (Tableau) Exercices
2005-2006
Physique
et Chimie
seconde
Collection
DURANDEAU
HaCHETTE 1) Exercice 4 page 210. 2) Exercice 5 page 210. 3) Exercice 7 page 210. 4) Exercice 14 page 212.
Physique
et Chimie
seconde
Collection
Microméga Hatier
Ancienne
édition
![]() m
: Masse de l'échantillon considéré en g
m
: Masse de l'échantillon considéré en g
![]() V
: Volume occupé par l’échantillon en m
3
V
: Volume occupé par l’échantillon en m
3![]() ρ
:
Masse volumique de l’échantillon en kg / m
3
ρ
:
Masse volumique de l’échantillon en kg / m
3
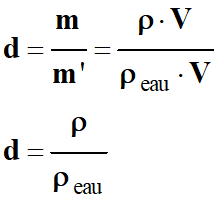
![]() Faire un schéma du récipient à l’équilibre.
Faire un schéma du récipient à l’équilibre.