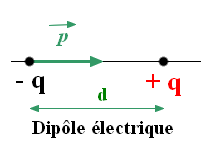|
Transformations en chimie organique : Aspect microscopique. Cours. |
|
|
|
|
Exercices : énoncé avec correction. a)- Exercice 6 page 313 : Déterminer la polarisation d’une liaison. b)- Exercice 10 page 313 : Localiser des sites donneurs ou accepteurs. c)- Exercice 12 page 314 : Représenter le mouvement des doublets
d’électrons. d)- Exercice 15 page 315 : Test à la
DNPH. e)- Exercice 18 page 315 – 316 : Hydratation de hex-1-ène. f)- Exercice 20 page 317 : Synthèse de l’éthanamide. g)- Exercice 22 page 318 : Synthèse d’un arôme. h)- Exercice 23 page 319 : Réduction du benzile. |
I-
Détermination de la polarisation d’une molécule.
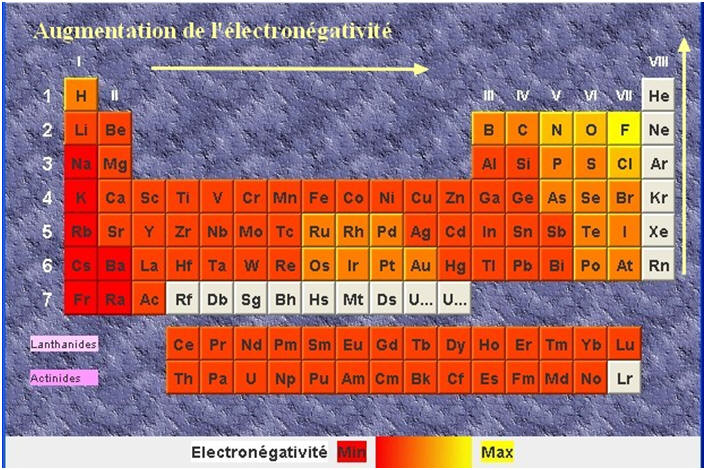
1)- Électronégativité d’un élément
chimique.
- Physique N° 06 Cohésion de la matière à l'état solide (Cours 1 S)
- Caractère dipolaire d'une molécule.
- L’électronégativité d’un élément traduit la
tendance d’un atome A de cet élément à attirer le doublet
d’électrons d’une liaison covalent qu’il forme avec un autre
atome B.
- Plus un élément est électronégatif, plus il attire à lui
le doublet d’électrons de la liaison covalent.
- L’électronégativité varie selon la place de
l’élément dans la classification périodique, ceci à l’exception
des gaz nobles.
- Cette propriété est liée à la règle du
duet et de
l’octet.
- Il existe plusieurs échelles d’électronégativité.
- On utilise le plus souvent l’échelle d’électronégativité
de Pauling.
- Sur une même ligne, l’électronégativité augmente
de gauche à droite.
- Dans une même colonne, elle augmente de bas en haut.
- Remarque :
- Les alcalins (Li, Na, K, …) ont tendance à perdre des électrons, alors que les halogènes (F, Cl, Br, …) ont tendance à gagner des électrons.
- Ainsi, ils peuvent acquérir la structure des gaz nobles.
2)- Polarisation d’une liaison.
a)-
Apparition de charges partielles :
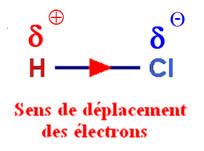
► Exemple : La molécule de chlorure d’hydrogène.
- Le chlorure d’hydrogène est constitué de molécules
HCl
dans lesquelles l’atome d’hydrogène est lié à l’atome de chlore
par une liaison covalente.
|
Représentation de
Lewis |
Caractéristiques géométriques |
|
|
|
|
dH – Cl ≈
127 pm |
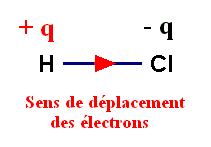
- Le chlore est beaucoup plus
électronégatif que
l’hydrogène.
- Il attire vers lui le doublet de liaison :
On dit que la
liaison H – Cl est polarisée.
- Cette polarisation fait apparaître :
- Un excédent de charge positive, noté +
q =
2,8
x 10–20
C, sur l’atome d’hydrogène.
- Un excédent de charge négative, noté –
q = –
2,8
x 10–20
C, sur l’atome de chlore.
- La charge
q est inférieure à la charge élémentaire
e = 1,6
x 10–19
C
- q
représente
une charge partielle.
- 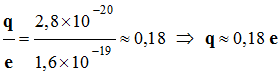
- La polarisation de la liaison peut être décrite par la
donnée des charges partielles :
- On écrit :
q =
δ .
e
- La charge
δ
. e
est portée par l’atome le moins électronégatif
et est notée :
![]()
- La charge
–
δ
. e
est portée par l’atome le plus électronégatif
et est notée :
![]()
- Représentation :
|
|
|
H
– Cl |
|
- L’électronégativité χ d’un atome traduit sa capacité à attirer le doublet d’électrons
d’une liaison covalente dans laquelle il est engagé.
- Une liaison
A – B est
polarisée si
χA –
χB ≥ 0,4
-
Si cette condition est vérifiée :
- Alors, il apparaît une charge partielle
négative
|
-
Représentation :
|
|
|
|
- La molécule de chlorure d’hydrogène a un caractère
dipolaire : elle constitue un dipôle électrique.
- Elle peut être représentée par un dipôle portant les
charges – q et
+ q
|
ou
|
Dipôle électrique
équivalent
ou
|
- Un dipôle électrique est l’ensemble constitué par 2
charges électriques opposées
– q et
+ q séparées
par la distance d.
- Un dipôle électrique possède un moment dipolaire
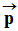 , colinéaire à la
liaison et orienté du pôle
– vers le pôle
+ du
dipôle.
, colinéaire à la
liaison et orienté du pôle
– vers le pôle
+ du
dipôle.
- Le moment dipolaire s’exprime en debye symbole D :
- Exemple pour la molécule de chlorure d’hydrogène :
p
(H –
Cl) = 1,1 D.
- Une liaison covalente est polarisée lorsque les deux
atomes liés ont des électronégativités différentes.
- La détermination de la polarisation d’une liaison
A –
B se fait en attribuant à l’atome le plus électronégatif une
charge partielle négative
 et à l’atome le moins électronégatif une charge partielle
positive
et à l’atome le moins électronégatif une charge partielle
positive
 .
.
- Plus la différence d’électronégativité est importante
entre les atomes liés, plus la liaison est polarisée et plus les
charges partielles portées par les atomes sont élevées.
- Les électronégativités des atomes de carbone
C
(2,5) et d’hydrogène H (2,2) sont assez voisines.
- En chimie organique, on considère que la liaison
C – H
est non polarisée.
e)-
Exemples de liaisons polarisées :
|
|
|
C
– Cl |
|
|
|
Mg
– C |
II-
Identifier un site donneur ou accepteur de doublet
d’électrons.
1)- Site donneur de doublet
d’électrons.
|
Représentation de
Lewis |
|
|
- L’atome d’oxygène
- Possède
trois doublets non
liants et un
doublet liant
(il respecte la règle de l’octet).
- Porte une charge électrique négative.
- Est un site riche en électrons.
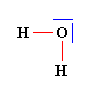
b)- La molécule d’eau : Chimie N° 03 Des Atomes aux molécules (Cours 1 S)
|
Représentation de
Lewis |
Caractéristiques géométriques |
|
|
|
|
Molécule coudée dH – O
≈ 96 pm α ≈ 105 ° |
- L’atome d’hydrogène respecte la règle du
DUET (un doublet
liant).
- L’atome d’oxygène respecte la règle de l’OCTET (deux
doublets liants et deux doublets non liants).
- L’atome d’oxygène est plus électronégatif que l’atome
d’hydrogène.
- Les deux liaisons
H – O sont polarisées.
- Chaque atome d’hydrogène porte une charge partielle
positive
![]() et l’atome
d’oxygène porte une charge partielle négative
2
et l’atome
d’oxygène porte une charge partielle négative
2
![]()

- Conclusion :
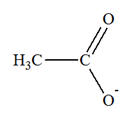
- L’atome d’oxygène constitue un site riche en électrons :
c’est un site donneur de doublet
d’électrons.
- Dans l’éthène (ou éthylène),
H2C
= CH2, la double liaison
C = C est un
site riche en électrons.
- C’est aussi un site donneur de doublet d’électrons.
- Dans un édifice, un atome porteur de doublet(s) non
liant(s) ou porteur d’une charge électrique négative constitue
un site donneur de doublet d’électrons.
- Une liaison multiple constitue aussi un site donneur de
doublet d’électrons.
2)- Site accepteur de doublet
d’électrons.
- L’ion hydrogène provient d’un atome d’hydrogène ayant
perdu un électron.
- L’ion hydrogène
H+ ne possède pas
d’électron et porte une charge électrique positive.
- C’est un
site accepteur de doublet d’électrons.
b)-
La molécule de chlorométhane :
|
Représentation de
Lewis |
Représentation spatiale |
|
|
|
- L’atome de carbone et l’atome de chlore vérifient la
règle de l’octet.
- L’atome de chlore est plus électronégatif que l’atome de
carbone.
- La liaison C – Cl est polarisée.
- L’atome de
carbone porte une charge partielle positive
![]() et l’atome de chlore porte
une charge partielle négative
et l’atome de chlore porte
une charge partielle négative
![]() .
.
- Les liaisons
C – H sont considérées comme non
polarisées.
- L’atome de carbone est appauvri en électrons et constitue
un site accepteur de doublet d’électrons, alors que l’atome de
chlore est un site donneur de doublet d’électrons.
- Dans un édifice, un atome porteur de charge électrique
positive élémentaire (atome appauvri en électrons) constitue un
site accepteur de doublet d’électrons.
III-
Interactions entre site donneur et accepteur
d’électrons.
1)- Mécanisme d’une réaction
chimique.
- À l’échelle microscopique, le passage des réactifs aux
produits peut nécessiter plusieurs réactions ou étapes.
- Ces étapes constituent le mécanisme réactionnel.
- L’étude de l’interaction entre sites donneur et accepteur
de doublet d’électrons permet d’interpréter les étapes d’un
mécanisme réactionnel.
2)- Étude de quelques réactions.
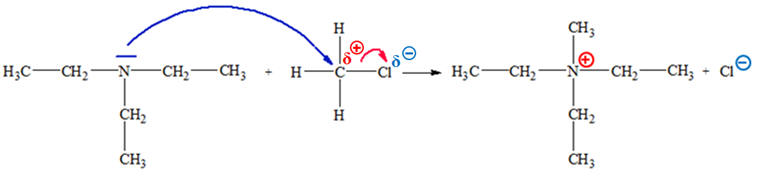
► Réaction entre la N,N-diéthyléthanamine et le
chlorométhane.
- La N,N- diéthyléthanamine :
|
Représentation de
Lewis |
Représentation spatiale |
|
|
|
- L’atome d’azote de l’amine possède un doublet non liant.
- Il constitue un site donneur de doublet d’électrons.
- Le chlorométhane :
|
Représentation de
Lewis |
Représentation spatiale |
|
|
|
- L’atome de carbone
C est appauvri en électrons et
constitue un site accepteur de doublet d’électrons, alors que
l’atome de chlore Cl
est un site donneur de doublet
d’électrons.
► Réaction chimique :
|
(C2H5)3N |
+ |
CH3
– Cl |
→ |
|
+ |
|
► Mécanisme réactionnel :
- La réaction résulte de l’interaction entre le site
donneur de doublet
d’électrons et le site
accepteur
de doublet d’électrons.
|
Flèche courbe (bleue) : - La
flèche courbe (bleue),
orientée du doublet non liant
de l’atome d’azote vers l’atome de
carbone de la molécule |
- Elle permet d’expliquer la formation de la nouvelle
liaison C – N dans le cation obtenu.
- La formation de cette liaison
C – N entraîne
automatiquement la rupture de la liaison
C – Cl afin que
l’atome de carbone respecte la règle de l’OCTET.
|
Flèche courbe (rouge) : - La flèche courbe (rouge) orientée du doublet liant C – Cl vers l’atome de chlore Cl représente le mouvement du doublet d’électrons correspondant : |
- Il se forme alors l’ion chlorure
Cl
–.
b)-
Saponification des esters.
- La réaction de saponification résulte de l’action de
l’ion hydroxyde HO– sur un ester.
- Elle conduit à la formation d’un alcool est d’un ion
carboxylate, base conjuguée d’un acide carboxylique.
- Exemple : saponification de l’éthanoate d’éthyle
► Réaction chimique :
|
|
+ HO– |
→ |
|
+ CH3
– CH2 – OH |
|
Éthanoate d’éthyle |
Ion
hydroxyde |
|
Ion éthanoate |
éthanol |
► Mécanisme réactionnel :
- Le mécanisme de cette réaction comporte plusieurs étapes.
|
Première étape :
|
|
|
Deuxième étape : |
|
|
Troisième étape : |
|
|
|
Réaction acido-basique |
- Remarques :
- L’ion hydroxyde
HO–, porteur de 3
doublets d’électrons non liants,
![]() est un site donneur de
doublet d’électrons.
est un site donneur de
doublet d’électrons.
- L’atome de carbone
C du groupe ester
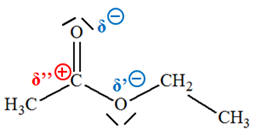 porte une charge partielle
positive car il est lié à deux atomes d’oxygène plus
électronégatifs que lui.
porte une charge partielle
positive car il est lié à deux atomes d’oxygène plus
électronégatifs que lui.
- C’est un site accepteur de doublet
d’électrons.
► Étude de la première étape :
- La
flèche courbe bleue
orientée d’un des doublets non liants de l’ion hydroxyde
vers l’atome de carbone
C du groupe ester représente le
mouvement du doublet correspondant à la formation de la liaison
C – O.
- Comme cet atome de carbone doit respecter la règle de
l’OCTET, la formation de la liaison
C – O entraîne le
basculement de l’un des doublets de la liaison
C = O vers
l’atome d’oxygène.
- Ce mouvement est représenté par la
flèche courbe rouge.
- Le carbone C du groupe ester passe d’une structure
trigonale à une structure tétragonale.
► Étude de la deuxième étape :
- La
flèche courbe bleue
orientée d’un des doublets non liants de l’atome
d’oxygène O (qui porte la charge négative) vers l’atome
de carbone C du groupe ester représente le mouvement du
doublet correspondant à la formation de la double liaison
C =
O.
- Comme cet atome de carbone
C doit respecter la
règle de l’OCTET, la formation de la double liaison
C = O
entraîne le basculement du doublet de la liaison
C – O
vers l’atome d’oxygène (lié au groupe éthyle).
- Ce mouvement est représenté par la
flèche courbe rouge.
- Le carbone C (du groupe ester) passe d’une
structure tétragonale à une structure trigonale.
► Étude de la troisième étape :
- Il s’agit d’un échange de proton entre la molécule
d’acide éthanoïque et l’ion éthanolate (base).
- On obtient un ion carboxylate (ion éthanoate) et un
alcool (éthanol).
- Lors d’une transformation, l’ensemble des réactions qui
se produisent au niveau microscopique constitue le mécanisme
réactionnel.
- Chacune de ces réactions est une étape du mécanisme
réactionnel et résulte de l’interaction entre site donneur et
site accepteur de doublet d’électrons.
- Le mouvement de ce doublet d’électrons peut être
représenté par une flèche courbe, reliant le site donneur au
site accepteur de doublet d’électrons.
- Ces flèches courbes permettent d’expliquer la formation
ou la rupture des liaisons au cours de ces réactions.
► Réaction chimique :
- Équation de la réaction de synthèse de l’aspirine :
|
|
+ |
|
→ |
|
+ |
|
|
Acide salicylique |
|
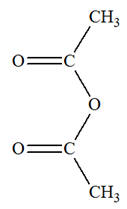
Anhydride éthanoïque |
|
Aspirine |
|
Acide éthanoïque
|
►
Mécanisme réactionnel :
- Dans ce qui suit, on ne fait apparaître que les sites
donneur et accepteur de doublet d’électrons qui participent à la
réaction.
- Le mécanisme de cette réaction comporte plusieurs étapes.
- Première étape :
- Deuxième étape : dissociation.
- Troisième étape : réaction acido-basique.
2)- Exercices :
a)-
Exercice 6 page 313 : Déterminer la polarisation d’une
liaison.
b)-
Exercice 10 page 313 : Localiser des sites donneurs ou
accepteurs.
c)-
Exercice 12 page 314 : Représenter le mouvement des
doublets d’électrons.
d)-
Exercice 15 page 315 : Test à la
DNPH.
e)-
Exercice 18 page 315 – 316 : Hydratation de hex-1-ène.
f)-
Exercice 20 page 317 : Synthèse de l’éthanamide.
|
|