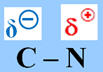|
Transformation en chimie organique : aspect microscopique. |
|
|
|
|
|
|
Transformation en chimie organique : aspect
microscopique :
Pour chaque question, indiquer la (ou les) bonne(s)
réponse(s).
Données :
|
||||||||||||||||||||||||||
|
|
Énoncé |
A |
B |
C |
R |
|||||||||||||||||||||
|
1 |
L’électronégativité d’un atome traduit son aptitude à : |
Former une liaison avec un autre atome. |
Attirer à lui le doublet d’électrons qui le lie à un autre atome. |
Porter des charges partielles négatives. |
BC |
|||||||||||||||||||||
|
2 |
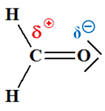
Les polarisations données ci-contre sont-elles correctes ? |
|
|
|
C |
|||||||||||||||||||||
|
3 |
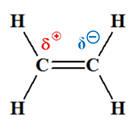
Les polarisations des liaisons multiples ci-contre sont-elles correctes ? |
|
|
|
B |
|||||||||||||||||||||
|
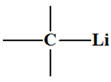
4 |
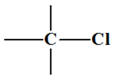
Parmi les atomes de carbone ci-contre, identifier les atomes accepteurs de doublet
d’électrons : |
|
|
|
AC |
|||||||||||||||||||||
|
5 |
L’ion hydrogène H+ est un site : |
Donneur de doublet d’électrons. |
Accepteur de doublet d’électrons |
Ni donneur, ni accepteur de doublet d’électrons. |
B |
|||||||||||||||||||||
|
6 |
L’ion hydrure
un
site : |
Donneur de doublet d’électrons. |
Accepteur de doublet d’électrons |
Ni donneur, ni accepteur de doublet d’électrons. |
A |
|||||||||||||||||||||
|
7 |
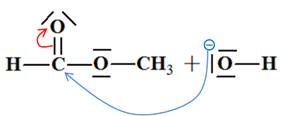
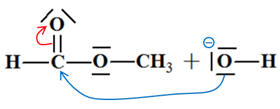
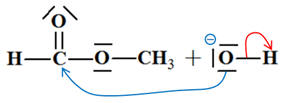
La représentation correcte de la première étape du mécanisme de saponification du méthanoate d’éthyle est : |
|
|
|
B |
|||||||||||||||||||||
|
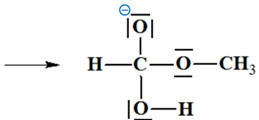
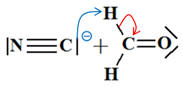
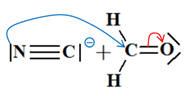
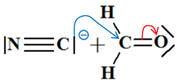
8 |
L’ion cyanure
réagit en une seule étape avec le méthanal pour donner
Cette étape peut s’écrire : |
|
|
|
C |
|||||||||||||||||||||
|
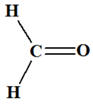
9 |
Dans la molécule de méthanal, l’atome :
|
De carbone porte une charge partielle négative. |
De carbone porte une charge partielle positive. |
D’oxygène porte une charge partielle positive. |
B
|
|||||||||||||||||||||
|
10 |
La liaison
C = O est : |
Chargée. |
Polarisée. |
Non polarisée. |
B |
|||||||||||||||||||||
►
Électronégativité :
-
L’électronégativité d’un
élément traduit la tendance d’un atome
A de cet élément à
attirer le doublet d’électrons d’une liaison covalent qu’il forme
avec un autre atome B.
-
Plus un élément est électronégatif,
plus il attire à lui le doublet d’électrons de la liaison covalent.
►
Liaison covalente polarisée :
-
Une liaison covalente est polarisée
lorsque les deux atomes liés ont des électronégativités différentes.
-
La détermination de la polarisation d’une liaison
A –
B se fait en attribuant à l’atome le plus électronégatif une
charge partielle négative
![]() et à l’atome le moins électronégatif une charge partielle
positive
et à l’atome le moins électronégatif une charge partielle
positive
![]() .
.
►
Site donneur de doublet
d’électrons :
-
Dans un édifice, un atome porteur de
doublet(s) non liant(s) ou porteur d’une charge électrique négative
constitue un site donneur de doublet d’électrons.
-
Une liaison multiple constitue aussi
un site donneur de doublet d’électrons.
►
Site accepteur de doublet
d’électrons :
-
Dans un édifice, un atome porteur de
charge électrique positive élémentaire (atome appauvri en électrons)
constitue un site accepteur de doublet d’électrons.
►
Mécanisme réactionnel :
-
Lors d’une transformation, l’ensemble
des réactions qui se produisent au niveau microscopique constitue le
mécanisme réactionnel.
-
Chacune de ces réactions est une
étape du mécanisme réactionnel et résulte de l’interaction entre
site donneur et site accepteur de doublet d’électrons.
-
Le mouvement de ce doublet
d’électrons peut être représenté par une flèche courbe, reliant le
site donneur au site accepteur de doublet d’électrons.
-
Ces flèches courbes permettent
d’expliquer la formation ou la rupture des liaisons au cours de ces
réactions.
-
La réaction résulte de l’interaction
entre le site
donneur de
doublet d’électrons et le site
accepteur
de doublet d’électrons.
►
Saponification du méthanoate
d’éthyle :
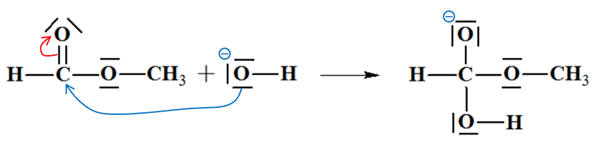
►
Molécule de méthanal :
-
L’atome d’oxygène est plus
électronégatif que l’atome de carbone.
-