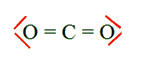|
Chim. N° 03 |
Des atomes aux molécules. Cours. |
|
|
Mots clés : Molécules, gaz nobles, gaz rares, des atomes aux molécules, formation des molécules, stabilité chimiques des gaz nobles, liaison covalente, règles du Duet, règle de l'octet, duet, octet, représentation de Lewis, Lewis, géométrie de molécules, doublets d'électrons, doublets d'électrons liants, doublets d'électrons non liants, méthane, ammoniac, eau, isomérie, Z, isomérie E, zusammen, entgegen, stéréo-isomérie, photo-isomérisation, exercices, QCM, ... |
|
|
|
1)- Stabilité chimique des gaz
nobles. |
|
II- Géométrie de quelques
molécules. 1)- Géométrie et doublets
d’électrons. 2)- Exemples : les molécules
de méthane, d’ammoniac et d’eau. |
|
Pour aller plus loin :
Les molécules ont été réalisées avec
ChemSketch |
|
|
|
Exercices : énoncé avec correction a)- Exercice 6 page 106. Prévoir le nombre de doublets liants. b)- Exercice 10 page 106. Placer des doublets non liants. c)- Exercice 11 page 106. Établir des représentations de Lewis. d)- Exercice 14 page 107. Identifier un isomère. e)- Exercice 17 page 107. Un colorant orangé. f)- Exercice 21 page 109. Des odeurs végétales. g)- Exercice 23 page 109. La vitamine A. |
1)- Stabilité chimique des gaz nobles.
- De façon générale, les atomes des éléments restent rarement isolés :
- Ils peuvent former des molécules ou des cristaux ioniques.
- Ils peuvent participer à des réactions chimiques, former des ions, des molécules.
- À l’état naturel, les éléments tels que l’hélium He, le néon Ne, l’argon Ar, le krypton Kr,… existent à l’état atomique.
- Ils ne participent quasiment pas à des réactions chimiques, ne forment pas de molécules ou d’ions.
- On les appelle les gaz nobles ou les gaz rares. Ce sont des gaz monoatomiques.
- Ils sont gazeux dans les conditions ordinaires de température et de pression.
- Structure électroniques des premiers gaz nobles :
|
Z |
Premiers gaz
nobles |
Structure
électronique La couche électronique externe
apparaît en rouge |
|
2 |
He (Hélium) |
K
(2) |
|
10 |
Ne (Néon) |
K (2) L (8) |
|
18 |
Ar (Argon) |
K (2) L (8) M (8) |
|
36 |
Kr (Krypton) |
K (2) L (8) M (18) N (8) |
- Cette stabilité chimique est liée au fait que leur dernière couche électronique (couche électronique externe) est saturée (pleine).
- Exemple : la couche électronique externe de l’hélium He contient 2 électrons (couche K qui est saturée à 2 électrons.
- Les autres gaz rares possèdent 8 électrons sur leur couche électronique externe.
- On parle de structure en DUET : atome ou ion qui possède 2 électrons sur sa couche électronique externe K.
- Et de structure en OCTET : atome ou ion qui possède 8 électrons sur sa couche électronique externe.
- Lorsqu’ils forment des molécules, les atomes mettent en commun certains des électrons de leurs couches électroniques externes de façon à s’entourer de 2 ou 8 électrons.
- En conséquence, dans une molécule, les atomes sont liés par des liaisons covalentes ou des liaisons de covalence.
► La liaison covalente :
- La liaison covalente consiste à la mise en commun par deux atomes d’un ou plusieurs doublets d’électrons appelés doublets de liaison ou doublets liants.
- Remarque : les électrons mis en commun appartiennent à chacun des deux atomes et doivent être pris en compte dans le total des électrons de chaque atome.
- En formant des liaisons de covalence, chaque atome acquiert, en général, une structure électronique en octet ou en DUET, semblable à celle du gaz noble qui le suit dans la classification périodique.
- Le nombre de liaisons covalentes qu’établit un atome est généralement égal au nombre d’électrons qui lui manque pour acquérir une structure électronique en OCTET ou DUET.
3)- Règles du DUET et de l’OCTET.
|
► Règles : - Au cours des transformations chimiques, les atomes tendent à acquérir la structure électronique du gaz rare de numéro atomique le plus proche : - Soit 2 électrons sur la couche électronique externe lorsque ce gaz rare est Hélium c’est la règle du DUET. - Soit 8 électrons sur la couche électroniques externe, c’est la règle de l’OCTET. - Ils acquièrent de ce fait une stabilité maximale. - Chaque liaison formée permet à l’atome de gagner un électron sur sa couche électronique externe. |
- Tableau ; cas des atomes que l’on rencontre souvent
|
Atome |
H |
C |
N |
O |
|
Numéro atomique Z |
1 |
6 |
7 |
8 |
|
Formule électronique |
K1 |
K2 L4 |
K2 L5 |
K2 L6 |
|
Nombre d’électron manquant à l’atome Pour acquérir une structure stable |
1 |
4 |
3 |
2 |
|
Nombre de doublets liants formés pour chaque atome |
1 |
4 |
3 |
2 |
4)- Représentation de Lewis d’une molécule.
-
La représentation de
LEWIS précise l’enchaînement
des atomes et la position des doublets liants et non liants.
-
Dans la représentation de
LEWIS
d’une molécule :
-
Le symbole de l’élément représente le noyau de l’atome et
les électrons internes,
-
Chaque doublet d’électrons externes est figuré par un
tiret.
-
On distingue les doublets liants et les doublets non
liants :
-
Un doublet liant est représenté par un tiret entre les
symboles de deux atomes,
-
Un doublet non liant est représenté par un tiret situé
autour du symbole d’un atome auquel il appartient.
- Une liaison simple est notée A – B, une liaison double A = B et une liaison triple A ≡ B.
► Application :
-
Donner la représentation de LEWIS des molécules
suivantes : H2,
HCl,
O2,
CO2.
- Réponse :
-
Une méthode : il en existe d’autres.
|
Écrire la formule brute de la molécule |
CO2 |
|
Écrire la représentation électronique de chaque atome. |
C : K2L4 et O : K2L6 |
|
Déterminer le nombre d’électrons manquant à chaque atome pour acquérir une structure stable |
ne (C) = 4 (structure stable en OCTET) ne (O) = 2 (structure stable en OCTET) |
|
Nombre maximal de liaisons que peut établir chaque atome |
nℓ (C) = 4 ; 4 liaisons nℓ (O) = 2 : 2 liaisons |
|
Placer entre les atomes, autant de doublets liants que possible (il faut respecter les valeurs trouvées précédemment) |
O = C = O |
|
Pour chaque atome, déterminer le nombre d’électrons de la couche externe qui ne sont pas engagés dans un doublet liant : |
L’atome d’oxygène possède 6 électrons sur sa couche électronique externe. Deux électrons sont engagés dans deux liaisons covalentes. Il possède 4 électrons non liants L’atome de carbone possède 4 électrons sur sa couche électronique externe. Ces 4 électrons sont engagés dans les 4 liaisons covalentes. L’atome de carbone ne possède pas d’électrons non liants. |
|
Nombre de doublets non liants entourant chaque atome : |
L’atome d’oxygène possède 2 doublets d’électrons non liants. L’atome de carbone ne possède pas de doublets d’électrons non liants. |
|
On place les doublets non liants autour de chaque atome et on vérifie que les règles du DUET et (ou) de l’OCTET sont respectées. |
|
►
Cas de molécules complexes :
L'acide nitrique HNO3
II- Géométrie de quelques molécules.
1)- Géométrie et doublets d’électrons.
- La structure spatiale d’une molécule correspond à celle dans laquelle les doublets d’électrons, liants et non liants s’écartent au maximum les uns des autres afin de minimiser au maximum leurs répulsions.
-
Cas de quatre doublets :
-
Pour minimiser leurs répulsions mutuelles, quatre
doublets adoptent une disposition tétraédrique
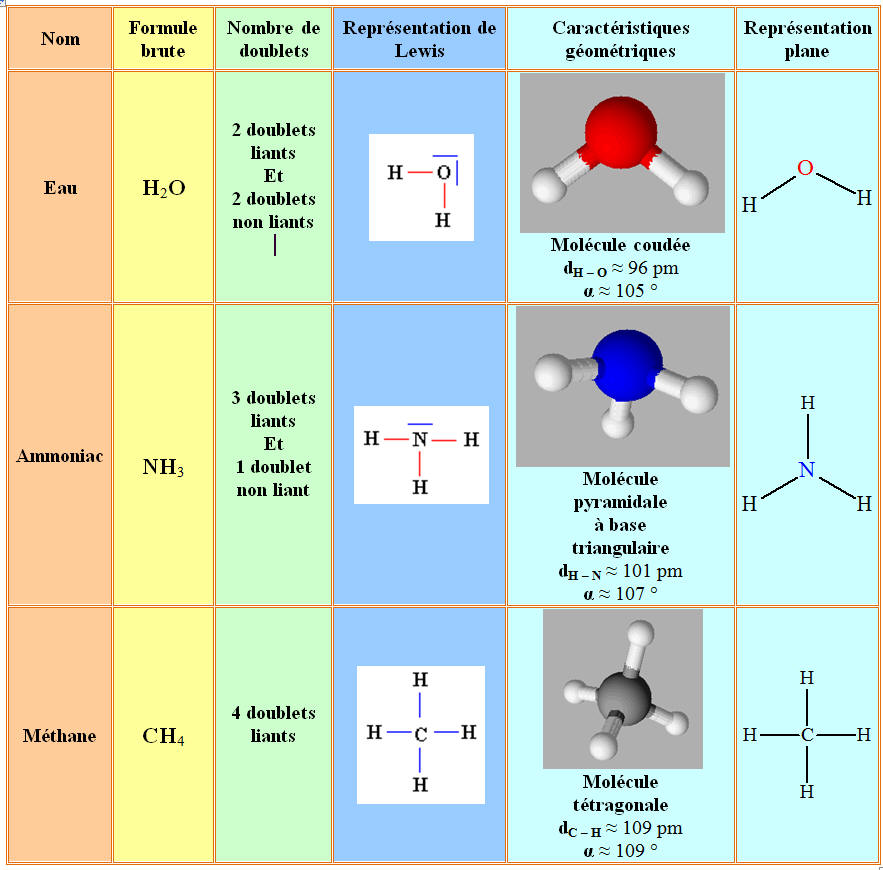
2)- Exemples : les molécules de méthane, d’ammoniac et d’eau.
-
Tableau : les molécules ont été réalisées avec le
logiciel
ChemSketch

- Pour les molécules d’eau, d’ammoniac et de méthane la répulsion des doublets impose une disposition tétraédrique pour quatre doublets se repoussant dans la molécule.
- Les différences proviennent du fait que la répulsion des doublets non liants est plus importante que la répulsion des doublets liants.
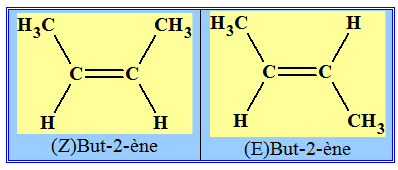
1)- L’isomérie Z et E ou stéréo-isomérie.
- Autour d’une simple liaison carbone – carbone, C – C, il y a libre rotation alors qu’il n’existe pas de libre rotation autour d’une double liaison carbone – carbone, C = C.
► Application :
- Que peut-on dire des molécules suivantes ? Les nommer.
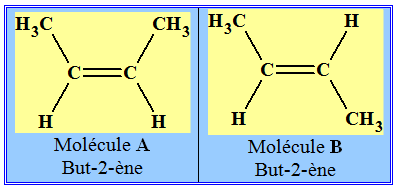
- Les molécules A et B différent par la position, par rapport à l’axe de la double liaison, des deux atomes d’hydrogène.
- Les deux molécules ne sont pas superposables.
- Pour passer de la molécule A à la molécule B, il faut rompre certaines liaisons et en reformer d’autres.
- Il n’y a pas libre rotation autour d’une double liaison carbone ‑ carbone C = C.
- Les molécules A et B sont des molécules distinctes que l’on peut séparer.
-
La température d'ébullition normale du (Z)-but-2-ène est
de
- Les molécules A et B sont des stéréo-isomères.
- On dit que le but-2-ène existe dans deux configurations :
- La configuration Z (de l'allemand zusammen : ensemble) où les deux atomes d’hydrogène sont situés du même côté de la double liaison,
- et la configuration E (de l'allemand entgegen : opposé) où les deux atomes d’hydrogène sont situés de part et d'autre de la double liaison.
|
Définition : - Si, dans un alcène de formule générale CHX = CHY, les deux atomes d’hydrogène sont dans le même demi-plan par rapport à l’axe de la double liaison C = C, le stéréo-isomère est Z, dans le cas contraire, il est E. |
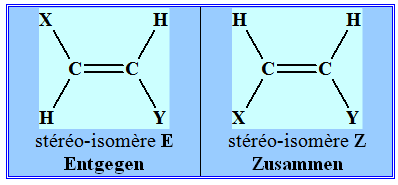
- Cas du but-2-ène :
3)- Passage d’un isomère à l’autre.
- Pour passer d’un isomère à l’autre, il faut rompre la double liaison C = C.
- Pour réaliser cela, il faut fournir de l’énergie.
- Ceci peut être réalisé grâce à une radiation électromagnétique convenable.
- En éclairant convenablement un isomère Z (ou E), il est parfois possible de rompre la double liaison et d’obtenir l’isomère E (ou Z).
- C’est une photo-isomérisation.
1)- QCM : Pour chaque question, indiquer la (ou les) bonne(s) réponse(s).
|
|
2)- Exercices : Exercices : énoncé avec correction
a)- Exercice 6 page 106. Prévoir le nombre de doublets liants.
b)- Exercice 10 page 106. Placer des doublets non liants.
c)- Exercice 11 page 106. Établir des représentations de Lewis.
d)- Exercice 14 page 107. Identifier un isomère.
e)- Exercice 17 page 107. Un colorant orangé.
f)- Exercice 21 page 109. Des odeurs végétales.
g)- Exercice 23 page 109. La vitamine A.
|
|